PA3573基因的结构功能预测及其在抗鲎素菌株中表达分析
洪 军,田佳雯,叶延欣,胡建业,黄玮玮,韩雨燕
(河南城建学院 生命科学与工程学院,平顶山 467036)
铜绿假单胞菌(Pseudomonasaeruginosa)作为一种人畜共患条件性致病菌,是医院感染的三大致病菌之一。它容易形成生物膜,并对多种抗生素具有耐受性。因此,预防与治疗铜绿假单胞菌的感染是医学界迫切需要解决的问题之一。有些细菌通过膜蛋白的主动外排系统能把抗菌肽有效地挤出体外,如大肠杆菌AcrAB-TolC及铜绿假单胞菌MexCD-oprJ等均在细菌抵抗抗菌肽中发挥重要作用[1]。铜绿假单胞菌生物膜对Colistin的抗性可能主要与pmr操纵子介导的脂多糖修饰和mexAB-oprM外排泵有关[2]。越来越多的研究发现,药物外排泵不仅可以通过外排药物实现细菌药物耐受,还可以通过促进生物膜的形成进一步增加药物耐受。此外,药物外排泵与其他外膜蛋白之间存在调控网络,协同发挥作用[3-4]。通过耐药泵将药物排出是铜绿假单胞菌抗生素耐药最主要的机制之一,尤其是多重耐药泵,能外排多种结构迥异的药物或对细菌代谢有毒性的化合物。主要易化子超家族(Major Facilitator Superfamily,简称MFS)也是铜绿假单胞菌中重要的外排系统之一。MFS是一个重要的次级膜转运蛋白超家族,该家族在铜绿假单胞菌的物质交换、能量代谢、致病性、毒力和耐药性等方面发挥着重要作用[5]。
鲎素是1988年由NAKAMURA等[6]从海洋动物鲎的鲎血细胞酸性提取物中分离出来的一种小分子阳离子抗菌肽,具有广谱抗菌活性。鲎素对铜绿假单胞菌具有很好的抑菌活性,并能抑制生物膜的形成[7]。在实验室条件下通过长期连续增高鲎素浓度诱导(大于60代),铜绿假单胞菌CGMCC 1.2620菌株能对鲎素产生不同程度的耐药性,通过对铜绿假单胞菌 99-2和60-2抗鲎素突变株与出发菌株的转录组测序对比分析,发现许多基因(含PA3573基因)在不同抗鲎素的突变株中有明显的差异表达[8-9]。经生物信息学比对分析发现,PA3573基因编码蛋白与铜绿假单胞菌Bcr/CflA亚家族同源性为100%,该基因编码蛋白属于多药抗性转运蛋白。因此,本研究通过PA3573基因编码蛋白的结构功能预测、与配体鲎素肽作用方式以及在抗鲎素铜绿假单胞菌中的差异表达情况分析,为阐明PA3573基因编码蛋白在铜绿假单胞菌中的作用提供一定的理论依据。
1 材料与方法
1.1 主要材料
铜绿假单胞菌CGMCC 1.2620(PA1.2620)出发菌株;抗鲎素菌株PA-60、PA-99(本实验室通过长期增高鲎素浓度条件下分别诱导60代和99代获得的抗鲎素菌株);鲎素是含有17个氨基酸残基的阳离子抗菌肽,其中所含的两对二硫键分别存在于C3和C16、C7和C12之间。
1.2 实验方法
1.2.1 铜绿假单胞菌PA3573基因的结构及功能预测
通过对铜绿假单胞菌CGMCC 1.2620进行2代+3代全基因组测序,获得PA3573基因序列及编码蛋白序列。使用NCBI、Expasy Proparm、Expasy ProtScale、SignalP-4.0server、TMHMM Server v.2.0、NetPhos 3.1 server、interPro:Protein sequence analysis &classification、STRING:functional protein association networks等[10-11]在线工具分别对PA3573基因编码蛋白进行结构及功能预测。在NCBI官网使用Blastp工具将PA3573基因编码的氨基酸序列与不同物种氨基酸序列作对比,选取与目标蛋白有较高相似度的氨基酸序列构建进化树[12]。
1.2.2PA3573基因在铜绿假单胞菌对鲎素抗药性中差异表达情况分析
通过对铜绿假单胞菌PA1.2620和PA-99、PA-60突变株进行转录组测序(RNA-seq),利用DESeq软件进行差异表达分析,基因表达量的计算使用RPKM(Reads Per Kilobase of transcript per Million fragments mapped)法。将Fold Change≥2且FDR(错误发现率)<0.01作为筛选差异表达基因的标准。挑选编码MFS家族转运蛋白差异表达基因,并对PA3573基因用qPCR法进行差异表达情况验证分析[8]。
1.2.3 PA3573蛋白与鲎素肽进行分子对接的模拟实验
使用AutoDockTools v4.2.6(http://autodock.scripps.edu/)和Vina program进行分子对接和能量分析。以预测的PA3573编码蛋白结构为受体,鲎素为配体,在预处理过程中,添加氢原子并手动将其调整为坐标文件中受体和配体的已知质子化状态。使用默认参数计算扭转分支的中心和配体的扭转自由度。将受体坐标分为刚性部分和柔性侧链。最后,将一个包含所有可移动氨基酸的大网格框设置为参数,然后使用默认的极性值运行Vina程序。
2 结果与分析
2.1 铜绿假单胞菌PA3573基因的结构及功能预测分析
通过对PA3573编码蛋白质的理化性质、信号肽、跨膜结构、蛋白质相互作用及序列同源性进行分析,了解PA3573基因编码蛋白的生理功能、与其他蛋白的相互作用以及潜在的与其他物种的亲缘关系,为后续研究该基因的功能提供一定参考。
2.1.1 PA3573蛋白理化性质分析
使用Proparm在线工具对PA3573蛋白的理化性质进行分析,结果表明:PA3573基因编码392个氨基酸,相对分子质量为40 942.54,等电点为8.75;几种含量较高的氨基酸占比分别为丙氨酸(Ala)17.1%,甘氨酸(Gly)11.2%,亮氨酸(Leu)16.3%,缬氨酸(Val)6.4%;氨基酸残基的总电荷为正电荷总数20,负电荷总数15,则该蛋白可能带正电;结构式为 C1897H2970N484O486S19;假设所有Cys残基都是胱氨酸时的消光系数为67 880;该蛋白在不同的生物体内半衰期不同;脂肪族指数为121.15;预测蛋白质的不稳定指数为34.60,所以预测目标蛋白为稳定蛋白;推测该蛋白质为碱性带正电的、稳定的疏水性蛋白质。
2.1.2 PA3573蛋白疏水性分析
使用在线工具ProtScale预测,发现PA3573基因编码氨基酸序列中亲水性最强的位点是第372位的组氨酸,分值为2.956,疏水性最强的位点是第386位的脯氨酸,分值为-1.967。该氨基酸序列中疏水区域多于亲水区域(见图1(a)),据此推断该氨基酸属于疏水性蛋白。
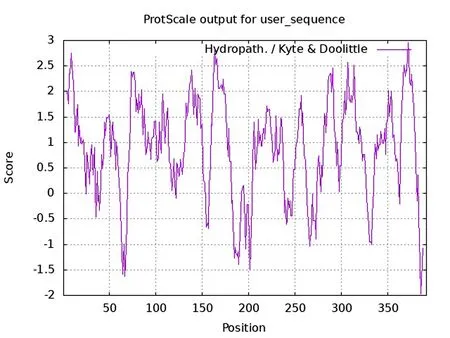
(a)蛋白的疏水性预测
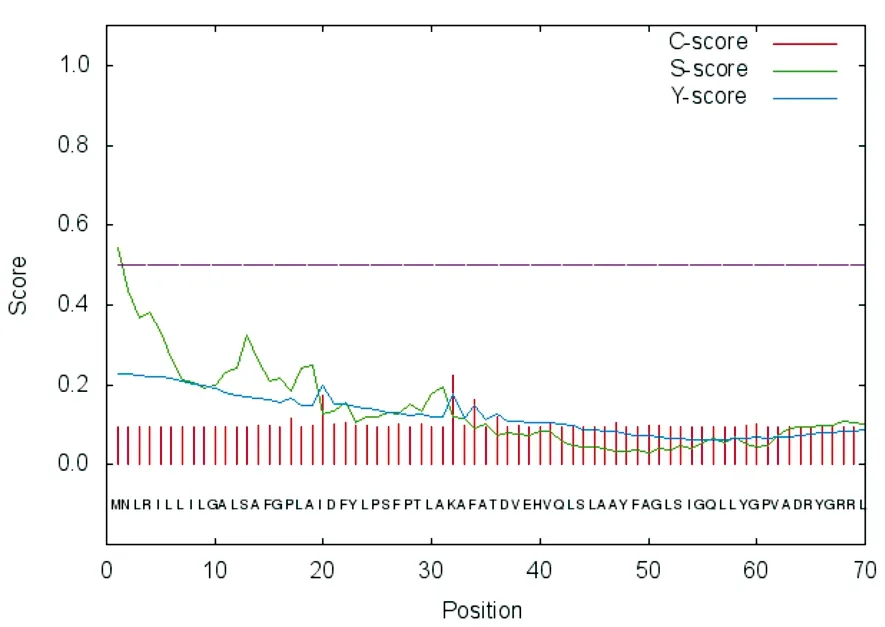
(b)蛋白的信号肽预测
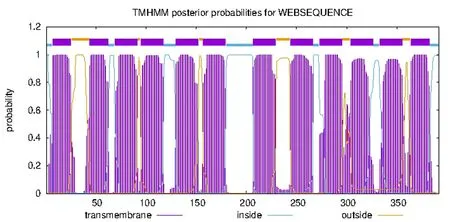
(c)蛋白的跨膜区预测

(d)蛋白的磷酸化位点预测图1 PA3573基因编码蛋白的结构功能预测分析图
2.1.3 PA3573蛋白的信号肽预测分析
使用SignalP 4.0 severs在线工具预测PA3573蛋白质中的信号肽(见图1(b))。前100个氨基酸中最大C评分在第32位氨基酸,评分为0.224;最大S评分在第1位氨基酸,评分为0.544;最大Y评分在第1位氨基酸,评分为0.227。可能的平均信号肽S值评分为0,可能的信号肽D评分为0.143。证明PA3573蛋白没有信号肽,是非分泌蛋白,与TMHMM Server v.2.0预测结果相符。
2.1.4 PA3573蛋白跨膜区预测分析
预测跨膜螺旋中氨基酸的数量为263.922 74,前60个氨基酸中,含跨膜螺旋的氨基酸数为40.320 94,N端位于膜的细胞质侧的总概率为0.997 06。PA3573可能跨膜螺旋区有12个,多肽链跨膜区分别位于氨基酸5-27、40-62、69-91、95-117、130-152、157-179、207-229、244-266、273-295、300-322、335-357、361-383,表明PA3573是跨膜蛋白(见图1(c))。
2.1.5 PA3573蛋白磷酸化位点预测分析
通过NetPhos 3.1 server 预测发现PA3573蛋白存在多个潜在的磷酸化位点(见图1(d))。评分超过0.500阈值的为可能的磷酸位点,共21个,其中评分较高的磷酸化位点有第384位(0.918,Thr)、第231位(0.787,Tyr)和第53位(0.685,Ser)等,前两者为非特异性激酶磷酸化位点,后者为蛋白激酶A的磷酸化位点。评分较低的磷酸化位点多数可能为周期蛋白、磷酸激酶C和肌酸激酶II等的磷酸化位点。
2.1.6 PA3573蛋白结构域的预测分析
使用interPro在线工具预测 PA3573蛋白家族和结构域如图2(a)所示。PA3573蛋白属于主要协同转运超家族MFS和耐药转运体Bcr/CmlA亚家族的成员。MFS的靶向底物十分广泛,包括离子、碳水化合物、脂类、氨基酸、多肽、核苷和其他双向跨膜的小分子。在许多情况下,通过将储存在电化学梯度中的能量转化为底物的浓度梯度,进而催化活性运输。MFS家族可以分为若干亚家族,在MFS的每一类亚家族中都存在特异性多药转运蛋白,能介导特异性药物外排。耐药转运体Bcr/cflA蛋白有12个跨膜区。已知活性的成员包括大肠杆菌中的Bcr(双环霉素抗药性蛋白)、沙门氏菌中的Flor(氯霉素和氟苯尼耐药性)及假单胞菌R1033上发现的CmlA(氯霉素抗药性)。
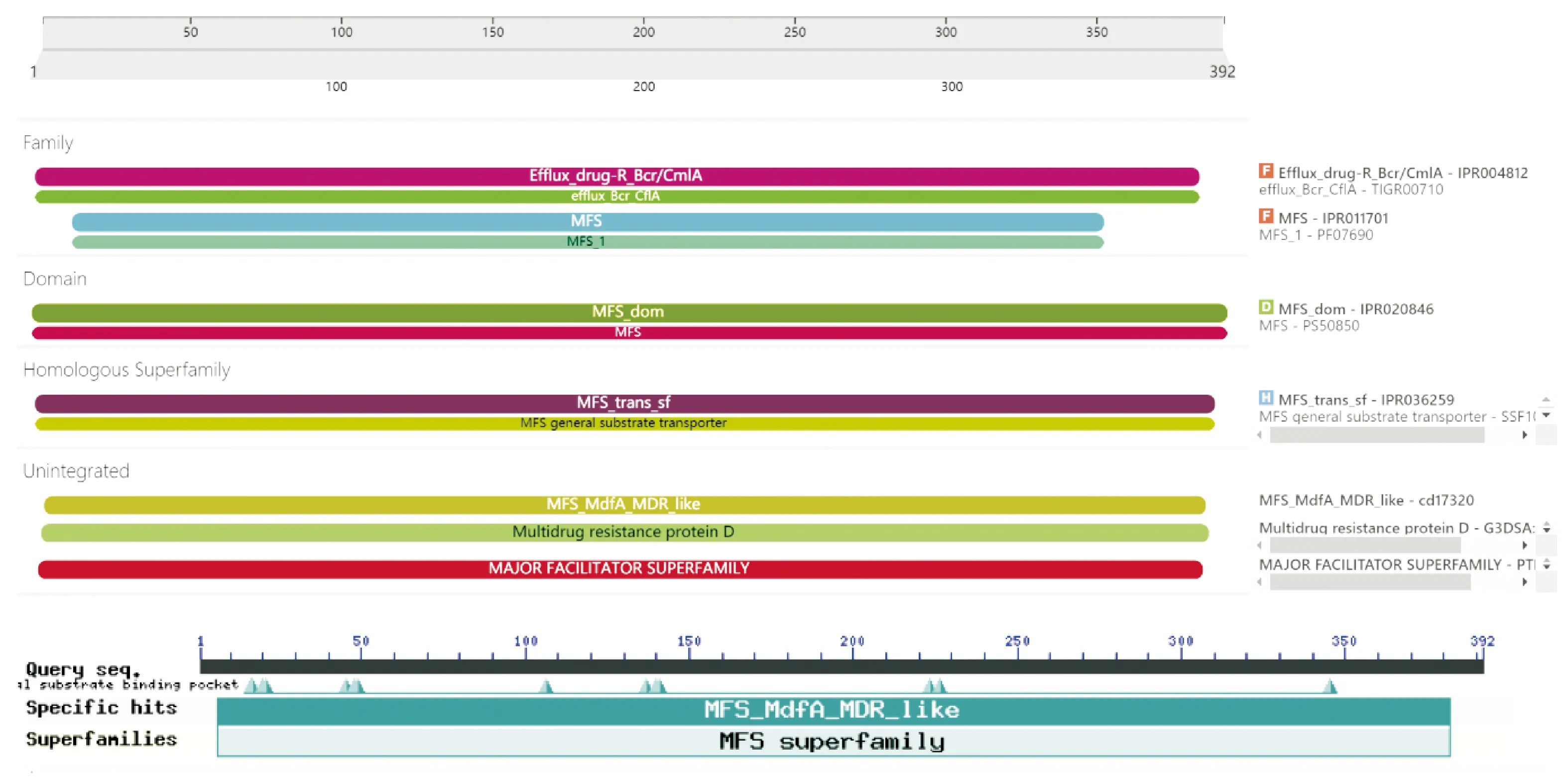
(a)蛋白家族和结构域预测

(b)与其他蛋白质的相互作用预测

(c)蛋白进化树构建
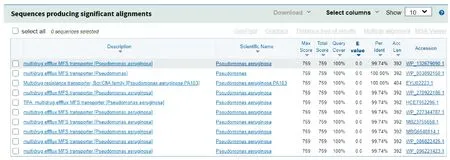
(d)蛋白同源性分析图2 PA3573基因编码蛋白的结构功能预测及进化树图
2.1.7 PA3573蛋白相互作用的预测分析
使用STRING在线工具预测与PA3573相互作用的蛋白质,结果如图2(b)所示:PA3573蛋白与pbuE、DR97-4591、DR97-5754互为基因共现;与DR97-4591互为共表达基因。
2.1.8 PA3573蛋白同源性分析及系统进化树构建
在NCBI官网使用blastp工具将PA3573基因编码的氨基酸序列进行分析,发现与铜绿假单胞菌的多药耐药转运体(Multidrug resistance transporter)Bcr/CflA 家族同源性为100%,与铜绿假单胞菌Multidrug efflux MFS transporter等同源性达99%以上,如图2(d)所示。与不同物种氨基酸序列作对比,选取与目标蛋白有较高相似度的氨基酸序列,采取邻位连接法构建系统进化树,与阴沟肠杆菌(Enterobactercloacae)、大肠杆菌(Escherichiacoli)等菌株有较近的亲缘关系(见图2(c))。
2.2 PA3573基因在铜绿假单胞菌对鲎素抗药性中差异表达情况分析
在铜绿假单胞菌抗鲎素突变株PA-99与出发菌株PA1.2620的1 459个差异表达基因中,发现31个编码MFS家族转运蛋白基因发生差异表达,其中15个表达上调基因和16个表达下调基因,但是这些基因的表达量相对偏低,均不属于高表达的基因(见图3)。经功能注释及抗生素抗药性基因预测,发现疑似编码多药转运蛋白基因(PA3137、PA1316、PA3573)差异表达。而PA3573基因在铜绿假单胞菌抗鲎素突变株PA-99、PA-60与原始菌株PA1.2620中显著差异表达如图4所示(该部分结果已报道)。此结果表明,编码MFS转运蛋白基因包括PA3573基因在鲎素耐药中也发挥着重要作用。

图3 高抗鲎素突变株PA-99和原始菌株中MFS超家族基因转录表达分析

图4 PA3573基因铜绿假单胞菌在抗鲎素突变株PA-99、PA-60与原始菌株的转录表达分析
2.3 PA3573蛋白与鲎素肽进行分子对接的模拟实验
为了进一步探究PA3573编码蛋白与鲎素的结合位点与结合情况,进行了分子对接模拟实验。结果如图5(a)、图5(b)所示,受体蛋白PA3573基本由α-螺旋组成,且鲎素与受体蛋白PA3573结合的位置在蛋白空腔,更加有利于蛋白对配体发挥作用。进一步将对接结果二维可视化之后(见图5(c)),受体蛋白PA3573的N19、N20、N21、N23、N24、N25、N26、N27、N30、N31、N32、N33、N34、N35、C50、C51、C52、C57等38个原子与鲎素通过形成氢键相互作用,此外,Ala127、Leu133、Met134、Pro141等17个氨基酸与鲎素之间具有疏水作用。这些结果将为分析蛋白PA3573的结构功能及与鲎素的相互作用关系提供一定的参考价值,进而对活性位点的确定及改造提供一定的方向。
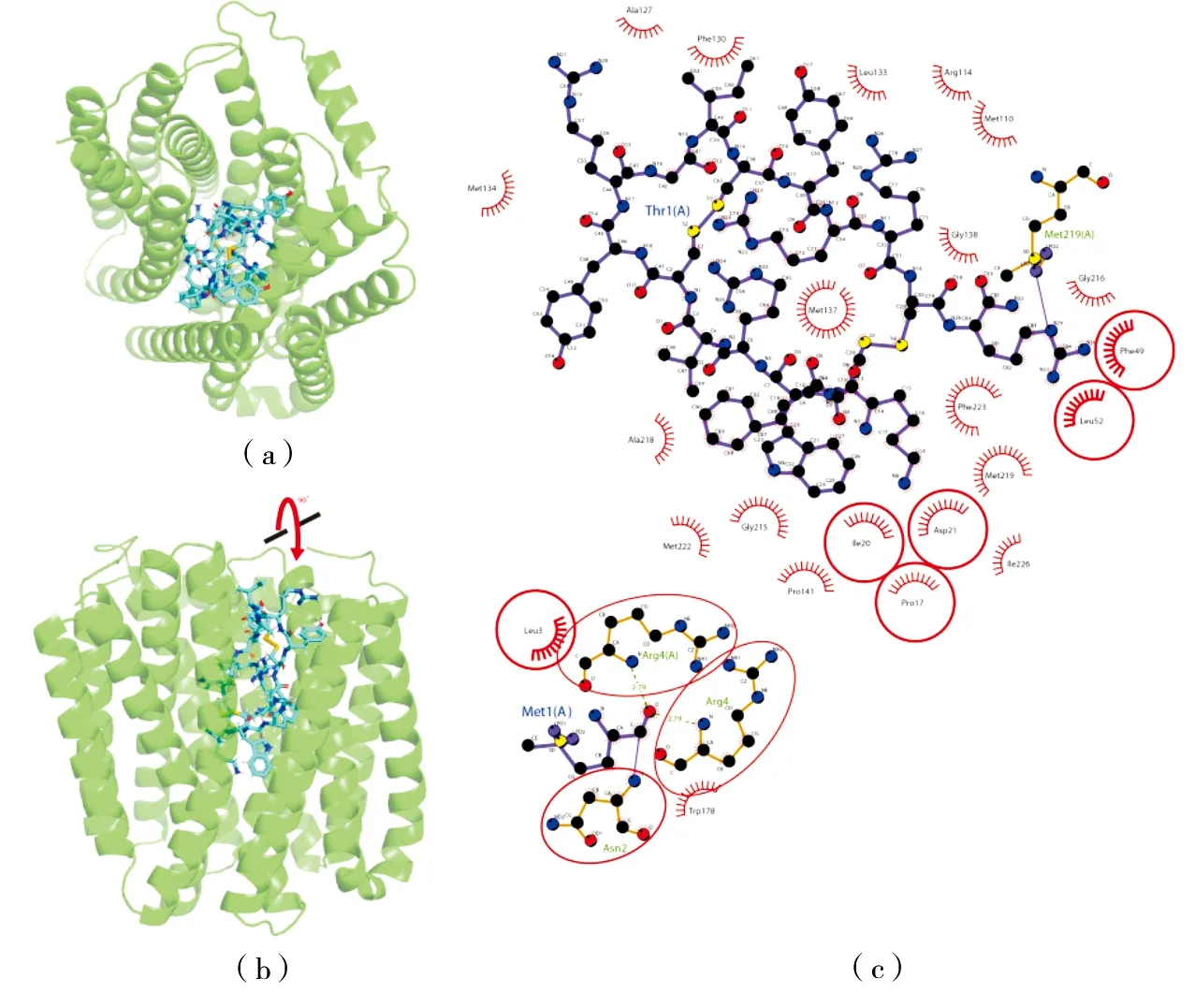
图5 PA3573蛋白与鲎素抗菌肽分子对接的模拟实验图
3 结论
通过对铜绿假单胞菌CGMCC 1.2620PA3573基因编码蛋白性质、结构域、与其他蛋白相互作用以及进化树进行分析,预测出该基因编码蛋白的理化性质及功能,并推测PA3573基因可能编码一种MFS外排转运蛋白。这种蛋白在铜绿假单胞菌抗鲎素突变株中差异表达,且该受体蛋白与鲎素结合的位置在蛋白空腔。在这个过程中有38个氨基酸与鲎素通过形成氢键相互作用,同时还有17个氨基酸与鲎素之间具有疏水作用。本结果为PA3573基因在铜绿假单胞菌中的作用研究提供一定的理论依据。

