低温风干发酵羊腿中优势乳酸菌的分离、筛选及鉴定
马依努尔·米吉提,茹克叶木·阿不力米提,力俊琛,巴吐尔·阿不力克木
(新疆农业大学 食品科学与药学学院,新疆 乌鲁木齐 830052)
羊火腿是我国传统的腌腊肉制品,羊后腿肉经腌制、风干、成熟而成,具有低脂肪、高蛋白的特点[1]。由于风干成熟期较长,羊火腿中的肌肉内源酶会影响肌肉蛋白和脂肪产生大量的小分子多肽、游离氨基酸、游离脂肪酸等易被人体消化吸收的物质,深受广大消费者的喜爱。自然发酵肉制品中的优良菌株被宝贵自然菌种资源利用[2]。传统发酵香肠主要用原料肉本身带有的微生物经自然发酵而成,不仅不能保证发酵肉制品的稳定性和安全性,而且发酵时间也较长[3]。优良发酵剂在发酵肉制品加工中起重要作用,发酵菌种能缩短发酵肉制品的发酵时间及生产周期[4]。研究显示,分离和筛选优良菌株作为发酵剂能保证产品品质,并能减少有害物质的形成[5],已成为发酵剂的主要研究热点。
近年来,对乳酸菌的研究集中于发酵泡菜、乳制品和发酵肉制品等食品领域[6],其中发酵香肠在微生物的作用下,会发生一系列的化学反应,将食品原料转化为具有独特风味,并且保质期长的发酵肉制品[7]。另外,乳酸菌可以有效减少食品中亚硝酸盐残留量[8],改善感官品质。李建等[9]从自然发酵香肠及泡菜水中分离出4 株优良乳酸菌。Papamanoli 等[10]对发酵香肠中的乳杆菌的抑菌效果进行研究,发现80 株乳酸菌均表现出对食品致病菌的有效抑制作用。沈清武[11]的研究结果表明,发酵剂与香肠质构特性有关联,如戊糖乳杆菌能改善香肠的咀嚼性、硬度和黏聚性,还能提升发酵香肠的感官品质。
本研究旨在从低温风干发酵羊腿中分离出适用于发酵香肠的优良乳酸菌菌株,并检测其产接触酶、产氨、产黏液等发酵特性,以及48 h 产酸能力和不同条件(温度、NaCl、NaNO2)下的生长情况等加工特性,筛选出产酸快、发酵特性良好,保障香肠安全性的同时改善发酵香肠品质的优良乳酸菌菌株,以期为发酵香肠接种发酵提供优良菌株。
1 材料与方法
1.1 材料与试剂
1.1.1 试验样品
低温风干发酵羊腿:新疆农业大学农产品加工实验室制作保存;大肠杆菌、金黄色葡萄球菌:新疆农业大学动物医学学院提供,菌种保存于新疆农业大学食品科学与药学学院畜产品实验室。
1.1.2 培养基与试剂
MRS 琼脂培养基、MRS 肉汤培养基:北京奥博星生物技术有限责任公司;耐亚硝酸盐培养基、耐盐性培养基、氨基酸脱羧酶培养基、产黏液培养基、产H2S 培养基、精氨酸产氨培养基、葡萄糖产气培养基、检测过氧化氢酶培养基:参考凌代文等[12]的配制方法。
革兰氏染色试剂盒、细菌基因组提取DNA 试剂盒、微量生化鉴定管、3%过氧化氢溶液、ddH2O,2×Taq PCR Green Mix、核酸染料、DNA Buffer:北京索莱宝科技有限公司;蛋白酶K(≥500 U/mg)、DNA 分子量标准Marker(100~2 000 bp)、溶菌酶(≥700 U/mg):生工生物工程(上海)股份有限公司;脱脂奶粉:纽瑞滋(上海)食品有限公司;氯化钠、亚硝酸钠、丙三醇(均为分析纯):天津市鑫铂特化工有限公司。
1.2 仪器与设备
SW-CJ-1FD 超净工作台:上海博迅医疗生物仪器股份有限公司;DSX-30L-l 立式压力蒸汽灭菌锅:上海申安医疗器械厂;2720 thermal cycler 聚合酶链式反应(polymerase chain reaction,PCR)仪:伯乐生命医学产品(上海)有限公司;DYY-12 电泳仪:北京六一生物科技有限公司;LC-LX-HL210D 台式离心机:湖南力辰仪器科技有限公司;DHP-9162 电热恒温培养箱、HH-4 水浴锅:上海一恒科学仪器有限公司;MSD106 显微镜:迈时迪(东莞)科技有限公司;UV1800 分光光度计:上海菁华科技仪器有限公司;PHS-3C pH 测定仪:上海大谱仪器有限公司;DW-40L92 超低温冰箱:青岛海尔特种电器有限公司;Fine-doX2 凝胶成像系统:上海天呈科技有限公司。
1.3 试验方法
1.3.1 乳酸菌的分离纯化
在无菌条件下,将低温风干发酵羊腿剪碎,称取10 g 肉样,转移至90 mL 无菌生理盐水中,振荡均匀,并将稀释度调为10-5g/mL,在MRS 琼脂培养基中涂布均匀,于35 ℃厌氧环境中,培养24~48 h。挑选单菌落反复划线分离[13],直到获得纯菌株(镜检时全部菌落、菌体大小形状均一致时判断为已纯化)。已纯化的菌株采取革兰氏染色、镜检后得到的阳性菌株进行斜面保藏并在最终浓度为50%的甘油中保存[14]。
1.3.2 菌株的初步筛选
将已纯化的菌株接种于MRS 琼脂培养基平板上,35 ℃培养48 h,选择明显溶钙圈并革兰氏染色为阳性、生长快的菌株[15]。
产黏性试验:直接挑取平板上的单菌落进行观察,筛选不产黏液的菌株[16]。
耐盐、耐亚硝酸盐试验:将发酵特性优良的菌株接种于已添加6%、9%NaCl 及浓度150 mg/kg 亚硝酸盐的液体培养基,35 ℃培养24 h 后用分光光度计测定600 nm 处的吸光值[17]。
过氧化氢酶试验:将培养24 h 后的菌液添加到含有5%过氧化氢的玻片上,记录结果并筛选阴性(不产气泡)菌株[18]。
葡萄糖产气试验:葡萄糖产气培养基的接种物于35 ℃培养24 h,筛选阴性菌株。如倒放小试管内有气泡则为阳性,未出现气泡则为阴性[19]。
氨基酸脱羧酶试验:将培养物接种于添加赖氨酸、苏氨酸等的培养基试管后,于35 ℃培养14~24 h,通过颜色特征判断阴性、阳性[20]。
产H2S、精氨酸产氨试验:参照东秀珠等[21]的方法进行。
1.3.3 菌株复筛试验
1.3.3.1 生长曲线及产酸能力的测定
将待测菌株接种于肉汤培养基,30 ℃培养48 h,每4 h 测定OD600值及pH 值。
1.3.3.2 不同温度下菌株生长能力将待测菌株接种于肉汤培养基,分别在10、20、30、35、45 ℃条件下培养24 h,测定OD600值。
1.3.3.3 耐盐、耐亚硝酸盐试验
将待测菌株接种到含不同浓度(3%、6%、9%、12%、15%)的NaCl 及含有不同浓度(30、60、90、120、150 mg/kg)NaNO2的MRS 肉汤培养基,30 ℃培养24 h,测其OD600值。
1.4 乳酸菌的鉴定
1.4.1 形态学特征
观察菌落形状,包括颜色、大小、透明度等,菌体形态采用革兰氏染色镜检观察[22]。
1.4.2 生理生化特征鉴定
将分离的菌株进行糖醇发酵试验,检验菌株对各种糖醇类碳源的利用情况,并记录结果。
1.4.3 16S rDNA 遗传学鉴定
1.4.3.1 扩增引物
按照试剂盒说明书对细菌DNA 进行提取,以提取DNA 基因组为PCR 扩增模板,采用通用型引物[23][正向引物:(5'-AGAGTTTGATCCTGGCTCAG-3') 反向引物:(5'-CTACGGCTACCTTGTTACGA-3')] 进行PCR扩增。PCR 反应条件:95 ℃预变性5 min,95 ℃变性30 s,58 ℃退火30 s,72 ℃延伸90 s,72 ℃延伸10 min。将PCR 产物送至生工生物工程(上海)股份有限公司测序,测序结果在美国国立生物技术信息中心(National Centerfor Biotechnology Information,NCBI) 基因库中进行同源性分析。
1.4.3.2 扩增体系
上述制备的基因组DNA 作为PCR 扩增模板,采用25 μL 反应体系进行PCR 扩增,PCR 扩增体系组成及用量如表1 所示。

表1 PCR 扩增体系组成及用量Table 1 Composition of PCR system
1.5 数据处理
每个试验做3 次平行,用Origin 8.0 软件绘制数据图,MEGA-X 软件绘制系统发育树。
2 结果与分析
2.1 菌株筛选结果
通过稀释分离平板法和划线平板法,从低温发酵风干羊腿中分离出43 株形态不同的疑似菌株,其中筛选出革兰氏染色阳性杆菌、有明显融钙圈并接触酶阴性菌31 株,初步判定为乳酸菌。乳酸菌主要发酵特性筛选结果见表2。

表2 乳酸菌主要发酵特性筛选结果Table 2 Screening results of lactic acid bacteria based on main fermentation characteristics
如表2 所示,所得的31 株菌均能耐受6%NaCl,其中25 株菌能够在含9% NaCl 的MRS 肉汤培养基中生长;培养24 h 后31 株菌pH 值均从6.25 下降至5.1以下;23 株菌不产生H2S;29 株菌在MRS 琼脂培养基中无黏液;所有菌株均能在浓度为150 mg/kg 的亚硝酸盐培养基中生长;在葡萄糖产气试验中,有16 株菌不产气;精氨酸产氨试验中19 株菌不产氨;26 株菌在氨基酸脱羧酶试验中结果呈阴性。筛选结果显示,分离的31 株菌中6 株菌不能耐受9%NaCl,2 株菌产黏液,8 株菌产H2S,15 株菌葡萄糖产气,19 株菌均无抑菌能力,12 株菌分解精氨酸产氨,5 株氨基酸脱羧酶阳性,均被淘汰。经过初筛,筛出5 株(GM09、GM23、GM28、PA15、KN02)发酵特性良好的优良乳酸菌,进一步筛选。
2.2 乳酸菌的生长曲线
乳酸菌的生长曲线如图1 所示。

图1 乳酸菌的生长曲线Fig.1 Growth curves of lactic acid bacterial strains
由图1 可知,筛选出的5 株菌均具有较强的生长能力。乳酸菌KN02、GM09 和GM28 在MRS 肉汤培养基的生长速度快于其余菌株,5 株菌在生长初期的0~8 h 内菌株的OD 值变化不明显,因乳酸菌接种于新环境,需要适应培养的环境进而导致生长缓慢状态,培养8 h 后细菌数上升趋势明显,菌体数量增加速度明显加快,此时进入对数期。其中GM23、PA15 在24 h 后开始进入稳定期,GM09、GM28、KN02 在培养32 h 左右进入稳定期。
2.3 乳酸菌的产酸能力
乳酸菌在48 h 内pH 值的变化见图2。
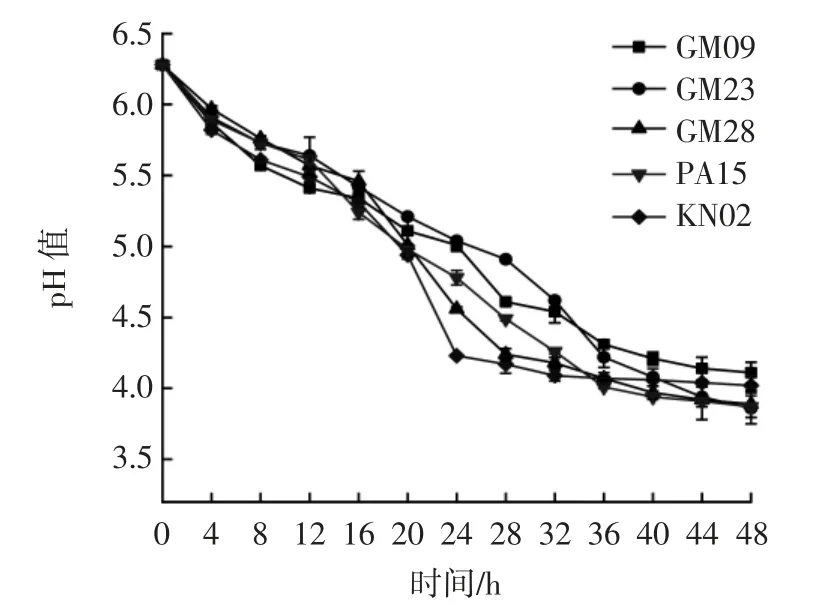
图2 乳酸菌在48 h 内pH 值变化Fig.2 Changes in medium pH value of lactic acid bacteria within 48 h
由图2 可知,5 株菌所处的培养基pH 值随时间的延长均呈下降趋势,培养48 h 时,GM09、GM23、GM28、PA15、KN02 所处培养基的pH 值分别为4.41、4.11、4.02、4.07、4.24。虽产酸速率存在差异,但5 株菌产酸能力均较强。结合生长曲线和产酸能力结果表明,5 株菌培养期迅速繁殖产生乳酸,进而降低pH 值,为发酵和菌株生长创造良好的条件。
2.4 不同温度下乳酸菌的生长情况
不同温度对乳酸菌生长的影响见图3。

图3 不同温度对乳酸菌生长的影响Fig.3 Effects of different temperatures on the growth of lactic acid bacteria
由图3 可知,温度为10~35 ℃时,菌株的生长能力随温度的升高而增强。虽45 ℃时生长趋势逆向发展,但在45 ℃条件下的生长情况基本良好;菌株在30 ℃和35 ℃条件下的生长能力明显强于其他温度条件,且相比于其他3 株菌,30 ℃和35 ℃时GM09 和KN02 的生长能力较强。
2.5 耐盐性
不同NaCl 浓度对乳酸菌生长的影响见图4。
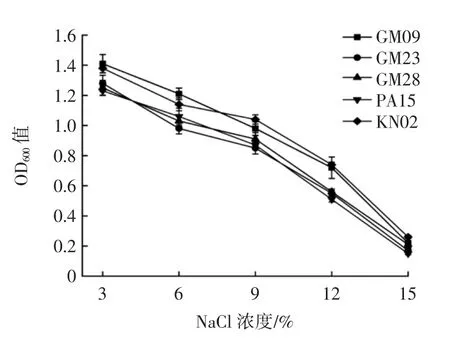
图4 不同NaCl 浓度对乳酸菌生长的影响Fig.4 Effects of different NaCl concentrations on the growth of lactic acid bacteria
由图4 可知,随着培养基中NaCl 浓度的增加,菌株的繁殖能力呈下降趋势,且5 株菌的生长抑制程度不同。在NaCl 浓度为3%、6%时,5 株乳酸菌生长良好;当NaCl 添加量达到15%时,菌株生长能力最弱,NaCl 浓度为9%时,KN02、GM09 的生长性能较佳。此外,NaCl 浓度为15%时,KN02 的生长能力高于其他菌株,生长性能最佳。
2.6 耐亚硝酸盐性
不同NaNO2浓度对乳酸菌生长的影响见图5。

图5 不同NaNO2 浓度对乳酸菌生长的影响Fig.5 Effects of different NaNO2 concentrations on the growth of lactic acid bacteria
由图5 可知,随着NaNO2浓度的增加,总体上菌株的繁殖能力呈下降趋势,并且5 株菌的生长能力受到不同程度的影响。当NaNO2浓度为30、60 mg/kg 时,GM23生长能力比其余菌株强;当NaNO2浓度为150 mg/kg时,GM28 生长能力比其余菌株弱。此外,GM09 在不同亚硝酸盐浓度下的生长能力相对较强。根据GB 2760—2014《食品安全国家标准食品添加剂使用标准》规定,亚硝酸盐最大使用量为150 mg/kg。因此,在亚硝酸盐盐浓度150 mg/kg 的条件下,5 株菌均能生长,表明5 株菌可作发酵香肠的发酵剂。
2.7 菌株的分类学鉴定结果
2.7.1 菌株形态学鉴定结果
乳酸菌菌落形态特征见图6。

图6 乳酸菌菌落形态特征Fig.6 Colonies of lactic acid bacteria
由图6 可知,乳酸菌在MRS 琼脂培养基中,35 ℃培养24~48 h,菌落直径大小有差异,KN02 和GM09 的菌落形态均呈白色圆形、不透明、形状规则;PA15、GM23 及GM28 的菌落形态均呈乳白色,菌落表面光滑湿润、不透明、边缘整齐。
乳酸菌菌体形态学特征见图7。

图7 乳酸菌菌体形态学特征(×1 000)Fig.7 Cell morphology of lactic acid bacteria(×1 000)
由图7 可知,GM09 和GM28 菌株在显微镜下观察时,细胞呈短杆状,KN02、PA15 及GM23 的菌株细胞均为杆状,5 株菌均为革兰氏阳性,其中GM09 和GM28 单个生长,KN02、PA15 及GM23 菌株呈不规则堆状排列。
2.7.2 菌株生理生化鉴定结果
参照《乳酸细菌分类鉴定及实验方法》中乳杆菌属鉴定所用的糖类,依据糖发酵试验产酸时的变色情况以及菌株的表型特征,菌株鉴定结果如表3 所示。

表3 菌株鉴定结果Table 3 Results of strain identification
由表3 可知,初步鉴定菌株GM09 和PA15 为戊糖乳杆菌(Lactobacillus Pentosus),GM23、GM28、KN02为植物乳杆菌(Lactobacillus Plantarum)。
2.7.3 16S rDNA 序列同源性分析结果
2.7.3.1 PCR 产物的检测与序列测定结果
菌株16S rDNA 扩增电泳图见图8。

图8 菌株16S rDNA 扩增电泳图Fig.8 Electrophoresis of 16S rDNA amplification of strains
如图8 所示,菌株GM09、GM23、GM28、PA15 及KN02 扩增出的16S rDNA 片段大小均约为1 500 bp,条带清晰且符合细菌16S rDNA 条带长度,经测序得到长度分别为1 478、1 476、1 476、1 483、1 482 bp。
2.7.3.2 16S rDNA 同源性分析及系统发育树
将菌株GM09、GM23、GM28、PA15、KN02 的16SrDNA序列与GenBank 中已知核酸序列进行Blast 分析,用MEGA-X 软件分析并构建系统发育树,结果如图9、图10 所示。
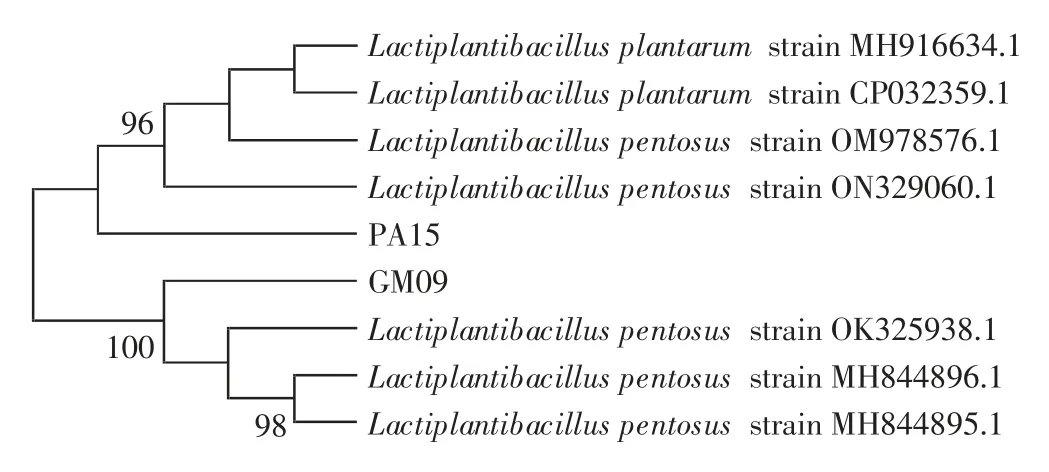
图9 乳酸菌菌株GM09、PA15 的系统发育树Fig.9 Neighbour-joining tree of GM09 and PA15

图10 乳酸菌菌株GM23、GM28、KN02 的系统发育树Fig.10 Neighbour-joining tree of GM23,GM28,and KN02
由图9、图10 可知,菌株GM09 与L.pentosus OK-325938.1 相似性高达100%,PA15 与L.pentosus ON-329060.1 相似性达96%,因此将菌株GM09、PA15 鉴定为戊糖乳杆菌;KN02 与Lactobacillus plantarum MT463669.1 相似性高达100%,GM23 与L.plantarum MH885507.1 相似性达99% ,GM28 与L.plantarum KM485577.1 相似性达94%,因此将菌株GM23、GM28及KN02 鉴定为植物乳杆菌。
3 讨论
发酵肉制品中分离得到的菌种,由于原料、配方及生产条件的不同,也存在很大的差异。筛选菌种不仅能提高和保证产品质量,还能够在性能及加工特性等方面超越自然发酵。
pH 值的下降使肉中蛋白质凝结,对产品色泽的形成有加快作用,使发酵肉制品在常温下的保质期有所延长,还能保证发酵肉制品的稳定性[24]。Ammor 等[25]的研究表明,作为发酵剂的基本要求是乳酸菌在培养24 h 后,pH 值能降至5.2 以下。如果将有黏性的菌株添加到发酵肉制品中,会直接作用于产品形成湿润、光泽感较好的外观形态和紧致的内部组织结构[26];为了防止肉质改变,选用过氧化氢阴性菌可以减少因氧化而导致的肉品质量改变,从而改善产品的色泽和风味。李珊珊等[27]的研究表明,发酵剂菌种产生H2S 和NH3等具有不良风味气体是影响产品品质的另一重要因素。本试验结果表明,31 株菌株在培养24 h 后,pH 值均从6.25 下降至5.1 以下,而在代谢过程中产生H2S的8 株菌、分解精氨酸产氨的12 株菌、氨基酸脱羧酶阳性的5 株菌、产黏液的2 株菌均不能作为肉品发酵剂。戴莹等[28]的研究表明,氨基酸脱羧酶阴性乳酸菌作为肉类发酵剂培养物时,能有效减少香肠中生物胺的积累。如菌株具有氨基酸脱羧酶活性,会产生一些有害胺类物质,如组胺、腐胺和酪胺等。因此,本试验中显示氨基酸脱羧酶活性的5 株菌被淘汰。
选择发酵肉制品发酵剂的重要因素是其具有耐盐、耐亚硝酸盐能力,且在较低盐浓度情况下菌能够生长。但随着加工过程中水分的减少,盐的浓度逐渐增加,但较高的盐浓度导致菌株不能正常生长[29]。而对NaCl 耐受性较高的菌株则能够在整个发酵和加工过程中具有较强的竞争力。一般选择能耐受2%~10%盐浓度的菌株作为发酵剂。而亚硝酸盐添加量在国标中规定的最大添加量为150 mg/kg。结果表明,本试验选取的5 株乳酸菌对盐和亚硝酸盐的耐受性都很好。
目前常应用的形态学和生理生化特征等分类鉴定方法仍存在耗时长、周期长、费用高、具有不确定性的缺点。为了保证鉴定结果的可靠性,将表型特征鉴定方法和16S rDNA 序列分析鉴定技术结合使用,使乳酸菌的分类鉴定结果更加准确。本研究中GM09、GM23、GM28、PA15 和KN02 的16S rDNA 同源性分析与表型特征鉴定结果一致。
4 结论
从低温发酵风干羊腿中共分离出43 株菌,依据肉制品发酵剂的发酵特性,筛选出6 株菌不能耐受9%NaCl,2 株菌产黏液,8 株菌产H2S,15 株菌葡萄糖产气,12 株菌分解精氨酸产氨,氨基酸脱羧酶阳性5 株,均被淘汰。通过菌株的产酸能力、生长曲线和耐高温性等一系列指标,最终筛选出GM09、GM23、GM28、PA15 和KN02,5 株菌发酵特性好,具有较强的抑菌和产酸能力及良好的生长特性和耐受性。
经过形态学和生理生化特征并结合16S rDNA 序列分析,鉴定GM09、PA15 为戊糖乳杆菌,GM23、GM28、KN02 为植物乳杆菌,为进一步探讨乳酸菌在发酵肉制品中的应用提供参考。

