山药硒多糖对镉暴露小鼠镉蓄积和氧化应激的缓解作用
刘敏,张岚,王丹,王长文,2*
(1.吉林医药学院 公共卫生学院,吉林 吉林 132000;2.吉林医药学院 慢病防治科研实验中心,吉林 吉林 132000)
镉(Cd)是一种有毒重金属,主要通过受污染的食物、水和职业暴露等途径进入人体,并对肝脏、肾脏、脑、骨骼和肺等多种器官造成损害。许多研究已表明,Cd 暴露会导致肝细胞氧化应激、肝纤维化和肝功能损害[1-2]。此外,Cd 被国际癌症研究机构认定为人类致癌物,许多证据充分证明其对人类具有致癌性,包括促进肺癌和肾癌[3]。Cd 暴露还会增加骨折和骨质疏松症的风险[4]。研究表明,慢性Cd 暴露与心力衰竭和动脉粥样硬化疾病的风险增加有关,包括冠状动脉疾病、外周动脉疾病[5]。因此,降低Cd 对机体健康带来的毒副作用至关重要。
山药学名薯蓣(Dioscorea opposita),为薯科(Dioscoreaceae)薯蓣属(Dioscorea)植物山药的块茎,主要分布于非洲、亚洲、南美洲部分地区、加勒比海地区和南太平洋岛屿[6]。山药是我国传统的药食同源植物,所含生物活性成分复杂,其中非淀粉多糖是山药水提物中的主要成分,具有降血糖、抗肿瘤、保护心肌细胞和抗氧化等生物活性[7-8],因此越来越受到关注。硒是人体内重要的微量元素之一,由于其具有提高机体免疫能力、抗肿瘤、缓解体内重金属蓄积、抗衰老和防止心脑血管疾病等重要的生理功能,也已成为近年来的研究热点。近年来研究发现,通过硒化修饰多糖获得硒多糖,不仅未改变多糖的生物活性,还提高机体对硒的利用率以及硒多糖的抗氧化活性和抗肿瘤活性的生物活性[6,9]。此外,研究表明,硒多糖可以提高机体抗氧化酶活性,清除体内的氧自由基[10-11]。然而,当前关于硒多糖缓解Cd 毒性的研究鲜见。因此,本试验以染镉小鼠为模型,探讨山药硒多糖(Chinese yam selenium polysaccharide,SeY)缓解Cd 诱导小鼠Cd 蓄积以及氧化应激的作用,以期为山药硒多糖在缓解重金属中毒的开发利用提供参考。
1 材料与方法
1.1 主要试剂
氯化镉(CdCl2)(纯度>99.7%):长春梦怡美有限公司;山药多糖(纯度≥97%):吉林医药学院公共卫生学院预防医学实验教学中心实验室制备并纯化;盐酸、硝酸、醋酸、亚硒酸钠、硫酸、抗坏血酸(均为分析纯):昊迪化学试剂经销有限责任公司;谷丙转氨酶(alanine aminotransferase,ALT)检测试剂盒、谷草转氨酶(aspartate transaminase,AST)检测试剂盒、乳酸脱氢酶(lactate dehydrogenase,LDH)检测试剂盒、碱性磷酸酶(alkaline phosphatase medicine,ALP)检测试剂盒:南京建成生物科技有限公司;超氧化物歧化酶(superoxide dismutase,SOD)检测试剂盒、谷胱甘肽过氧化物酶(glutathione peroxidase,GSH-Px)检测试剂盒、谷胱甘肽还原酶(glutathione reductase,GR)检测试剂盒、过氧化物酶(catalase,CAT) 检测试剂盒、丙二醛(malondialdehyde,MDA)检测试剂盒:上海生工生物有限公司。
1.2 主要仪器
原子吸收分光光度计(AA-6880):日本岛津公司;全波长酶标仪(Spectramax 384 plus):美国Molecular Devices 公司;低速冷冻离心机(KDC-2046 型):科大创新股份有限公司中佳分公司;紫外分光光度计(UV756 型):上海第三分析仪器厂。
1.3 实验动物
100 只8 周龄成年C57BL/6 雄性小鼠(25~30 g):长春长生生物科技有限责任公司,许可证号为SYXK(吉)2017-0009。实验小鼠在实验动物饲养室进行饲养,环境为(22±2)℃,湿度为(55±5)%。饲喂1 周后用于进一步实验。
1.4 试验方法
1.4.1 山药硒多糖的制备
山药硒多糖制备方法为HNO3-Na2SeO3法,具体操作:将山药多糖用50 mL 5% HNO3溶液溶解并加入三口烧瓶中,随后加入等质量的亚硒酸钠,水浴加热至70 ℃,并加入0.5 g BaCl2催化剂,反应8 h。待反应完成时冷却降至室温,并滴加1 mol/L 硫酸溶液至Ba2+完全沉淀,8 000 r/min 离心10 min。反应液用无水Na2CO3调节pH 值至5~6,8 000 r/min 离心10 min,透析袋中用流水透析48 h 以上,直至用抗坏血酸检测透析液不再变红为止,醇沉、离心、干燥、称重。并使用原子吸收分光光度计测定山药硒多糖中硒含量和苯酚-硫酸法测定其多糖含量。
1.4.2 试验设计及样品采集
将100 只成年C57BL/6 雄性小鼠随机分成5 组,每组20 只。分别为对照组(CK 组),氯化镉处理组(Cd组),山药硒多糖低(L-SeY)、中(M-SeY)、高剂量组(H-SeY)。CK 组小鼠饮用普通蒸馏水,Cd 组和山药硒多糖组小鼠饮用含CdCl2的蒸馏水(20 mg/L)。山药硒多糖给药方式为灌胃给药,其中CK 组和Cd 组小鼠灌胃生理盐水,L-SeY 组、M-SeY 组和H-SeY 组分别灌胃200、500 mg/kg 和1 000 mg/kg 的山药硒多糖。实验持续6 周,每天记录小鼠采食量和饮水量,每周对小鼠进行称重。实验期间各组小鼠自由采食饮水。实验结束前24 h,对各组小鼠禁食不禁水,使用戊巴比妥钠腹腔注射麻醉,并收集小鼠血液、肝脏、肾脏、小肠、大脑和心脏样品用于后续实验。并对肝脏、肾脏、大脑和心脏样品进行称重,用于计算各脏器指数。本研究中的所有实验方案均经吉林医药学院公共卫生学院动物委员会批准。
1.4.3 小鼠血液及组织中镉浓度的测定
使用原子吸收分光光度测定小鼠血液和肝脏、肾脏、小肠、大脑和心脏中Cd 浓度,具体参考Wan 等[12]的方法。
1.4.4 小鼠肝功能指标的测定
将收集的小鼠血液使用离心机3 000 r/min 离心10 min,取血清。并使用试剂盒对小鼠ALT、AST、LDH 及ALP 活性进行测定,具体操作步骤参考试剂盒说明书。
1.4.5 小鼠肝脏氧化应激指标的测定
处死小鼠后,立即切除肝组织,并在冰冷的磷酸钠盐缓冲液(0.1 mol/L Na2HPO4/NaH2PO4,pH7.4)中使用超声波处理器进行组织匀浆。将组织匀浆在4 ℃下,3 500 r/min 离心10 min,收集上清液。使用试剂盒对小鼠肝脏中SOD、GSH-Px、GR、CAT 活性和MDA 含量进行测定,参考试剂盒说明书进行操作。
1.5 数据分析
试验数据表示为平均值±标准差。试验数据使用Excel2010 和SPSS 22.0 进行方差分析,使用Duncan 法进行多重比较,并使用GraphPad Prism 7.0 制图,P<0.05表示差异显著。
2 结果与分析
2.1 山药硒多糖的得率、糖含量和硒含量
按照1.4.1 制备方法共制备合成20 批山药硒多糖,其中山药硒多糖平均得率为(48.24±1.16)%,硒平均含量为3.97 mg/g,多糖平均含量为52.37%。
2.2 山药硒多糖对Cd 暴露小鼠体质量的影响
山药硒多糖对Cd 暴露小鼠体质量的影响见图1。

图1 山药硒多糖对Cd 暴露小鼠体质量的影响Fig.1 The effect of Chinese yam selenium polysaccharide on the body weight of Cd-exposed mice
实验期间,各组小鼠活动无异常,且无小鼠死亡,各组小鼠采食量和饮水量之间无明显差异。由图1 可知,随着Cd 暴露时间的延长,Cd 组小鼠体质量逐渐降低,并低于其他处理组,且H-SeY 组和M-SeY 组小鼠体质量在第6 周时高于L-SeY 组小鼠。
2.3 山药硒多糖对Cd 暴露小鼠不同组织中Cd 蓄积的影响
山药硒多糖对Cd 暴露小鼠不同组织中Cd 蓄积的影响见图2。
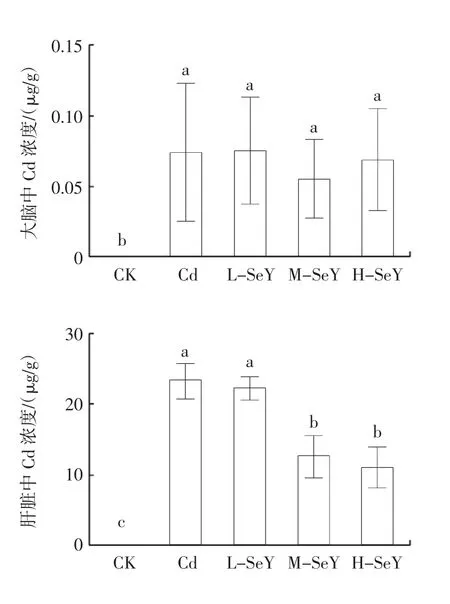
图2 山药硒多糖对Cd 暴露小鼠不同组织中Cd 蓄积的影响Fig.2 Effects of Chinese yam selenium polysaccharide on Cd accumulation in different tissues of Cd-exposed mice
由图2 可知,在Cd 组中,Cd 在小鼠各组织的蓄积情况排序为肾脏(47.55 μg/g)>肝脏(23.15 μg/g)>心脏(13.26 μg/g)>小肠(9.31 μg/g)>大脑(0.07 μg/g),血液中Cd 含量为5.17 μg/L。与Cd 组相比,M-SeY 组和H-SeY 组小鼠血液、肾脏、肝脏、小肠和心脏中的Cd含量显著降低(P<0.05);而L-SeY 组和Cd 组差异不显著(P>0.05)。此外,除CK 组外,各组小鼠大脑中Cd含量无显著性差异(P>0.05)。
2.4 山药硒多糖对Cd 暴露小鼠脏器指数的影响
山药硒多糖对Cd 暴露小鼠脏器指数的影响见表1。
由表1 可知,与CK 组相比,Cd 组小鼠肝脏指数显著升高(P<0.05);与Cd 组相比,M-SeY 组和H-SeY 组小鼠肝脏指数显著降低(P<0.05)。此外,各组小鼠在肾脏指数、心脏指数和大脑指数间无显著性差异(P>0.05)。
2.5 山药硒多糖对Cd 暴露小鼠氧化应激的影响
山药硒多糖对Cd 暴露小鼠氧化应激的影响见图3和图4。



图3 山药硒多糖对Cd 暴露小鼠血清中AST、ALT、LDH 和ALP水平的影响Fig.3 Effects of Chinese yam selenium polysaccharide on serum levels of AST,ALT,LDH and ALP in Cd-exposed mice

图4 山药硒多糖对Cd 暴露小鼠肝脏中SOD、GSH-Px、CAT、GR 和MDA 水平的影响Fig.4 Effects of Chinese yam selenium polysaccharide on the levels of SOD,GSH-Px,CAT,GR and MDA in the liver of Cdexposed mice
由图3 可知,Cd 暴露显著提高了小鼠血清中AST、ALT、LDH 和ALP 水平(P<0.05)。山药硒多糖(M-SeY组和H-SeY 组)显著降低了小鼠血清中AST、ALT、LDH 和ALP 水平(P<0.05)。然而,L-SeY 组小鼠血清中AST 和ALT 含量与Cd 组间无差异显著性(P>0.05)。由图4 可知,与CK 组相比,Cd 暴露小鼠肝脏中SOD、GSH-Px、CAT 和GR 水平显著降低,而MDA 水平显著升高(P<0.05)。与Cd 组相比,山药硒多糖组小鼠肝脏中SOD、GSH-Px、CAT 和GR 水平显著升高,而MDA水平显著降低(P<0.05),且呈剂量依赖性。
3 讨论
Cd 进入机体后,首先在血液中分布,随后随血液循环不断进入肝脏和肾脏等器官。Cd 进入肝脏后会不断诱导肝细胞合成分泌金属硫蛋白(metallothionein,MT),并与MT 结合形成Cd-MT 复合物运输至肾脏,在肾小管溶酶体的作用下Cd-MT 复合物中游离出Cd2+,从而在肾小管上皮细胞中发挥毒性[13]。Cd 进入机体后会在机体内器官内蓄积,引起器官氧化损伤。Cd在机体内不同器官的蓄积情况不同,并且Cd 在机体器官内的蓄积与Cd 暴露的浓度和方式等有关。当前的结果表明,Cd 进入体内后主要在肾脏和肝脏蓄积。此外,心脏中较高的Cd 含量可能与Cd 进入体内后通过血液循环进入肝脏的过程有关。本文结果还显示,对小鼠灌胃山药硒多糖可降低Cd 在小鼠器官中的蓄积。与Cd 组小鼠相比,山药硒多糖组小鼠肾脏、肝脏、心脏、小肠和血液中Cd 含量显著降低,并且还呈现出剂量依赖性。
当动物受到重金属的危害时,重金属会引起机体器官的损伤,相应的脏器指数也随着变化[14]。李光先[13]研究表明,对小鼠Cd 暴露后,小鼠肝脏指数和脾脏指数升高。蓝田丰等[15]的研究也表明,小鼠Cd 暴露后,其肝脏指数和睾丸指数显著升高。本研究结果显示,Cd暴露后,小鼠的肝脏指数显著升高。Cd 暴露还会导致脂肪肝和急性肝炎的出现,从而导致肝脏指数升高。当对Cd 暴露小鼠进行山药硒多糖灌胃后,小鼠的肝脏指数逐渐降低。推测这与山药硒多糖的抗氧化活性有关,其提高了肝脏的抗氧化能力,缓解了因Cd 暴露导致的氧化应激。
ALT 和AST 是评价机体肝损伤的重要指标,其中,血清中ALT 和AST 活性增高表明肝脏线粒体被破坏,细胞膜通透性增加,ALT 和AST 被释放到肝脏中[16]。此外,LDH 和ALP 也是反映肝功能正常与否的重要指标。在本文中,Cd 暴露后,小鼠血清中AST、ALT、LDH和ALP 水平显著升高,表明小鼠出现肝损伤。而对小鼠进行山药硒多糖灌胃后,小鼠血清中AST、ALT、LDH和ALP 水平显著降低,表明山药硒多糖缓解了Cd 暴露导致的小鼠肝功能异常。此外,Cd 暴露还会导致机体出现氧化应激。氧化应激的特征是产生自由基,诱导脂质过氧化和细胞膜的破坏[17]。研究表明,镉暴露会降低细胞内GSH 的含量以及细胞内SOD、过氧化物酶和CAT 活性,从而导致氧自由基积累和细胞内氧化应激的增加[18]。自由基的产生及其相关的氧化应激被认为是镉诱导毒性的主要机制之一[19-20]。Yang 等[21]研究指出,Cd 暴露后小鼠肝脏中SOD、GST、GSH、CAT 和GR 水平显著降低,MDA 水平显著升高。本研究结果也表明,Cd 暴露显著降低了小鼠肝脏中SOD、GSH-Px、CAT 和GR 水平,显著提高了MDA 含量。然而,山药硒多糖的治疗缓解了Cd 暴露导致的小鼠肝脏氧化应激(SOD、GSH -Px、CAT 和GR 水平升高,MDA 水平降低),且呈现剂量依赖性。这表明山药硒多糖可通过提高Cd 暴露小鼠抗氧化酶活性来缓解Cd 暴露导致的小鼠氧化应激和肝损伤。
4 结论
本研究旨在探究山药硒多糖对Cd 暴露小鼠镉蓄积和氧化应激的缓解作用。本实验结果表明,山药硒多糖能够降低Cd 在小鼠各组织中的蓄积,并通过提高肝脏抗氧化酶活性来改善Cd 毒性引起的小鼠氧化应激和肝损伤。但关于山药硒多糖降低Cd 在小鼠体内的蓄积以及缓解氧化应激的具体机制还需进一步探究。

