重组大肠杆菌产L-阿拉伯糖异构酶的条件优化
李 俊 凯, 张 艳 芳, 周 金 龙, 张 春 枝
( 大连工业大学 生物工程学院, 辽宁 大连 116034 )
0 引 言
D-塔格糖是在自然界中较为稀少的天然己酮糖,属于稀有糖的一种[1]。D-塔格糖理化性质与蔗糖相近,热量为6.28 kJ/g,是蔗糖的1/3,甜度是蔗糖的92%[2],D-塔格糖可替代蔗糖作为低能量甜味剂和食品添加剂。D-塔格糖除了具有热量低的特点外,还具有改善肠道菌群、抗龋齿、抗氧化、降低血糖等保健功能[3]。作为一种新型的功能性稀有糖,D-塔格糖被广泛应用到食品、医疗、化妆品、饮料等多个领域中。
D-塔格糖常见的生产方法有化学合成法和生物转化法。化学合成法存在诸多不利因素。所以环境友好型的生物转化法成为目前生产D-塔格糖的研究热点。生物转化法包括酶转化法和细胞转化法[4]。细胞转化法生产周期长、转化率低,不适合工厂化生产。酶转化法是指用L-阿拉伯糖异构酶(L-AI,EC 5.3.1.4)将D-半乳糖催化为D-塔格糖,这种方法步骤简单、条件温和、产率较高,是当前生产D-塔格糖采用较多的方法[5]。
目前,国内外已经报道的L-阿拉伯糖异构酶的微生物来源多达30余种,在NCBI中可以检索到具有L-AI的编码基因araA的菌种有乳杆菌[6](Lactobacillusplantarum)、双歧杆菌[7](Bifidobacteriumlongum)、嗜热菌[8](Geobacillussteathermophilus)、极端嗜热菌[9](Thermotoganeapolitana)。利用野生菌表达L-阿拉伯糖异构酶时,发酵基础培养基需要以L-阿拉伯糖为碳源,这样会增加酶的生产成本。利用基因工程菌生产L-阿拉伯糖异构酶,可利用价格低廉的葡萄糖、蔗糖等作为发酵基础培养基的碳源,而且具有表达能力强、产酶能力高、生产成本低、生产周期短等优点[10],对实现D-塔格糖的高效生产具有重要意义。本实验利用重组大肠杆菌E.coliBL21(DE3)/pET-30a(+)-araA生产D-塔格糖,对该菌株的发酵基础培养基和诱导产酶条件进行优化,以提高其产酶能力。
1 材料与方法
1.1 材 料
1.1.1 菌 株
重组大肠杆菌E.coliBL21(DE3)/pET-30a(+)-araA,本实验室构建。
1.1.2 培养基
LB培养基(种子培养基):蛋白胨10 g/L,酵母浸粉5 g/L,氯化钠1 g/L,磁力搅拌后用氢氧化钠溶液调节pH至7.5,121 ℃高温高压蒸汽灭菌20 min。
M9培养基(发酵基础培养基):葡萄糖5.0 g/L,MgSO4·7H2O 0.5 g/L,Na2HPO4·12H2O 17.1 g/L,氯化铵1.0 g/L,氯化钠0.5 g/L,无水KH2PO43.0 g/L。
1.2 方 法
1.2.1 种子液的制备
挑取在37 ℃的恒温培养箱中培养12 h的平板上的单菌落,接种于100 mL LB培养基中,于37 ℃、180 r/min下振荡培养12 h。
1.2.2 酶液的制备
按1%的接种量将种子液接种于100 mL M9培养基中,于37 ℃、180 r/min下振荡培养,待菌体浓度OD600为0.6~0.7时,用终浓度0.1 mmol/L的IPTG进行诱导,于16 ℃、180 r/min下振荡培养18 h后,将发酵液离心(4 500 r/min,5 min),用50 mmol/L pH 7.4的PBS缓冲液洗两次,去掉上清,再用5 mL PBS缓冲液将菌体重悬,经超声破碎(功率350 W,超声3 s,停3 s,工作时间10 min)、离心保留上清,得到L-AI酶液。
浅议代扣代缴年金个人所得税………………………………………………………………………………………钱玉香(3.93)
1.2.3 单因素试验优化发酵基础培养基
1.2.3.1 碳源优化
在发酵基础培养基中,分别选取蔗糖、乳糖、甘油、果糖和葡萄糖作为碳源,测定各样品的酶活力,选取发酵基础培养基的适宜碳源,并确定该碳源的适宜添加量。
1.2.3.2 氮源优化
在发酵基础培养基中,分别选取氯化铵、硫酸铵、酵母浸粉、尿素、玉米浆干粉作为氮源,其他条件不变,测定各样品的酶活力,选取发酵基础培养基的适宜氮源,并确定该氮源的适宜添加量。
1.2.4 单因素试验优化诱导产酶条件
分别对诱导时机、诱导剂浓度、诱导温度、诱导时间4个因素进行优化,改变其中某一因素时,其余各因素水平保持不变,通过测定各样品的酶活力,选取较优的诱导产酶条件。
1.2.5 L-AI催化D-半乳糖生产D-塔格糖
0.5 mL 90 g/L的D-半乳糖与2.5 mL L-AI,并加入终浓度3 mmol/L的Co2+,在55 ℃的水浴振荡器中反应12 h,测定D-塔格糖的生成量。
1.2.6 D-塔格糖浓度的测定
采用间苯二酚法进行D-塔格糖浓度的测定[11]。将已知浓度D-塔格糖标准溶液按比例稀释,7组样品的D-塔格糖终质量浓度分别为0、10、20、30、40、50、60 μg/mL。分别加入2 mL 1 mg/mL的间苯二酚溶液,于沸水浴中显色30 min,取出流水冷却至室温,用1号管作空白对照,在400 nm波长处测定吸光度,绘制D-塔格糖标准曲线。
1.2.7 L-AI酶活力的测定
取1 mL L-AI酶液,与1 mL 90 mg/mL的D-半乳糖溶液于55 ℃的恒温水浴振荡器中反应2 h。将反应液稀释一定倍数,取2 mL稀释后的反应液和2 mL 1 mg/mL间苯二酚溶液混合,煮沸30 min,流水冷却至室温,在400 nm处测定吸光度[12]。在相同条件下,以稀释相同倍数的90 mg/mL D-半乳糖作为空白对照。
酶活力定义:以D-半乳糖为底物,每分钟生成1 μg D-塔格糖所需的L-AI量作为一个酶活力单位,以U表示[13]。
2 结果与讨论
2.1 碳源的优化
2.1.1 碳源的选择
选用质量浓度5 g/L的蔗糖、乳糖、甘油、果糖、葡萄糖作为发酵基础培养基的碳源,结果如图1所示。从图1可以看出,以葡萄糖为碳源的L-AI酶活力明显高于其他组,葡萄糖与果糖相比,原料来源充足,价格低廉。综合考虑,选择葡萄糖作为发酵基础培养基的碳源。
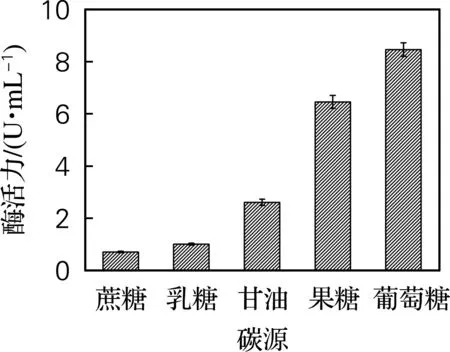
图1 碳源对酶活力的影响Fig.1 Effect of carbon source on enzyme activity
2.1.2 碳源用量的选择
对葡萄糖添加量进行优化,如图2所示。葡萄糖添加量在10~40 g/L时,酶活力先随葡萄糖添加量的增加而增大,当添加量为40 g/L时,酶活力达到最大值,为20.9 U/mL。当葡萄糖添加量在40~50 g/L时,酶活力呈下降趋势。因此,选择葡萄糖的适宜添加量为40 g/L。

图2 葡萄糖添加量对酶活力的影响Fig.2 Effect of glucose addition on enzyme activity
2.2 氮源的优化
2.2.1 氮源的选择
分别选用质量浓度为1 g/L的氯化铵、硫酸铵、酵母浸粉、尿素和玉米浆干粉作为发酵基础培养基的氮源,结果如图3所示。从图3可以看出,氯化铵、硫酸铵等无机氮源优于酵母浸粉、尿素、玉米浆干粉等有机氮源,表明无机氮源的产酶能力更强。以硫酸铵作为氮源培养的L-AI酶活力明显高于氯化铵。因此,选用硫酸铵作为发酵基础培养基的氮源。
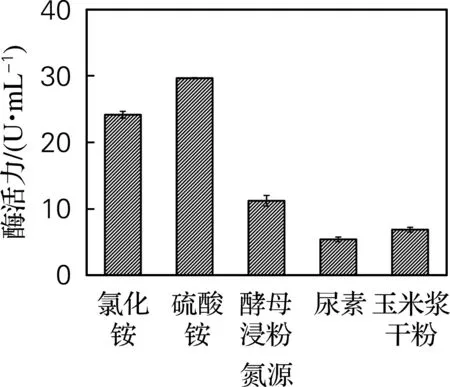
图3 氮源对酶活力的影响Fig.3 Effect of nitrogen source on enzyme activity
2.2.2 氮源用量的选择
对硫酸铵添加量进行优化,结果如图4所示。硫酸铵添加量在2~10 g/L时,酶活力先随硫酸铵量的增加而增大,在添加量为8 g/L时,酶活力达到最大值35.7 U/mL,之后呈下降趋势。因此,确定硫酸铵最适添加量为8 g/L。
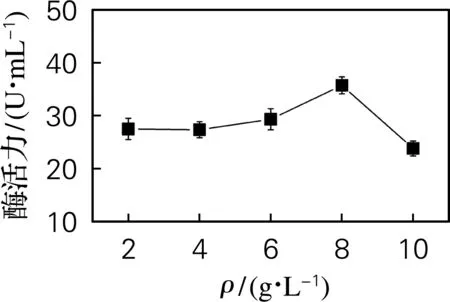
图4 硫酸铵添加量对酶活力的影响Fig.4 Effect of ammonium sulfate addition on enzyme activity
2.3 诱导时机的优化
为了使可溶性目的蛋白大量表达,在菌体进行快速生长繁殖的对数期进行IPTG诱导是最佳的诱导时机,可通过绘制该菌体的生长曲线来判断其对数生长期的大致范围,重组大肠杆菌的生长曲线如图5所示。由图5可知,对数生长期为5~10 h。
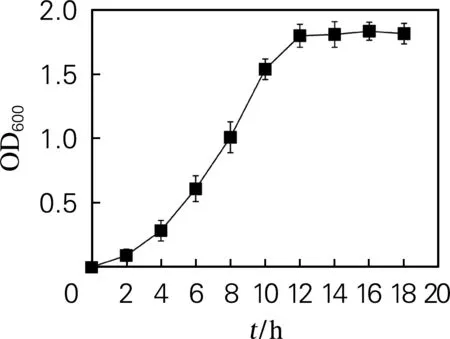
图5 重组大肠杆菌的生长曲线Fig.5 Growth curve of recombinant E. coli
由图6可知,在7 h时进行IPTG诱导,酶活力达到最大值。选择在37 ℃下培养7 h时进行IPTG诱导。
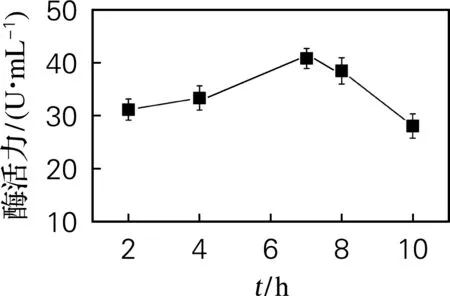
图6 诱导时机对酶活力的影响Fig.6 Effect of induction time on enzyme activity
2.4 诱导剂浓度的优化
选择终浓度0.3、0.4、0.5、0.6、0.7 mmol/L的IPTG进行诱导,结果如图7所示。随着诱导剂浓度的增加,酶活力先增大后降低,当诱导剂浓度为0.6 mmol/L时达到最大值。因此选取0.6 mmol/L为适宜的诱导剂浓度。
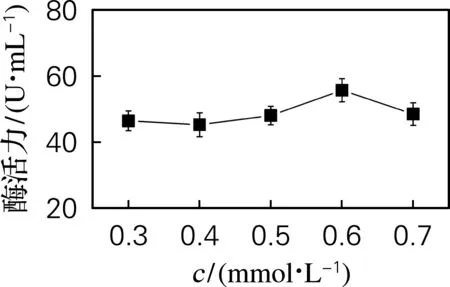
图7 诱导剂浓度对酶活力的影响Fig.7 Effect of inducer concentration on enzyme activity
2.5 诱导温度的优化
向在37 ℃培养7 h的发酵基础培养基中添加终浓度为0.6 mmol/L的IPTG,分别在16、20、25、30、37 ℃下诱导培养相同时间,结果如图8所示。随着诱导温度的升高,酶活力一直呈下降趋势。低温诱导所得L-AI酶活力更高的原因可能是低温条件下菌体生长速率低于质粒复制速度,而且低温下质粒稳定性好,使得外源蛋白有充足的时间进行正确折叠,不易形成包涵体,有利于可溶性蛋白的表达[14-15]。因此,选用16 ℃的诱导温度进行产酶。
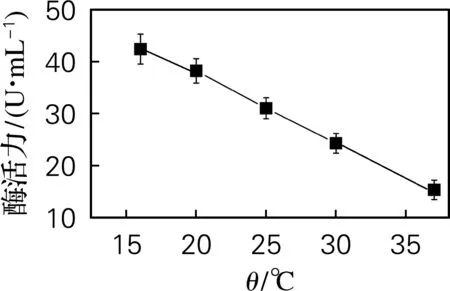
图8 诱导温度对酶活力的影响Fig.8 Effect of induction temperature on enzyme activity
2.6 诱导时长的优化
向在37 ℃培养7 h的发酵基础培养基中添加终浓度为0.6 mmol/L的IPTG,在16 ℃下分别诱导培养10、12、14、16、18 h,结果如图9所示。由图可知,随着诱导时长的增加,酶活力先增大,当诱导时长为16 h时,酶活力达到最大值,随后呈下降趋势。因此选择16 h为最适诱导时长。
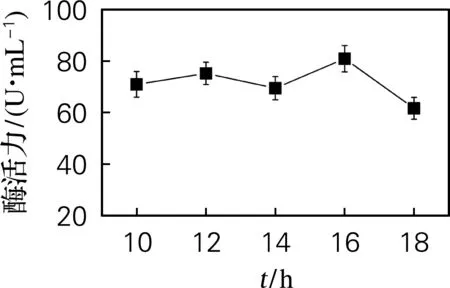
图9 诱导时长对酶活力的影响Fig.9 Effect of induction duration on enzyme activity
2.7 产酶条件优化前后酶活力的对比
以初始M9培养基为发酵基础培养基,在37 ℃培养10 h后进行IPTG诱导,IPTG终浓度为0.1 mmol/L,诱导温度16 ℃,诱导时长18 h,制备的L-AI酶活力为44.2 U/mL。利用优化后的培养基,以40 g/L葡萄糖为碳源,以8 g/L硫酸铵为氮源,37 ℃培养7 h后进行IPTG诱导,IPTG终浓度为0.6 mmol/L,诱导温度为16 ℃,诱导时长为16 h,制备的L-AI酶活力达到80.1 U/mL,是优化前的1.8倍。
2.8 L-AI催化D-半乳糖生产D-塔格糖
利用优化后的M9培养基条件和诱导产酶条件所制备的L-AI催化90 g/L的D-半乳糖异构化生产D-塔格糖,在55 ℃的水浴振荡器中反应12 h,D-半乳糖的转化率可达到44.2%。
3 结 论
采用单因素试验对重组E.coliBL21(DE3)/pET-30a(+)-araA生产L-AI的条件进行优化,其中M9培养基以40 g/L的葡萄糖为碳源,以8 g/L的硫酸铵为氮源,在37 ℃培养7 h后进行IPTG诱导,IPTG终浓度为0.6 mmol/L,诱导温度为16 ℃,诱导时长为16 h。按照优化后的产酶条件生产L-AI,酶活力为80.1 U/mL,是优化前酶活力的1.8倍。催化反应体系中加入终浓度3 mmol/L的Co2+,L-AI与90 g/L D-半乳糖,在55 ℃的水浴振荡器中反应12 h,D-半乳糖的转化率可达到44.2%。

