miR-199a-3p靶向CD151对甲状腺癌B-CPAP细胞增殖、凋亡、侵袭和上皮间质转化的影响*
覃 艳, 赵可雷, 李 燕, 朱云峰, 曹 萌
新乡医学院第一附属医院 1内分泌科二病区 2肿瘤内科二病区,新乡 453100
甲状腺癌属于内分泌系统恶性肿瘤的一种,发病率呈现逐渐上升的趋势,预计该疾病将成为全球第四大主要癌症[1]。甲状腺癌治疗通常选择手术切除或放射碘治疗,在大多数情况下,甲状腺乳头状癌(papillary thyroid carcinoma,PTC)在手术切除后预后良好,少数患者会复发或者发生远处转移[2]。探索PTC细胞迁移的潜在分子机制,对于提供新的治疗靶点和改善PTC患者的预后具有重要意义。
miRNA在肿瘤发生中起重要作用,并显示出明显的组织特异性,miRNA也被认为是良好的癌症生物标志物。已有研究表明miR-199a-3p在甲状腺乳头状癌标本中和细胞系中低表达,并表现出抑癌作用[3]。CD151是近年新发现的癌基因,在多种肿瘤细胞表面均有较高水平的表达,相关研究表明CD151 mRNA和蛋白在甲状腺癌组织中的表达明显升高[4]。但miR-199a-3p与CD151的相关性尚未见报道。miR-199a-3p与CD151在甲状腺癌发生发展过程中是否具有调控作用,有待进一步探究,因此本研究以甲状腺癌B-CPAP细胞为研究对象,初步探讨了miR-199a-3p靶向CD151对甲状腺癌细胞增殖、凋亡、侵袭及上皮间质转化的影响。
1 材料与方法
1.1 主要试剂
RPMI 1640培养液、胎牛血清、青-链霉素、胰蛋白酶购自美国Gibco公司;人甲状腺癌B-CPAP细胞株购自中国科学院典型培养物保藏委员会细胞库;miR-199a-3p mimic、mimic-NC、pcDNA载体由上海生工生物工程股份有限公司合成;BrdU细胞增殖检测试剂盒、LipoRNAiTM转染试剂、二辛可宁酸(bicinchoninic acid,BCA)蛋白浓度测定试剂盒、Annexin Ⅴ-FITC细胞凋亡检测试剂盒、辣根过氧化物酶标记山羊抗兔IgG购自上海碧云天生物技术研究所;双荧光素酶报告基因检测试剂盒购自上海百赛生物技术股份有限公司;Transwell购自北京伊塔生物科技有限公司;一抗基质金属蛋白酶-2(matrix metalloproteinase-2,MMP-2)、Ki-67、细胞周期蛋白D1(Cyclin D1)、E-钙粘蛋白(E-cadherin)、神经钙粘蛋白(N-cadherin)、波形蛋白(Vimentin)、actin购自英国Abcam公司。
1.2 细胞培养
将B-CPAP细胞培养于RPMI 1640培养液中,添加10%胎牛血清和1%青霉素-链霉素,于37 ℃、5%CO2恒温培养箱中培养,每24 h更换新鲜培养液,1∶2传代。选用对数生长期细胞为实验用细胞。
1.3 qRT-PCR检测
用Trizol法从B-CPAP细胞中提取总RNA,提取的总RNA首先去除基因组中的DNA,然后进行反转录,以上步骤根据产品说明书进行操作。构建20 μL反应体系,反应条件为:95 ℃预变性2 min,95 ℃变性30 s,60 ℃退火30 s,72 ℃延伸30 s共40个循环。以actin和U6为内参基因,用2-ΔΔCt计算各目的基因相对表达量。
1.4 双荧光素酶报告基因实验
生物信息学网站(http://www.targetscan.org/)分析显示CD151是miR-199a-3p的潜在靶点,选用荧光素酶报告分析,构建野生型和突变型CD151 3′-UTR荧光素酶报告基因质粒,转染至B-CPAP细胞。按照双荧光素酶报告基因试剂盒说明书检测B-CPAP细胞荧光素酶相对活性。
1.5 CD151过表达
构建pcDNA载体的CD151过表达质粒,转染至B-CPAP细胞,将细胞随机分为3组:Control组、pcDNA-NC组和pcDNA-CD151组,通过qRT-PCR和Western blot检测CD151表达量。Control组细胞不作处理,pcDNA-NC组转染pcDNA-NC,pcDNA-CD151组转染pcDNA-CD151。
1.6 细胞分组
将miR-199a-3p mimic与pcDNA-CD151单独或联合转染至B-CPAP细胞,将细胞随机分为4组:Control组、miR-199a-3p mimic组、pcDNA-CD151组和miR-199a-3p mimic+pcDNA-CD151组。
1.7 BrdU染色检测细胞增殖
取对数生长期B-CPAP细胞接种于6孔板内,按方法1.6处理及分组。加入终浓度为0.03 μg/mL的BrdU继续孵育40 min。严格按照说明书进行细胞增殖检测。镜下观察并计数BrdU阳性细胞数。
1.8 流式细胞术检测细胞凋亡率
使用Annexin Ⅴ-FITC细胞凋亡检测试剂盒,通过流式细胞术检测细胞凋亡率。Annexin Ⅴ-FITC(-)/ PI(-)(左下)为正常细胞,Annexin Ⅴ-FITC(+)/ PI(-)细胞(右下)为早期凋亡细胞,Annexin Ⅴ-FITC(+)/ PI(+)(右上)为晚期凋亡细胞。Annexin Ⅴ(-)/ PI(+)(左上)为坏死细胞。
1.9 Transwell检测细胞侵袭能力
Transwell小室加入50 μL基质胶并于37 ℃孵育3 h凝固。将1.6所述分组处理的细胞接种于Transwell小室上室,其中上室为无血清培养液,下室为完全培养液,培养48 h后擦除未穿过膜的细胞,再以多聚甲醛固定,1%结晶紫染色,200倍放大视野下拍照观察并计数。每组取3个随机视野,计数视野中的染色细胞数目即为侵袭细胞数。
1.10 Western blot检测MMP-2、Ki-67、Cyclin D1、E-cadherin、N-cadherin、Vimentin蛋白表达
按方法1.6处理各组细胞,用RIPA裂解液提取各组B-CPAP细胞蛋白,BCA试剂盒检测总蛋白后每组取20 μg蛋白在10% SDS-PAGE中电泳分离蛋白,并转移至聚偏二氟乙烯(PVDF)膜,5%脱脂乳封闭2 h,一抗(1∶1000)4 ℃孵育过夜。PBS缓冲液清洗3次后加入2抗(1∶10000)继续孵育2 h,ECL显色液显影,以actin为内参。
1.11 统计学方法
2 结果
2.1 CD151与miR-199a-3p的靶向关系
通过Targetscan预测得到CD151的3′-UTR有miR-199a-3p的结合位点(图1A),提示CD151与miR-199a-3p可能存在靶向作用关系。在B-CPAP细胞中转染miR-199a-3p mimic,通过qRT-PCR检测miR-199a-3p与CD151 mRNA的表达水平。结果显示,与Control组比较,miR-199a-3p mimic组CD151 mRNA表达水平降低(P<0.01,图1B、1C)。双荧光素酶报告基因实验显示,CD151 Wt组加入miR-199a-3p mimic处理后荧光素酶活性降低(P<0.01,图1D)。
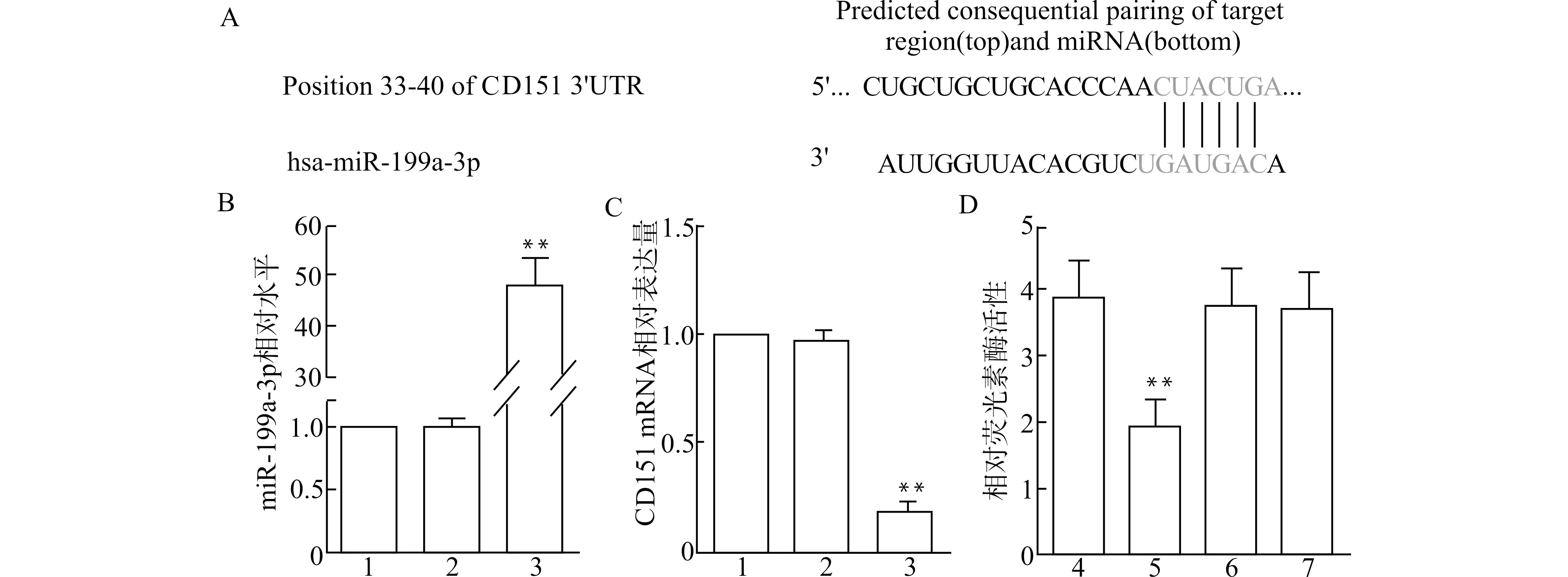
1:Control组;2:mimic-NC组;3:miR-199a-3p mimic组;4:CD151 Wt组;5:CD151 Wt+miR-199a-3p mimic组;6:CD151 Mut组;7:CD151 Mut+miR-199a-3p mimic组;A:Targetscan预测靶向关系;B:qRT-PCR检测miR-199a-3p表达水平,与Control组比较,**P<0.01;C:qRT-PCR检测CD151 mRNA的表达水平,与Control组比较,**P<0.01;D:双荧光素酶报告基因实验验证靶向关系,与CD151 Wt组比较,**P<0.01图1 CD151与miR-199a-3p的靶向关系Fig.1 Targeting relationship between CD151 and miR-199a-3p
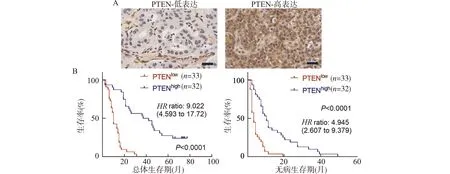
A:胆管癌组织样本中PTEN免疫组化染色结果(×200);B:PTEN高表达患者与低表达患者的总体生存期与无病生存期分析图1 PTEN在胆管癌组织中的表达及其与患者预后的关系Fig.1 Immunohistochemical staining of PTEN in clinical patients with cholangiocarcinoma and the relationship between PTEN expression and prognosis
2.2 在B-CPAP细胞中过表达CD151
通过qRT-PCR和Western blot检验CD151过表达是否成功(图2)。与Control组比较,pcDNA-CD151组CD151 mRNA水平和蛋白表达水平均升高,差异有统计学意义(均P<0.01)。
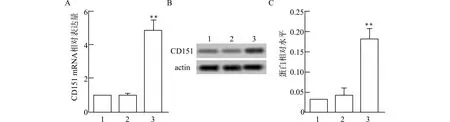
1:Control组,2:pcDNA-NC组,3:pcDNA-CD151组;A:CD151 mRNA表达水平统计图;B:CD151蛋白表达蛋白条带;C:半定量分析CD151蛋白表达水平;与Control组比较,**P<0.01图2 在B-CPAP细胞中过表达CD151Fig.2 Overexpression of CD151 in B-CPAP cells
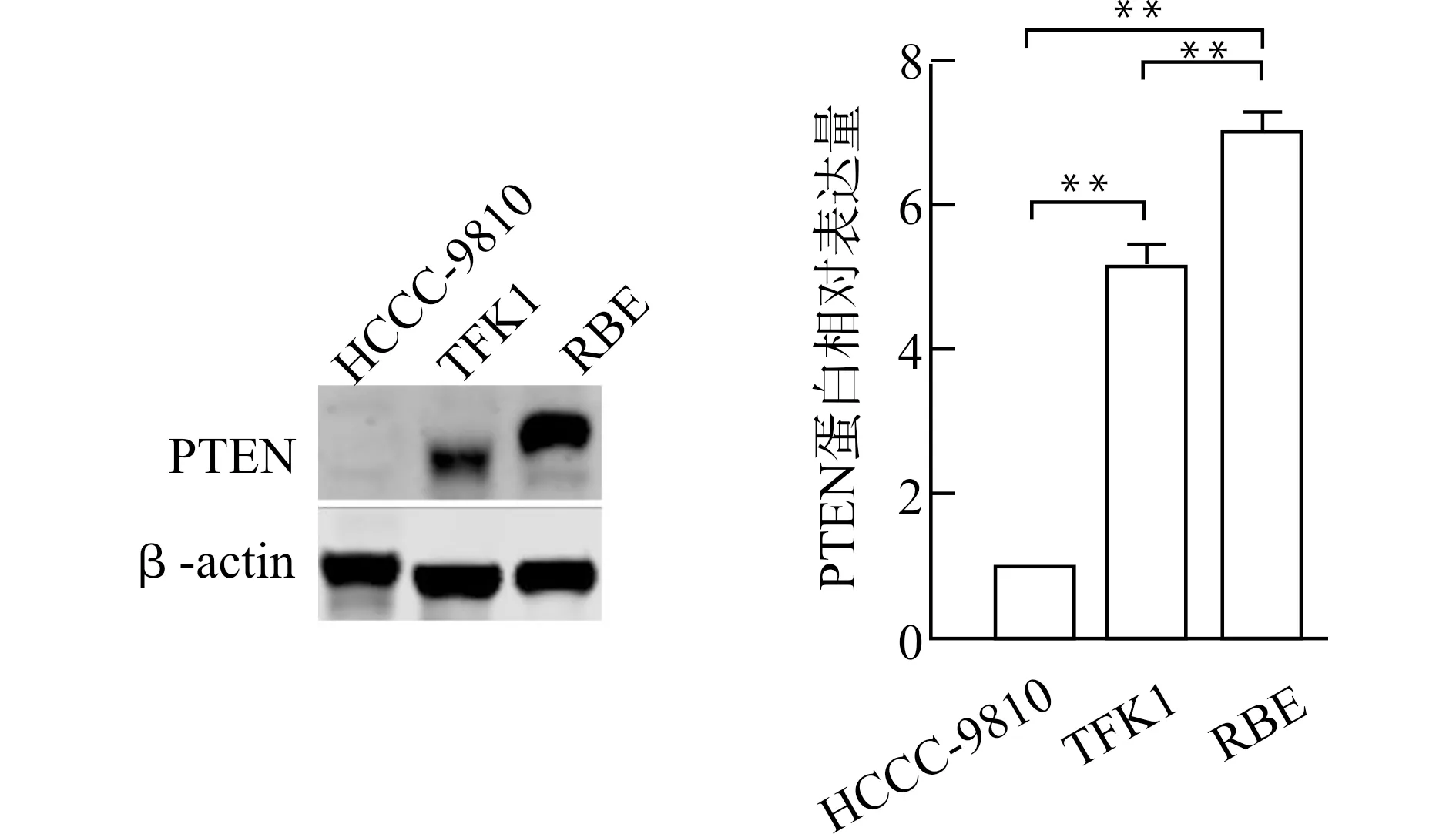
**P<0.01图2 三种胆管癌细胞系中PTEN蛋白的表达情况Fig.2 Expression of PTEN in cholangiocarcinoma cell lines
2.3 miR-199a-3p过表达靶向CD151抑制B-CPAP细胞增殖
通过BrdU染色检测B-CPAP细胞的增殖能力(图3)。与Control组相比较,miR-199a-3p mimic组BrdU阳性细胞数减少,pcDNA-CD151组BrdU阳性细胞数增加,差异有统计学意义(均P<0.01);与pcDNA-CD151组相比较,miR-199a-3p mimic+pcDNA-CD151组BrdU阳性细胞数减少(P<0.01)。
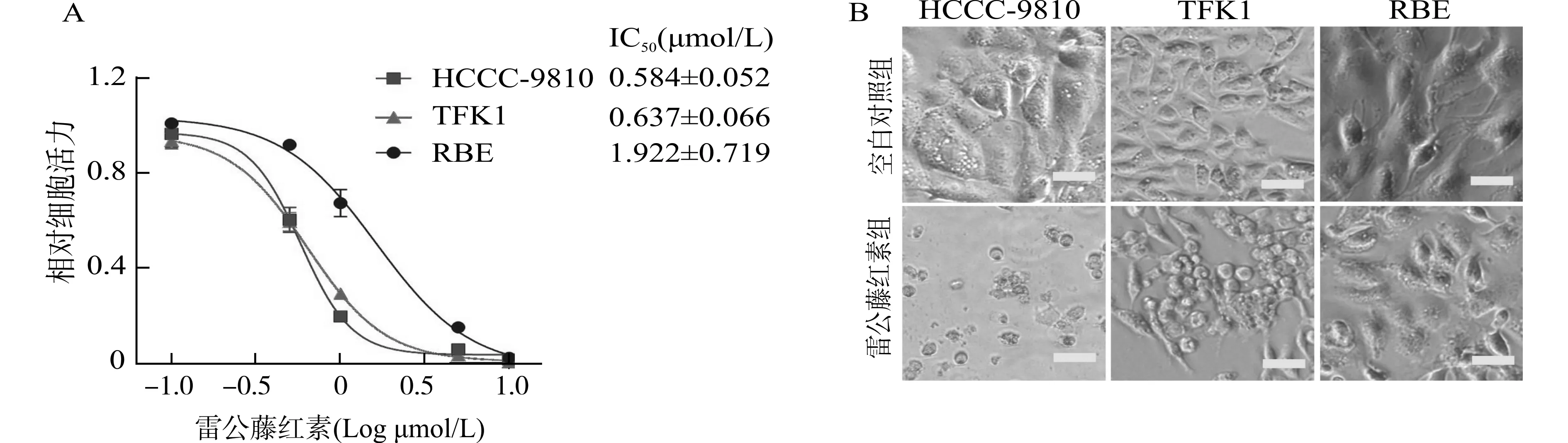
A:3种胆管癌细胞系对雷公藤红素的药物敏感性;B:经雷公藤红素处理后胆管癌细胞系的形态变化,标尺=20 μm图3 雷公藤红素对胆管癌细胞活力和形态的影响Fig.3 Effect of Celastrol on viability and morphology of cholangiocarcinoma cells
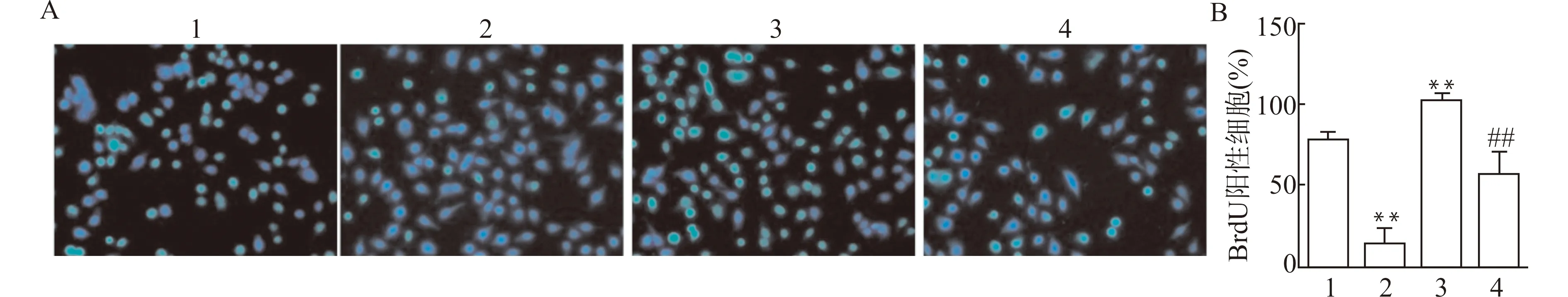
1:Control组,2:miR-199a-3p mimic组,3:pcDNA-CD151组,4:miR-199a-3p mimic+pcDNA-CD151组;A:BrdU染色结果(×200);B:半定量分析各组B-CPAP细胞BrdU阳性细胞占比,与Control组比较,**P<0.01,与pcDNA-CD151组比较,##P<0.01图3 miR-199a-3p过表达靶向CD151对B-CPAP细胞增殖的影响Fig.3 The effect of miR-199a-3p overexpression targeting CD151 on the proliferation of B-CPAP cells
2.4 miR-199a-3p过表达靶向CD151促进B-CPAP细胞凋亡
通过流式细胞术检测B-CPAP细胞凋亡率(图4)。与Control组比较,miR-199a-3p mimic组细胞凋亡率升高,pcDNA-CD151组细胞凋亡率降低,差异有统计学意义(均P<0.01)。与pcDNA-CD151组比较,miR-199a-3p mimic+pcDNA-CD151组细胞凋亡率升高,差异有统计学意义(P<0.01)。
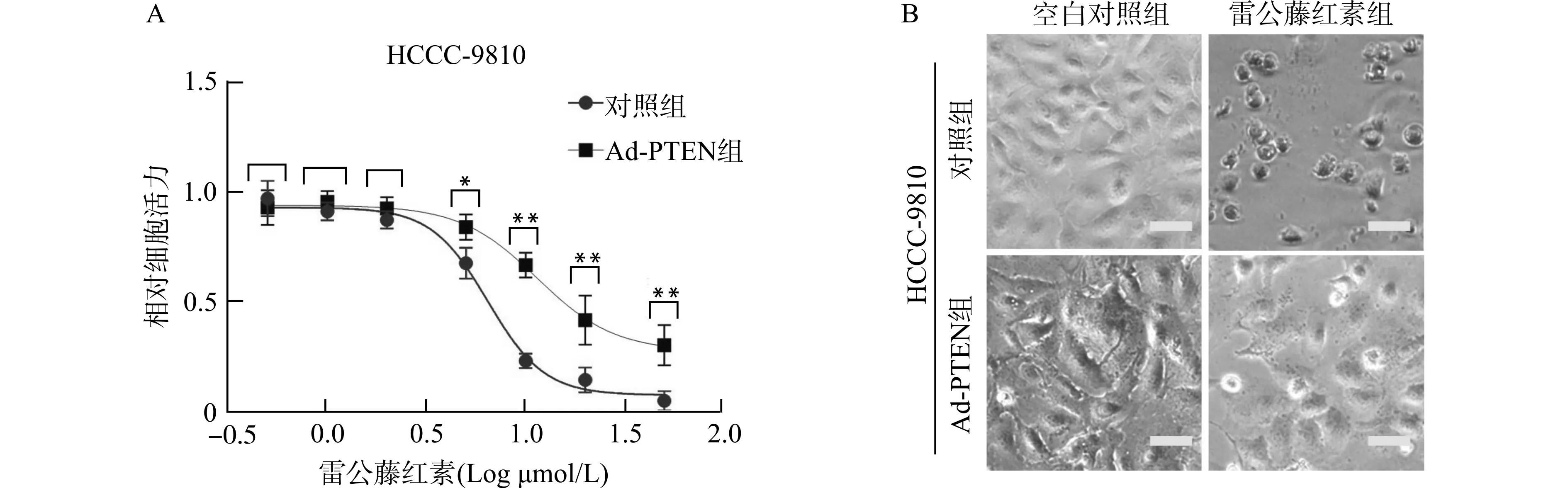
A:CellTiter细胞活力检测,与对照组比较,*P<0.05 **P<0.01;B:光镜下细胞形态观察,标尺=20 μm图4 PTEN调控HCCC-9810细胞对雷公藤红素的敏感性Fig.4 PTEN regulates sensitivity of HCCC-9810 cells to Celastrol
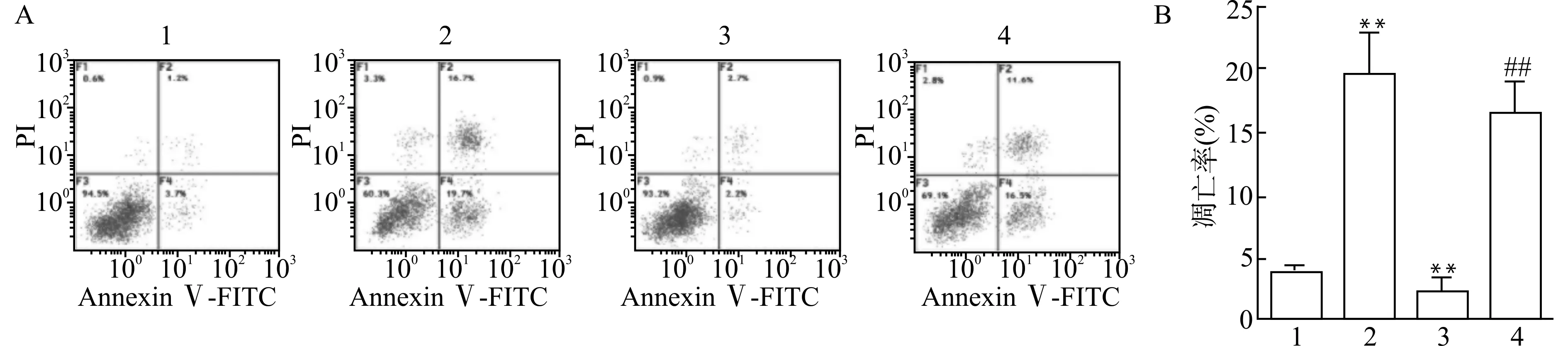
1:Control组,2:miR-199a-3p mimic组,3:pcDNA-CD151组,4:miR-199a-3p mimic+pcDNA-CD151组;A:流式细胞仪检测各组B-CPAP细胞凋亡率;B:半定量分析各组B-CPAP细胞细胞凋亡率;与Control组比较,**P<0.01;与pcDNA-CD151组比较,##P<0.01图4 miR-199a-3p过表达靶向CD151对B-CPAP细胞凋亡的影响Fig.4 Effects of miR-199a-3p overexpression targeting CD151 on apoptosis of B-CPAP cells
2.5 miR-199a-3p过表达靶向CD151调控B-CPAP细胞周期分布
通过流式分选检测细胞周期(图5)。与Control组比较,miR-199a-3p mimic组G2/M和G1期比例降低,S期比例升高,pcDNA-CD151组G2/M和G1期比例升高,S期比例降低,差异有统计学意义(均P<0.05)。与pcDNA-CD151组比较,miR-199a-3p mimic+pcDNA-CD151组G2/M和G1期比例降低,S期比例升高,差异有统计学意义(均P<0.01)。
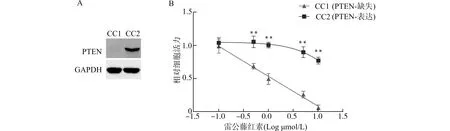
CC1:原代人胆管癌细胞1,CC2原代人胆管癌细胞2;A:Western blot检测PDCs中PTEN表达;B:CellTiter检测细胞活力,与CCT1比较,**P<0.01图5 PTEN表达/缺失的PDCs对雷公藤红素的敏感性Fig.5 Sensitivity of PTEN-positive or PTEN-negative PDCs to Celastrol
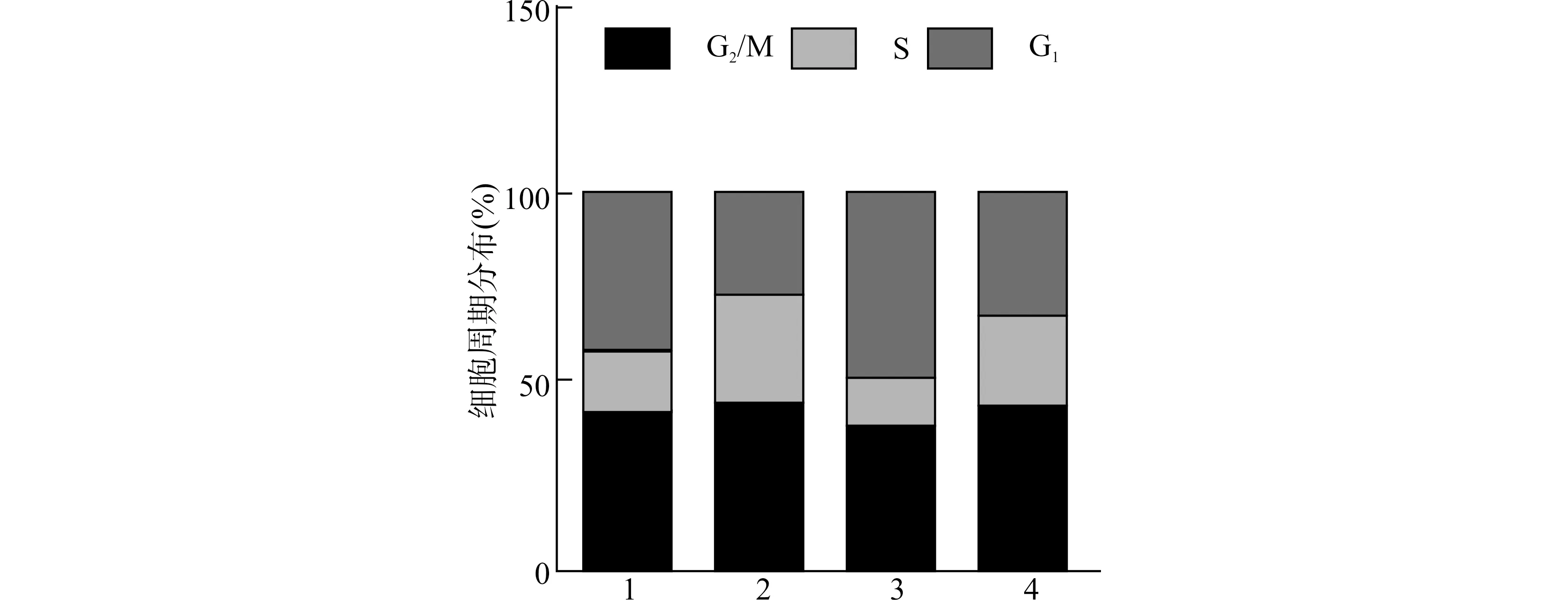
1:Control组;2:miR-199a-3p mimic组;3:pcDNA-CD151组;4:miR-199a-3p mimic+pcDNA-CD151组图5 miR-199a-3p过表达靶向CD151对B-CPAP细胞周期分布的影响Fig.5 The effect of miR-199a-3p overexpression targeting CD151 on the cell cycle distribution of B-CPAP cells
2.6 miR-199a-3p过表达靶向CD151降低B-CPAP细胞侵袭能力
通过Transwell检测B-CPAP细胞侵袭能力(图6)。与Control组比较,miR-199a-3p mimic组侵袭细胞数减少,pcDNA-CD151组侵袭细胞数增加,差异有统计学意义(均P<0.01)。与pcDNA-CD151组比较,miR-199a-3p mimic+pcDNA-CD151组侵袭细胞数减少,差异有统计学意义(P<0.01)。
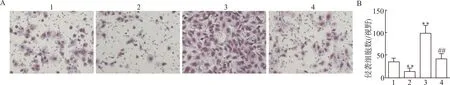
1:Control组,2:miR-199a-3p mimic组,3:pcDNA-CD151组,4:miR-199a-3p mimic+pcDNA-CD151组;A:Transwell检测各组B-CPAP细胞侵袭细胞数(×200);B:半定量分析各组B-CPAP细胞侵袭细胞数,与Control组比较,**P<0.01,与pcDNA-CD151组比较,##P<0.01图6 miR-199a-3p过表达靶向CD151对B-CPAP细胞侵袭的影响Fig.6 The effect of miR-199a-3p overexpression on the invasion of B-CPAP cells
2.7 miR-199a-3p过表达靶向CD151降低B-CPAP细胞MMP-2、Ki-67、Cyclin D1蛋白表达
通过Western blot检测B-CPAP细胞MMP-2、Ki-67、Cyclin D1蛋白表达(图7)。与Control组比较,miR-199a-3p mimic组MMP-2、Ki-67、Cyclin D1蛋白表达降低,pcDNA-CD151组MMP-2、Ki-67、Cyclin D1蛋白表达升高,差异有统计学意义(均P<0.01);与pcDNA-CD151组比较,miR-199a-3p mimic+pcDNA-CD151组MMP-2、Ki-67、Cyclin D1蛋白表达降低,差异有统计学意义(均P<0.01)。
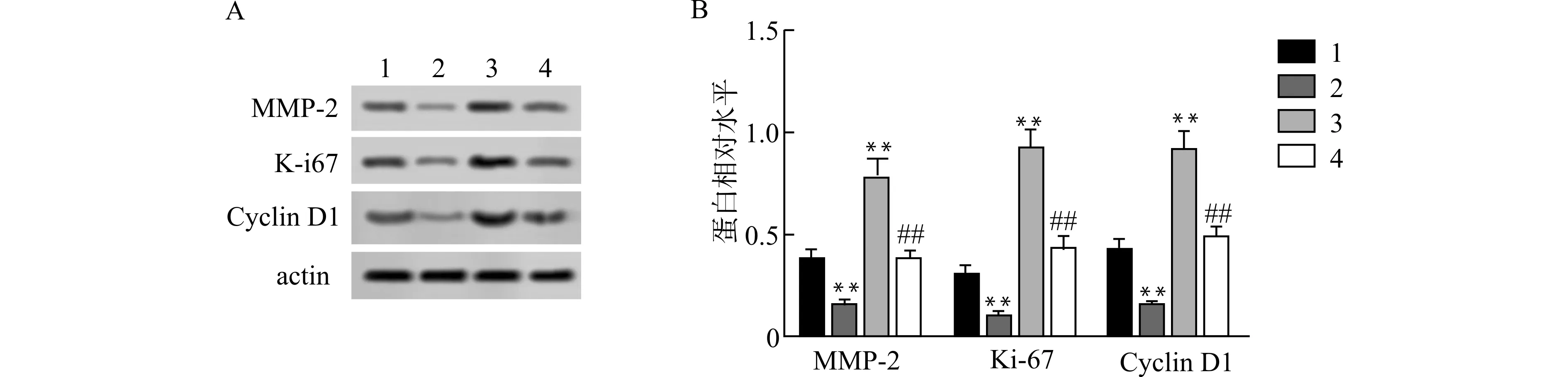
1:Control组,2:miR-199a-3p mimic组,3:pcDNA-CD151组,4:miR-199a-3p mimic+pcDNA-CD151组;A:Western blot检测各组B-CPAP细胞MMP-2、Ki-67、Cyclin D1蛋白表达;B:半定量分析各组B-CPAP细胞MMP-2、Ki-67、Cyclin D1蛋白表达,与Control组比较,**P<0.01,与pcDNA-CD151组比较,##P<0.01图7 miR-199a-3p过表达靶向CD151对B-CPAP细胞MMP-2、Ki-67、Cyclin D1蛋白表达的影响Fig.7 Effects of miR-199a-3p overexpression targeting CD151 on the protein expressions of MMP-2,Ki-67 and Cyclin D1 in B-CPAP cells
2.8 miR-199a-3p过表达靶向CD151升高E-cadherin蛋白表达,降低N-cadherin、Vimentin蛋白表达
通过Western blot检测B-CPAP细胞E-cadherin、N-cadherin、Vimentin蛋白表达(图8)。与Control组比较,miR-199a-3p mimic组E-cadherin蛋白表达升高,N-cadherin、Vimentin蛋白表达降低,pcDNA-CD151组E-cadherin蛋白表达降低,N-cadherin、Vimentin蛋白表达升高,差异有统计学意义(均P<0.01);与pcDNA-CD151组比较,miR-199a-3p mimic+pcDNA-CD151组E-cadherin蛋白表达升高,N-cadherin、Vimentin蛋白表达降低,差异有统计学意义(均P<0.01)。
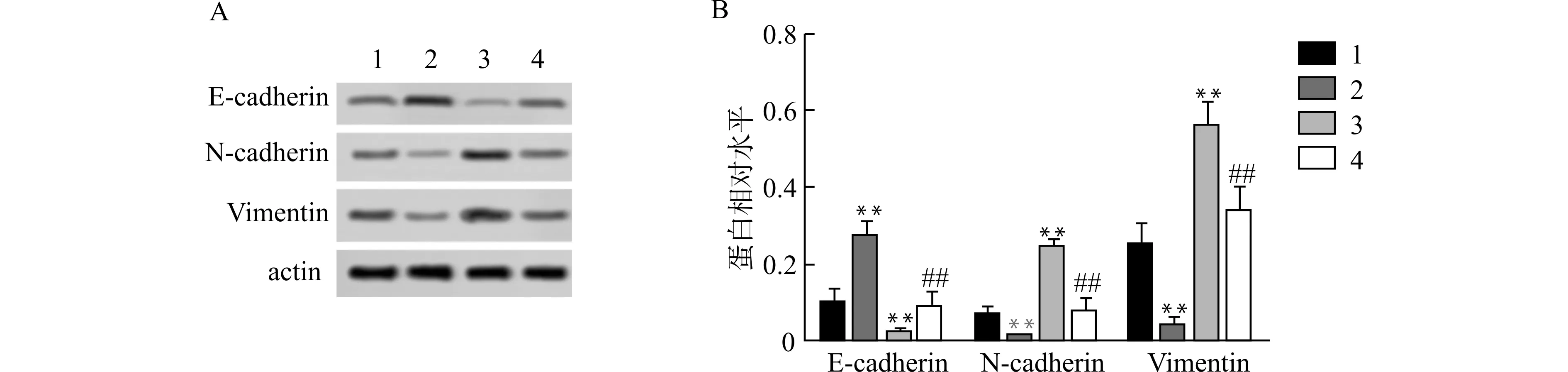
1:Control组,2:miR-199a-3p mimic组,3:pcDNA-CD151组,4:miR-199a-3p mimic+pcDNA-CD151组;A:Western blot检测各组B-CPAP细胞E-cadherin、N-cadherin、Vimentin蛋白表达;B:半定量分析各组B-CPAP细胞E-cadherin、N-cadherin、Vimentin蛋白表达;与Control组比较,**P<0.01;与pcDNA-CD151组比较,##P<0.01图8 miR-199a-3p过表达靶向CD151对B-CPAP细胞E-cadherin、N-cadherin、Vimentin蛋白表达的影响Fig.8 Effects of miR-199a-3p overexpression targeting CD151 on the protein expressions of E-cadherin,N-cadherin and Vimentin in B-CPAP cells
3 讨论
近年来,越来越多的研究表明miRNA通过调控细胞生理功能在甲状腺癌发生发展中发挥重要的作用,为甲状腺癌的诊断与治疗提供了新的研究方向[5]。在本研究中,生物信息学分析预测CD151是miR-199a-3p的靶基因。CD151参与肿瘤组织间肌动蛋白骨架重排,与甲状腺乳头状癌侵袭转移密切相关[6-7]。
细胞异常增殖是癌症发生和发展的重要组成部分,Ki-67是一种与细胞增殖相关的核抗原,参与多种恶性肿瘤细胞的增殖与侵袭,其在甲状腺癌中高表达[8]。细胞周期阻滞是细胞分化过程中的必要事件,Cyclin D1作为调控细胞周期依赖性蛋白激酶(CDK)的主要组成部分,具有灭活Rb的作用,并协同CDK发挥调控细胞周期的作用,使之从G1期进展为S期。Cyclin D1蛋白高表达会诱导细胞增殖,且可能引起细胞恶性转化[9]。本研究发现miR-199a-3p过表达靶向CD151,降低G2/M、G1期比例和Cyclin D1、Ki-67蛋白表达,升高S期比例。提示miR-199a-3p过表达靶向CD151通过调控周期分布抑制B-CPAP细胞增殖。
本研究通过流式和Transwell实验发现,miR-199a-3p过表达靶向CD151升高B-CPAP细胞凋亡率,降低侵袭细胞数。MMP-2异常高表达是甲状腺癌发生颈部淋巴结转移的独立危险因素[10]。miR-199a-3p与多种恶性肿瘤细胞的恶性增殖、凋亡和侵袭密切相关。邢晓伟等[11]研究发现过表达miR-199a-3p可抑制mTOR的表达引起骨肉瘤细胞自噬从而促进细胞凋亡降低细胞增殖。张丽娟等[12]研究发现miR-199a-3p可能通过抑制c-Met、MMP-2和CD44蛋白的表达进而影响卵巢癌SK0V3细胞的侵袭和迁移。提示miR-199a-3p过表达靶向CD151可诱导B-CPAP细胞凋亡,并抑制细胞侵袭。
本研究通过Western blot实验发现,miR-199a-3p过表达靶向CD151升高B-CPAP细胞E-cadherin蛋白表达,降低N-cadherin、Vimentin蛋白表达。在肿瘤细胞的侵袭和迁移中,EMT起着关键的作用,通过EMT,肿瘤细胞失去细胞粘附和极性,获得间叶细胞的特性,包括迁移、侵袭及干样特性[13]。在正常上皮组织中,E-cadherin可以维持紧密的细胞连接,限制细胞的运动和转移,而N-cadherin主要分布在神经和内皮细胞间叶组织,与细胞的运动和侵袭能力有关[14]。Vimentin是间质细胞中的中间纤维,与微丝和微管共同构成了细胞支架网络,负责维持细胞骨架的完整性[15-16]。EMT的主要特点是E-cadherin高表达和N-cadherin及Vimentin的过表达[17]。表明miR-199a-3p过表达靶向CD151抑制B-CPAP细胞EMT。
综上所述,miR-199a-3p过表达可抑制B-CPAP细胞增殖、侵袭和EMT,诱导细胞凋亡。双荧光素酶报告实验证实miR-199a-3p能够靶向结合CD151,并可负向调控CD151的表达,CD151过表达可逆转miR-199a-3p过表达对B-CPAP细胞增殖、凋亡、侵袭和EMT的作用效应。探讨miR-199a-3p及CD151之间的调控关系有望成为临床治疗甲状腺癌的新靶点。

