异氟醚通过HMGB1介导大鼠海马神经细胞的自噬和凋亡*
李明霞, 饶瑞林, 曾小华, 彭 湃, 杨 军
长江航运总医院/武汉脑科医院麻醉科,武汉 430010
异氟醚(isoflurane,ISO)是一种临床常用的吸入性麻醉剂,能够引起大脑海马区功能异常,并导致认知功能障碍[1]。大量研究发现,ISO能够诱导神经细胞的凋亡、氧化应激和线粒体功能障碍,引起神经细胞损伤,但其引起损伤的机制尚不明确[2-3]。高迁移率族蛋白B1(high mobility group box 1,HMGB1)是一种高度保守的核蛋白,存在于所有细胞类型中[4]。研究表明,神经细胞表面或细胞外基质中的HMGBl有助于神经突的生长和细胞的迁移,并能介导损伤后的神经炎症反应,在创伤性脑损伤、中风、癫痫、多发性硬化症等中枢神经系统的免疫相关疾病中发挥重要作用,但HMGB1的调控机制仍不清楚[5-6]。自噬是维持神经细胞稳态的重要过程,该过程可以将神经细胞中错误折叠的蛋白质、受损细胞器和病原体等清除[7]。研究发现,神经损伤在某些情况下可激活神经细胞的自噬,在病理状态早期,自噬能及时清除受损的细胞器和蛋白,维持细胞内环境的稳定,起保护作用;而到病理状态晚期,自噬已不能逆转细胞死亡,细胞器被大量降解导致自噬性细胞死亡[8]。研究表明,HMGBl可通过直接与自噬蛋白Beclin1相互作用调节自噬[9]。因此,本研究假设ISO通过HMGB1介导大鼠海马神经细胞自噬;为验证该假设,我们建立ISO诱导的麻醉大鼠动物模型,通过病理学检测和分子生物学检测技术,探究ISO对大鼠神经细胞损伤的作用机制,为全身麻醉后认知功能障碍的研究提供实验依据。
1 材料与方法
1.1 实验动物
SPF级SD雌性大鼠,6~8周龄,共72只,来源于湖南斯莱克景达实验动物有限公司。实验动物使用许可证号:SYXK(鄂)2018-0104,饲养环境为温度22~26℃,相对湿度50%~60%,人工光照明暗各12 h。适应性饲养7 d。
1.2 主要试剂和仪器
用于HMGB1过表达的重组慢病毒载体(Lv-HMGB1)和用于HMGB1敲除的短发夹RNA(sh-HMGB1)的重组慢病毒由武汉华联科生物技术有限公司合成,sh-HMGB1的序列为5′-CGGAGGAAAATCAACTAAACATG-3′。异氟醚和小动物呼吸麻醉机购于玉研仪器,免疫组化所用一抗、免疫印迹所用一抗和二抗购于Bioswamp公司,免疫组化所用二抗购于迈新公司,BCA蛋白浓度测定试剂盒、伊红、DAB浓缩型试剂盒、中性树脂、封闭山羊血清购于Solarbio公司,苏木精、尼氏体染色液购于Servicebio公司,Trizol购于Ambion公司,SYBR FAST qPCR Master Mix购于KAPA Biosystems公司,逆转录试剂盒购于TaKaRa公司。电泳仪、荧光定量PCR仪购于Bio-Rad公司,酶标仪购于雷勃公司,正置显微镜、石蜡切片机购于徕卡显微系统有限公司。
1.3 模型构建及分组
将64只大鼠随机分为4组,对照组(CON组)、异氟醚组(ISO组)、ISO+Lv-HMGB1组、ISO+sh-HMGB1组,每组16只。对照组大鼠尾静脉注射100 μL生理盐水,30 min后暴露于混合空气4 h;异氟醚组大鼠尾静脉注射100 μL生理盐水,30 min后暴露于1.8%异氟醚4 h[10];ISO+Lv-HMGB1组大鼠尾静脉注射1×108PFU Lv-HMGB1,30 min后暴露于1.8%异氟醚4 h;ISO+sh-HMGB1组大鼠尾静脉注射1×108PFU sh-HMGB1,30 min后暴露于1.8%异氟醚4 h。
1.4 Morris水迷宫测试大鼠神经功能
干预前4 d进行适应性训练,水迷宫内注水将平台放置在第3象限,每只大鼠分别在4个象限圆弧中线位置面朝水池壁放入水中作为起点,设定寻找时间为1 min,若1 min内未发现平台,则引导大鼠在平台停留20 s。每天固定时间开始训练,每天训练4次,每次训练间隔至少20 min。各组大鼠处理完成24 h后,依次进行定位航行实验、空间探索实验和可视站台实验,记录并分析大鼠的潜伏期、运动轨迹图、1 min内穿越平台的次数和目标象限停留的时间和路程。
1.5 免疫组化检测大鼠海马组织中HMGB1的表达
神经功能测试完成24 h后,处死动物,取海马组织。利用免疫组化法对大鼠海马组织中HMGB1的表达水平进行检测。海马组织经固定、石蜡包埋、切片,常规脱蜡至水,切片置于0.01 mol/L柠檬酸钠缓冲溶液中高压修复23 min,冷却后PBS洗涤3次,置于3% H2O2中孵育10 min,10%山羊血清封闭30 min,加入一抗稀释液(1∶100),4℃孵育过夜,次日PBS冲洗3次后加入maxvision二抗,37℃孵育1 h,PBS洗涤后DAB显色,去除染色液,用苏木精复染3 min,1%盐酸乙醇分化,自来水冲洗10 min,乙醇梯度脱水,透明,封片。
1.6 苏木精-伊红(HE)和尼氏染色观察大鼠海马组织神经细胞和尼氏体
将固定好的大鼠海马组织按照常规步骤脱水浸蜡包埋后进行切片,厚度约为3 μm,水浴展片,烤片后分别进行HE染色和尼氏染色,染色完成后显微镜拍照,观察海马组织中神经细胞和尼氏体。
1.7 透射电镜观察大鼠海马组织神经细胞超微结构
用3%的戊二醛固定海马组织,48 h后用PBS冲洗,再先后置于0.1%锇酸和1%醋酸铀中固定2 h,环氧树脂包埋后进行切片,厚度约2 μm,醋酸双氧铀和柠檬酸铅染色15 min,透射电镜下观察大鼠海马组织神经细胞核仁、内质网及线粒体等结构和自噬小体的形成。
1.8 自噬和凋亡相关指标的检测
提取大鼠海马组织总RNA,利用逆转录试剂盒合成cDNA,qRT-PCR检测自噬(LC3-Ⅰ、LC3-Ⅱ、Beclin1、P62)和凋亡(Bax、Bcl-2、Caspase-3)相关基因mRNA的表达。引物序列见表1。以GAPDH为内参,2-ΔΔCt法计算目的基因的相对表达量。另提取海马组织总蛋白,BCA法测定蛋白浓度,Western blot检测大鼠海马组织中自噬和凋亡相关蛋白的表达。

表1 引物序列Table 1 Primer sequences
1.9 统计学方法
利用SPSS 20.0进行数据分析,结果用“平均值±标准差”表示,组间比较采用单因素方差分析。以P<0.05表示差异具有统计学意义。
2 结果
2.1 各组大鼠Morris水迷宫实验结果比较
定位航向实验结果显示,与对照组相比,ISO组的潜伏期显著延长(P<0.01);与ISO组相比,过表达HMGB1后潜伏期进一步延长(P<0.01),而敲低HMGB1后潜伏期显著缩短(P<0.05),见图1A。
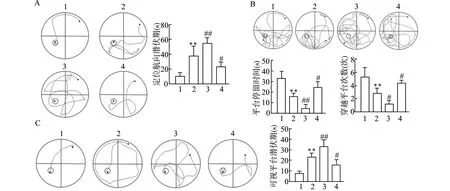
A:定位航向实验结果;B:空间探索实验结果;C:可视平台实验结果;1:CON组;2:ISO组;3:ISO+Lv-HMGB1组;4:ISO+sh-HMGB1组;与CON组比较,**P<0.01;与ISO组比较,#P<0.05 ##P<0.01图1 各组大鼠水迷宫实验结果Fig.1 Morris water maze experiment results of rats in each group
空间探索实验结果显示,与对照组相比,ISO组大鼠在平台停留的时间及穿过平台的次数均显著减少(均P<0.01);与ISO组相比,过表达HMGB1后大鼠在平台停留的时间及穿过平台的次数均进一步减少(均P<0.05),而敲低HMGB1后大鼠在平台停留的时间及穿过平台的次数均较ISO组显著增加(均P<0.05),见图1B。可视平台实验结果显示,与对照组相比,ISO组的潜伏期显著延长(P<0.01);与ISO组相比,过表达HMGB1后潜伏期进一步延长(P<0.01),而敲低HMGB1后潜伏期显著缩短(P<0.05),见图1C。
2.2 各组大鼠海马组织中HMGB1的表达情况
免疫组化实验结果显示,与对照组相比,ISO组海马组织中HMGB1的阳性表达显著增多(P<0.01);与ISO组相比,过表达HMGB1后HMGB1的阳性表达进一步增多(P<0.01),而敲低HMGB1后HMGB1的阳性表达显著减少(P<0.05)。见图2。
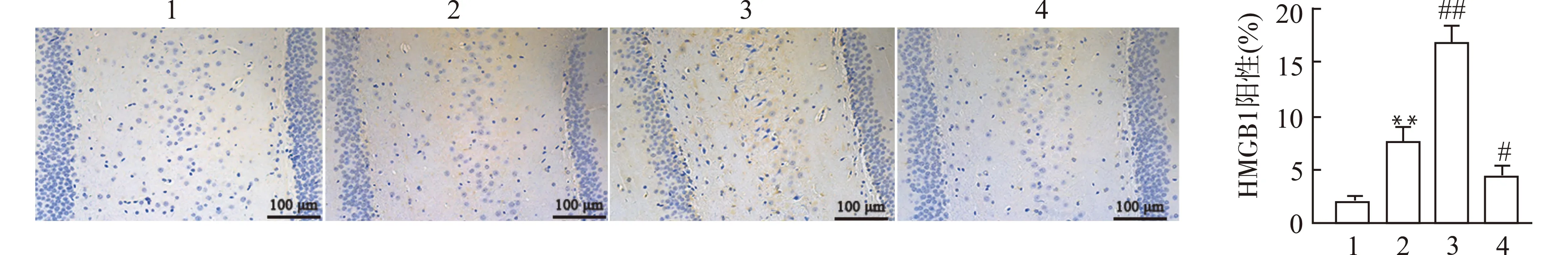
1:CON组;2:ISO组;3:ISO+Lv-HMGB1组;4:ISO+sh-HMGB1组;与CON组比较,**P<0.01;与ISO组比较,#P<0.05 ##P<0.01图2 各组大鼠海马组织中HMGB1的表达情况(免疫组化染色)Fig.2 Expression of HMGB1 in hippocampal tissue of rats in each group(immunohistochemistry staining)
2.3 各组大鼠海马组织神经细胞损伤情况
HE染色结果显示,对照组大鼠海马组织神经细胞排列整齐,核清晰;与对照组相比,ISO组神经细胞间隙变大,神经数量显著减少,细胞排列稀疏,核固缩;与ISO组相比,过表达HMGB1后神经细胞间隙进一步增大,神经细胞数量进一步减少,细胞排列紊乱,细胞出现坏死和变形,而敲低HMGB1后神经细胞排列趋于整齐,神经细胞数量显著增多,核清晰,偶见细胞核深染。见图3。
2.4 各组大鼠海马中尼氏体变化
尼氏染色结果显示,对照组大鼠海马中尼氏体呈深蓝色颗粒状,锥体细胞排列规则,形态结构正常;ISO组海马中尼氏体浅染,椎体细胞排列紊乱,细胞数量显著减少,胞膜皱缩,核固缩;ISO+Lv-HMGB1组较ISO组尼氏体染色更浅,细胞肿胀,出现空泡现象,而ISO+sh-HMGB1组较ISO组尼氏体染色变深,细胞损伤也有所缓解,空泡细胞变少。见图4。
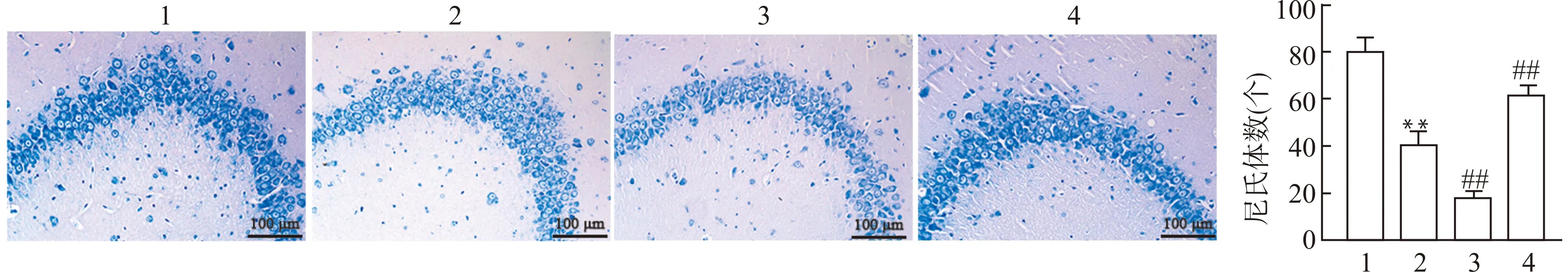
1:CON组;2:ISO组;3:ISO+Lv-HMGB1组;4:ISO+sh-HMGB1组;与CON组比较,**P<0.01;与ISO组比较,##P<0.01图4 各组大鼠海马中尼氏体变化(尼氏染色)Fig.4 Changes of Nissl bodies in hippocampal of rats in each group(Nissl staining)
2.5 各组大鼠海马组织中神经细胞超微结构
透射电镜结果显示,对照组神经细胞线粒体结构正常,呈椭圆形,嵴清晰,未见自噬体形成;ISO组线粒体嵴断裂、消失,甚至出现空泡化,可见大量自噬体结构;与ISO组相比,过表达HMGB1后线粒体损伤加重,空泡化现象增多,自噬体数量进一步增多,而敲低HMGB1后线粒体形态明显改善,空泡化减少,自噬体数量减少。见图5。
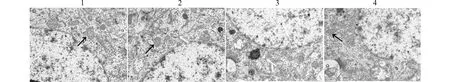
1:CON组;2:ISO组;3:ISO+Lv-HMGB1组;4:ISO+sh-HMGB1组;黑色箭头示线粒体,白色箭头示自噬体图5 各组大鼠海马组织神经细胞超微结构(×8000)Fig.5 Ultrastructure of nerve cells in hippocampal tissue of rats in each group(×8000)
2.6 各组大鼠海马组织自噬及凋亡相关基因的表达
qRT-PCR检测结果显示,与对照组相比,ISO组LC3-Ⅰ、P62、Bcl-2 mRNA的表达量显著降低(均P<0.01),LC3-Ⅱ、Beclin1、Caspase-3、Bax mRNA的表达量显著升高(均P<0.01);与ISO组相比,ISO+Lv-HMGB1组LC3-Ⅰ、P62、Bcl-2 mRNA的表达量显著降低(均P<0.01),LC3-Ⅱ、Beclin1、Caspase-3、Bax mRNA的表达量显著升高(均P<0.01),ISO+sh-HMGB1组LC3-Ⅰ、P62、Bcl-2 mRNA的表达量显著升高(均P<0.01),LC3-Ⅱ、Beclin1、Caspase-3、Bax mRNA的表达量显著降低(均P<0.01)。见图6。
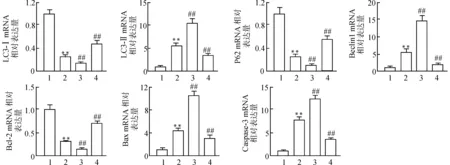
1:CON组;2:ISO组;3:ISO+Lv-HMGB1组;4:ISO+sh-HMGB1组;与CON组比较,**P<0.01;与ISO组比较,##P<0.01图6 各组大鼠海马组织自噬及凋亡相关基因的mRNA表达水平Fig.6 Expression of autophagy and apoptosis-related genes in hippocampal tissue of rats in each group
2.7 各组大鼠海马组织自噬及凋亡相关蛋白的表达
Western blot检测结果显示,与对照组相比,ISO组LC3-Ⅰ、P62、Bcl-2蛋白表达水平显著降低(均P<0.01),LC3-Ⅱ、Beclin1、Caspase-3、Bax蛋白表达水平显著升高(均P<0.01);与ISO组相比,ISO+Lv-HMGB1组LC3-Ⅰ、P62、Bcl-2蛋白表达水平显著降低(均P<0.01),LC3-Ⅱ、Beclin1、Caspase-3、Bax蛋白表达水平显著升高(均P<0.01),ISO+sh-HMGB1组LC3-Ⅰ、P62、Bcl-2蛋白表达水平显著升高(均P<0.01),LC3-Ⅱ、Beclin1、Caspase-3、Bax蛋白表达水平显著降低(均P<0.01)。见图7。
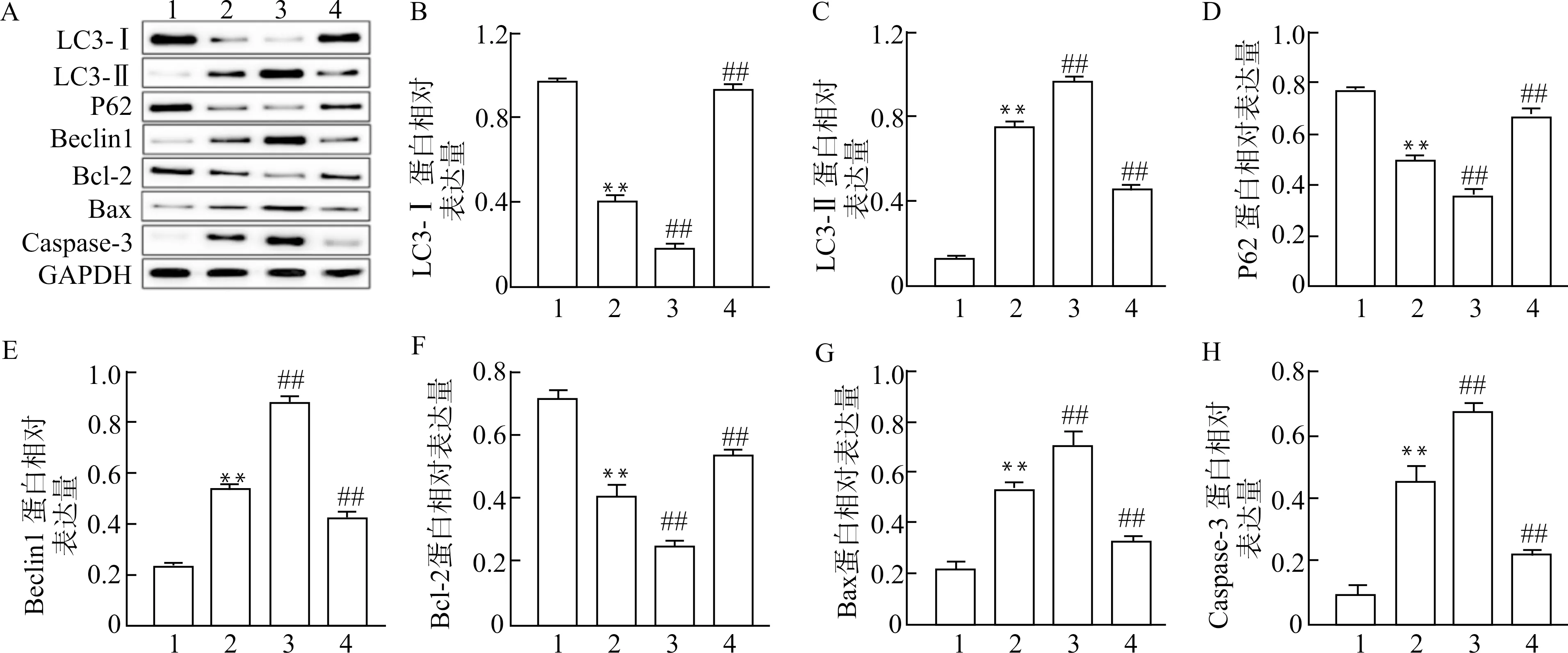
A:Western blot检测结果条带图;B~H:海马组织中LC3-Ⅰ、LC3-Ⅱ、Beclin1、P62、Bax、Bcl-2、Caspase-3蛋白表达结果分析;1:CON组;2:ISO组;3:ISO+Lv-HMGB1组;4:ISO+sh-HMGB1组;与CON组比较,**P<0.01;与ISO组比较,##P<0.01图7 各组大鼠海马组织自噬及凋亡相关基因的蛋白表达水平Fig.7 Expression of autophagy and apoptosis-related proteins in hippocampal tissue of rats in each group
3 讨论
研究发现,ISO能够阻碍大脑海马区功能并导致记忆和认知功能障碍[11]。近年来,ISO引起的神经细胞损伤受到越来越多的关注,Morris水迷宫常用来评估动物的空间学习记忆能力,我们利用Morris水迷宫检测了ISO处理对大鼠神经功能的影响,结果显示,在定位航向和可视平台实验中ISO处理能显著延长大鼠的逃避潜伏期,而空间探索实验中,ISO能显降低大鼠在平台停留时间以及穿越平台的次数,证明ISO对大鼠的学习记忆能力产生了损害,与前人研究结果一致[2-3]。此外,过表达HMGB1后大鼠的学习记忆能力较ISO组进一步降低,而敲低HMGB1表达则会对大鼠学习记忆能力的损害有一定的缓解,提示HMGB1对大鼠的学习记忆能力有损害作用。
研究表明,神经细胞受到损伤刺激时会释放HMGB1[12]。本研究结果显示,ISO诱导处理后大鼠海马组织中HMGB1的表达升高,大鼠海马组织神经细胞数量减少,细胞间隙变大,排列稀疏,核固缩,胞膜皱缩,尼氏体浅染,过表达HMGB1后上述损伤表现加重,而敲低HMGB1表达则会减轻ISO对大鼠神经细胞的损伤,表明HMGB1具有介导大鼠神经细胞损伤的作用。透射电镜结果显示,ISO处理后出现了大量的自噬体结构,线粒体损伤严重,过表达HMGB1后自噬体进一步增多,线粒体损伤进一步加重,而敲低HMGB1表达后自噬体数量减少,线粒体损伤表现也得到了部分逆转,提示HMGB1对大鼠神经细胞的凋亡和自噬具有一定的影响,但其机制还有待进一步研究。
自噬是一种细胞的存活机制,它能够降解细胞中多余的蛋白质和受损细胞器,对于维持细胞的稳态至关重要[13]。自噬过程中,胞质内的LC3-Ⅰ被切割脂化形成LC3-Ⅱ,LC3-Ⅱ随后被募集到自噬体膜上。在自噬体与溶酶体融合过程中,自噬体内的LC3-Ⅱ会被溶酶体蛋白酶降解[14]。因此,LC3-Ⅱ常被作为自噬标记物,LC3-Ⅱ/Ⅰ水平越高,自噬水平越高[15]。P62是一种典型的自噬底物,受到自噬的调控,对于自噬缺失细胞中泛素化蛋白的积累至关重要,激活自噬会降低P62的表达[16]。Beclin1可介导其他自噬蛋白定位到自噬前体结构中,对细胞自噬至关重要[17]。我们的研究结果显示,ISO处理后,神经细胞中LC3-Ⅱ和Beclin1上调,而LC3-Ⅰ和P62下调,过表达HMGB1后上述变化更显著,而敲低HMGB1表达后LC3-Ⅱ和Beclin1下调,LC3-Ⅰ、P62上调,提示HMGB1可通过调节自噬相关蛋白的表达促进大鼠海马神经细胞自噬。自噬与凋亡间存在复杂的关系,有研究表明,激活自噬能够减少凋亡性的细胞死亡,而也有研究表明自噬会促进细胞的凋亡[18-20]。我们又进一步检测了凋亡相关蛋白的表达,结果显示,过表达HMGB1后Bax和Caspase-3的表达较ISO组明显上调,Bcl-2显著下调,而敲低HMGB1表达后趋势相反,提示HMGB1可调节凋亡相关蛋白的表达促进ISO诱导的神经细胞凋亡。张列等[21]也发现下调大鼠神经细胞中HMGB1的表达后,LC3-Ⅱ、Beclin1、Bax和Caspase-3的表达减少,而LC3-Ⅰ和Bcl-2的表达增加,与本研究结果一致,提示HMGB1可促进ISO诱导的大鼠海马神经细胞的自噬和凋亡。
综上表明,ISO可通过上调大鼠海马组织HMGB1表达,促进大鼠海马神经细胞的自噬和凋亡,引起神经细胞损伤。

