1 例PURA 综合征的临床及遗传学特征并文献复习
王秋红,张 淇,王杨阳,卢 倩,敦 硕,邹丽萍
解放军医学院,解放军总医院儿科医学部,北京 100853
富含嘌呤的元件结合蛋白A(purine-rich element-binding protein A,PURA) 基因位于染色体5q31,为编码高度保守的含有322 个氨基酸的PURA 蛋白Pur-alpha。PURA 结构域包括3 个PUR 序列,分别为PURⅠ、PURⅡ和PURⅢ。Pur-alpha 参与基本的细胞功能,包括复制、转录、翻译和细胞生长,对大脑发育、神经元增殖及突触形成具有重要作用[1-2]。PURA 基因变异可导致PURA 综合征(OMIM 600473),主要表现为发育落后、新生儿期肌张力低下/喂养困难/呼吸异常、运动障碍、癫痫、面部畸形特征等;亦可存在头颅MRI 异常,多为非特异性,主要见于髓鞘形成延迟[3-6]。目前国内仅报道2 例PURA 综合征。本研究报道了1 例以肌张力减退为主要表现的PURA 综合征患者,回顾总结了相关文献,加强临床医师对该病的认识,并强调早期遗传学检测的重要性。
病例资料
1 临床表现 患儿男,2 岁10 月龄,因“肌张力低下2 年余”于2022 年6 月就诊于解放军总医院,患儿系第2 胎第2 产,胎龄41+5 周,经阴道分娩,出生时体质量3.8 kg,头围38 cm,身高53 cm,无出生缺氧窒息史。新生儿期嗜睡多,喂养可,生后42 d 龄于健康体检时发现肌张力低下,并给予康复治疗,高压氧及神经节苷脂治疗。目前患儿存在精神运动发育落后,认知差,反应慢,易惊吓,流涎多;面部畸形特征:长脸,眼距宽,内眦赘皮,扁平鼻梁,高发际线;语言障碍,只会说两个字词语。患儿发育较正常者延迟,出生后追物追听差,4 月龄逗笑,5 月龄才开始追物追听、抬头,7 月龄偶会发“爸爸”音,9 月龄独坐,10 月龄翻身,1 岁9 月龄会爬及扶站,2 岁5 月龄会走路。患儿无既往病史,无家族阳性史。入院体格检查:神清,精神可,大头(头围51 cm),双眼位异常,眼窝深,对光反射正常,下肢肌力Ⅳ级,四肢肌张力低,反射减弱,病理征阴性。头颅MRI 及脑电图未见异常,血尿串联质谱检测正常。Gesell 发育诊断量表提示发育商为38.58,适应行为(适应性、大动作、精细动作、语言、个人-社交) 综合评估结果为重度缺陷。
2 遗传学检测 全外显子组的家系检测结果提示患儿PURA 基因变异,chr5:139494229,exon1,c.463T>C p.Tyr155His (NM_005859.4),错义变异,经Sanger 测序证实为新生变异(图1)。该变异位点在千人数据库、ExAC 等正常对照人群数据库及ClinVar、HGMD 数据库均未见报道,为新发现的变异位点。采用生物信息学软件预测其致病性,Mutation taster 预测结果为Disease causing,PolyPhen-2 提示Probably damaging(1.000),ACMG分级具有可能致病性,致病证据为PS2+PM2 +PP3,诊断为PURA 综合征。

图1 本例患儿的PURA 基因变异位点(chr5:139494229,c.463T>C p.Tyr155His)(NM_005859.4)及其父母的Sanger 测序结果Fig.1 PURA gene mutation site (chr5:139 494 229,c.463T>C p.Tyr155his) (NM_005859.4) and Sanger sequencing results of the parents
讨论
本文以“PURA”“PURA syndrome”“Pur-alpha”为检索词检索PubMed (https://pubmed.ncbi.nlm.nih.gov)、人类基因组变异数据库(HGMD,http://www.hgmd.cf.ac.uk)、在线人类孟德尔遗传数据库(OMIM,http://omim.org);以“PURA 综合征”为检索词检索中国知网(CNKI)和万方数据库,检索时间为建库至2022 年6 月30 日,筛选报道明确诊断为PURA 综合征患者的文献,收集其临床资料并进行总结,包括临床表型、基因变异位点及影像学检查结果等。最终共检索到了26 篇英文文献[2-27],报道158 例PURA 综合征患者;2 篇中文文献[28-29],报道2 例PURA 综合征患者;总共160 例PURA 综合征患者,男68 例,女92 例;患者年龄范围为生后4 d 至48 岁。所有诊断为PURA综合征的患者均发育落后,包括智力低下、运动落后、语言障碍;131 例存在(81.9%)新生儿期肌张力低下,且肌张力低下可持续至儿童期,甚至成年期;120 例(75%)存在新生儿期喂养困难,严重者需要管饲;78 例(48.8%) 存在新生儿期呼吸障碍,包括呼吸窘迫及呼吸暂停等。101 例(64.4%)患者存在面部畸形特征,可见于眼距过宽、内眦赘皮、杏仁状睑裂、扁平鼻梁、鼻尖宽且呈三角形、人中长、嘴角下垂、小下颌、长脸、高发际线等。87 例(54.4%) 患者有癫痫发作,其中以肌阵挛发作、全面性强直-阵挛发作及局灶性发作等常见。86 例(53.8%)患者头颅MRI 异常,可见于髓鞘形成延迟、脑白质发育不良/体积较少、胼胝体发育不良、轻度脑室增宽等,其中最常见的异常表现是髓鞘形成延迟,发生于62 例(38.8%)患者。其详细临床表型谱见图2。
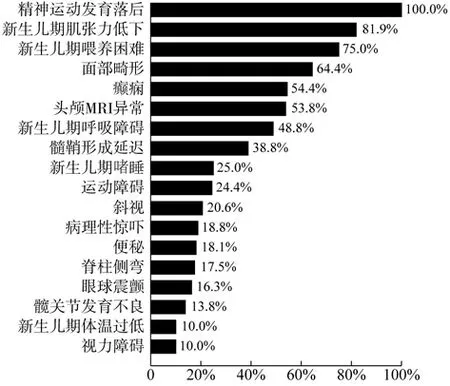
图2 PURA 综合征患者的临床表型谱Fig.2 Clinical profile of patients with PURA syndrome
PURA 基因的变异类型包括错义变异、移码变异、无义变异、框内缺失等。文献复习共报道了117 个不同的氨基酸位点变异,其中,移码变异51 例(43.6%)、错义变异36 例(30.8%)、无义变异19 例(16.2%)、框内缺失9 例(7.7%)、缺失插入2 例(1.7%)。所有变异类型中,移码变异类型最常见。在变异来源明确的相关位点报道中,所有的变异位点均为新生变异,即其父母均为野生型。另外,最常发生的变异位点有c.289A>G p.Lys97Glu、c.697_699del p.Phe233del、c.734G>C p.Arg245Pro、c.812_814del p.Phe271del。
PURA 综合征是PURA 基因变异导致的单基因常染色体显性遗传病,其可导致神经发育障碍,于2014 年首次被报道[27,30]。早期关于小鼠模型的研究提到,PURA 基因敲除小鼠可表现出喂养问题、运动障碍、步态异常及癫痫发作等;组织学分析显示脑区及其他器官的细胞增殖减少,神经元和树突的数量减少,这证实了PURA 基因在大脑发育和神经保护功能中的重要作用[31-32]。
PURA 综合征常见的临床表现有新生儿期的肌张力低下、喂养困难、嗜睡、呼吸障碍以及发育落后、癫痫、运动障碍等[3-4]。本文通过文献复习总结国内外不同临床表型的发生频率,最终发现PURA 综合征患者几乎全部存在精神运动发育落后伴语言障碍;在新生儿期最常表现为肌张力低下、喂养困难、呼吸障碍、嗜睡;新生儿期及新生儿期后其他较常见的临床表型包括面部畸形、癫痫、运动障碍(包括刻板动作、共济失调、舞蹈样动作等)、斜视、病理性惊吓反应、便秘。其他可见于PURA 综合征的表现有胎龄大于41周、流涎、吞咽困难、皮肤松弛、非癫痫性的抽动或凝视、内分泌异常(如维生素D 缺乏症等)[3,6],由于一些报道的病例对这些症状的描述不全面,故此处未做系统概述。PURA 综合征患者可存在头颅MRI 异常,包括髓鞘形成延迟、脑白质体积减小、胼胝体发育不良等[3-4],本研究通过文献复习总结出约53.8%患者可存在头颅MRI 异常,其中以髓鞘形成延迟最常见。本例患儿主要表现为胎龄大于41 周、新生儿期的肌张力低下/嗜睡、流涎、精神运动发育落后伴语言障碍、病理性惊吓反应,并存在眼距宽、扁平鼻梁等面部畸形特征,其临床表型符合PURA 综合征。
PURA 综合征多在新生儿期即开始发病,但在临床上,新生儿期存在的肌张力低下、嗜睡、喂养困难等症状容易被忽视。在排除产伤、缺血缺氧性脑病等围生期脑损伤史的情况下,出现上述新生儿期症状时,需进一步检查患者的面部特征,是否存在运动障碍、癫痫等,尽可能完善头颅MRI 检测。若头颅MRI 提示髓鞘形成延迟,临床医师需高度警惕PURA 基因变异可能。另外,一半以上的PURA 综合征患者可发生癫痫,对于癫痫病因不明者,若同时存在明显的精神运动发育落后,面部畸形特征及髓鞘化延迟时亦需考虑PURA 基因变异可能,尤其是对于表现为肌阵挛发作、全面性强直-阵挛发作及局灶性发作形式者,尽早完善基因检测以明确诊断。Johannesen 等[3]报道,非截短变异和截短变异均可出现在具有相似表型的患者中,且其在患有和不患有癫痫患者中的分布无显著差异,本研究总结了117 个不同变异位点,亦未发现明确的基因型-表型相关性。
对于变异类型,我们总结出移码变异(43.6%)最常见。移码变异为截短变异,可导致蛋白功能的丧失。另外我们总结了变异频率较高的4个位点,c.289A>G(p.Lys97Glu)、c.697_699del(p.Phe233del)、c.734G>C(p.Arg245Pro)、c.812_814del(p.Phe271del),明确了其致病性。故对于临床中发现的PURA 基因变异,若存在以上高频变异位点,可判别其致病性,并做出相应的临床诊断。迄今已报道的有遗传数据来源的患者中,其变异位点均为新生变异,故即使无遗传病家族史,亦不能排除基因变异这一病因。关于PURA 的基因检测,主要是通过基因包或全外显子检测,其中基因包检测主要涉及将PURA 基因纳入发育障碍和癫痫性脑病基因组[30]。遗传学检测至关重要,可进一步帮助明确病因,且下一步的遗传咨询有助于减少出生缺陷患儿;故在病因不明确且高度怀疑某种遗传病时,应尽早完善基因检测。
Johannesen 等[3]报道在其队列中,PURA 综合征患者(杂合变异)的死亡主要与严重发育障碍和癫痫有关,而与PURA 变异没有直接关系。关于纯合变异,PURA 纯合缺失小鼠显示出更严重的致死性,在出生后28 d 即无法存活[31]。由于缺乏纵向随访数据,目前尚无有关病死率的系统描述。目前PURA 综合征尚无有效的治疗方案,主要是对症和康复治疗;另外,研究报道PURA 基因变异相关的癫痫大多为药物难治性癫痫[3]。故亟须进一步研究PURA 综合征相关的病理生理机制,探索有效的治疗方案。
综上,PUAR 综合征的临床表型以新生儿期症状常见,多表现为新生儿期肌张力低下、喂养困难、呼吸困难、嗜睡,其他常见表型包括发育落后、面部畸形特征、癫痫及运动障碍等,头颅MRI 异常表现以髓鞘形成延迟为主。对于存在以上相关表型且其病因无法解释者,需警惕PURA基因变异的可能,尽早完善基因检测。
作者贡献王秋红:数据收集和整理,文章撰写;张淇:数据收集和整理;王杨阳:数据整理;卢倩、敦硕:数据收集;邹丽萍:提供文章思路,文章修改。
利益冲突所有作者声明无利益冲突。
数据共享声明本篇论文相关数据可依据合理理由从作者处获取,Email:drwangqiuhong@163.com。

