放化疗联合靶向免疫治疗复发转移性胰腺癌患者的预后分析
吴陈陈,曹必样,张乐天,王 竞
1 解放军医学院,北京 100853;2 解放军总医院第一医学中心放射治疗科,北京 100853
近年来,世界范围内胰腺癌发病率呈明显上升趋势[1]。统计数据显示,2020 年胰腺癌居我国恶性肿瘤发病率第8 位,居恶性肿瘤相关死亡率第6 位,总体5 年生存率约10%,中位生存期仅为4~ 6 个月[2]。对于可切除胰腺癌,约20%患者有机会接受手术,术后仍有高达50%的复发率[3]。免疫检查点CTLA-4、PD-1 和PD-L1 的抑制剂可逆转肿瘤微环境的免疫抑制效应,促进抗肿瘤免疫,放疗可以增加肿瘤抗原释放,调节肿瘤间质,促进免疫原性效应,为放疗联合免疫治疗提供了理论基础[4]。胰腺癌具有广泛的致癌突变,包括KRAS、TP53、CDKN2A、SMAD4 等基因突变,部分患者可以受益于基于肿瘤生物标志物特定靶点的靶向治疗[5]。目前缺乏对复发转移性胰腺癌患者进行放化疗联合免疫治疗和靶向治疗的大规模临床试验。本研究运用单中心临床数据分析接受综合治疗的胰腺癌根治术后复发转移患者的临床疗效和耐受性,并探讨预后影响因素和治疗失败模式,以期为临床治疗决策提供参考。
对象与方法
1 研究对象 选取2011 年1 月 -2021 年9 月解放军总医院第一医学中心收治的胰腺癌患者。纳入标准:(1) 年龄≥18 岁;(2) 接受胰腺癌根治性切除;(3) 病理诊断为胰腺导管腺癌(pancreatic ductal adenocarcinoma,PDAC);(4)术后出现复发转移;(5)接受放疗、化疗联合靶向和(或)免疫治疗。排除标准:(1)胰腺神经内分泌肿瘤;(2)合并其他肿瘤;(3)壶腹、胆管或十二指肠癌;(4)放化疗禁忌证;(5)病历不全或数据缺失。
2 随访和分析指标 收集患者临床病理特征,包括初次确诊时年龄、性别、肿瘤大小及部位、病理类型、淋巴结状态、术前CA-199 等一般资料,以及复发转移时间、放化疗顺序、放疗剂量、生物学等效剂量、化疗方案、化疗周期数和靶向免疫治疗方案等。门诊和电话随访患者的生存情况。分析指标包括中位总生存期(median overall survival,mOS)、中位无病生存期(median diseasefree survival,mDFS)以及1 年、2 年、3 年、5 年生存率。根治术后总生存期定义为胰腺癌患者接受根治性切除至死亡或末次随访时间;无病生存期定义为患者从胰腺癌根治术后至肿瘤出现复发转移时间;术后复发转移患者总生存期定义为复发转移确诊后治疗至死亡或末次随访的时间。
3 统计学方法 采用SPSS 25.0 软件进行统计分析。计数资料以例数(百分比)表示,计量资料以Md表示。采用Kaplan-Meier 法绘制生存曲线,log-rank 检验行生存资料比较。建立Cox 比例风险回归模型,对影响预后的因素进行单因素和多因素分析,并计算HR和95%CI。所有统计检验均为双尾检验,P<0.05 为差异有统计学意义。
结果
1 研究对象一般资料 纳入41 例胰腺癌根治术后复发转移接受放化疗联合靶向免疫治疗患者,其中男性33 例,女性8 例;中位年龄56(范围:40~76)岁。根据美国癌症联合委员会(AJCC)癌症分期手册第8 版进行术前TNM 分期,Ⅰ~ Ⅱ期25 例,Ⅲ期16 例;对根治术后复发转移患者进行TNM 再分期,Ⅲ期19 例,Ⅳ期22 例。发生肝转移13 例,未发生肝转移28 例;根据治疗模式分组,其中放化疗联合靶向治疗17 例,联合免疫治疗10 例,联合靶向及免疫治疗14 例。见表1。

表1 胰腺癌根治术后复发转移患者临床资料及与总生存的关系(n=41)Tab.1 Clinical data about patients with recurrent and metastatic pancreatic cancer after radical surgery and their relationship with overall survival (n=41)
2 综合治疗方案及其安全性 术后复发转移性患者均采用了化疗、放疗、靶向和免疫治疗相结合的综合治疗手段。
(1)化疗方案:参考NCCN 胰腺癌治疗指南化疗原则[6]。41 例胰腺癌根治术后出现复发转移患者采用的化疗方案:Nab-紫杉醇+S-1 (AS)方案占44%(18/41),Nab-紫杉醇+吉西他滨(AG)方案占29%(12/41),吉西他滨+S-1 (GS) 占26.8%(11/41),5-氟尿嘧啶、亚叶酸钙、伊立替康、奥沙利铂(FOLFIRINOX)/5-氟尿嘧啶、奥沙利铂、亚叶酸钙(FOLFOX) 占28%(11/41),单用S-1 方案39.0%(16/41),单用吉西他滨方案32%(13/41)。接受靶向治疗或免疫治疗的患者分别占42%(17/41)和24%(10/41),同时接受靶向及免疫治疗的患者占34%(14/41)。靶向治疗包括厄洛替尼、尼妥珠单抗和安罗替尼等,免疫治疗包括针对PD-1 和PD-L1 的免疫监测点抑制剂。
(2)局部放疗:所有患者均接受针对复发/转移灶的局部放疗。放疗主要采取图像引导的调强放疗(image guided-intensity modulated radiation therapy,IG-IMRT)和实时追踪的立体定向放射消融治疗(stereotactic ablation radiotherapy,SABR)。采用IG-IMRT 技术治疗复发转移灶处方剂量为50~ 70 Gy/17~ 30 f,相应的生物学等效剂量(biologically equivalent dose,BED10) 为60~ 89.6 Gy。采用SABR 的处方剂量为42.5~ 55 Gy/4~ 6 f,相应的BED10为78.6~ 115.5 Gy。
(3)不良反应:均通过对症处理后改善,没有观察到治疗相关死亡。根据不良事件常用术语标准(Common Terminology Criteria for Adverse Events,CTCAE) 4.0 版对患者进行评分,3/4 级不良反应事件发生率为46.3%,包括骨髓抑制(31.7%)、梗阻性黄疸(14.6%)、腹水(7.3%)、脱发(4.9%)、肝功能障碍(2.4%)和黏膜炎(2.4%)。
3 生存分析 中位随访时间75 (范围:31.5~118.5)个月,41 例中33 例死亡。根治术后患者的mOS 为26.3 (95%CI:17.5~ 35.1)个 月,术后mDFS 为9.79 (95%CI:8.10~ 11.5)个月,复发转移后mOS 为17.1 (95%CI:9.41~ 24.8)个月。根治术后患者1 年、2 年、3 年、5 年的OS 率为90.2%、63.4%、36.6%、19.5%,术后1 年、2 年、3 年、5 年的DFS 率为75.6%、19.5%、2.4%、2.4%,复发转移后1 年、2 年、3 年、5 年的OS率分别为65.8%、44.0%、26.8%、4.8%。依据生存数据绘制的Kaplan-Meier 生存曲线见图1。
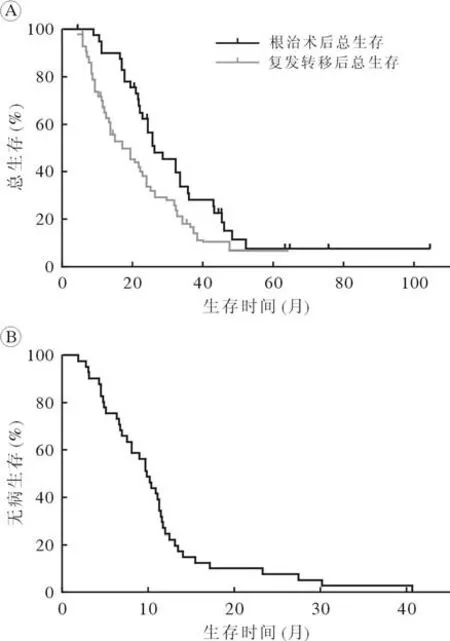
图1 41 例胰腺癌根治术后复发转移接受放化疗及靶向免疫治疗患者的总生存(A)和无病生存(B)情况Fig.1 Overall survival (A) and disease free survival (B) in 41 patients treated with radiotherapy and chemotherapy combined with targeted and immunotherapy for recurrent metastases after radical pancreatic cancer surgery
4 预后因素分析建立Cox 比例风险回归模型,以本研究资料为样本,以胰腺癌根治术后患者总生存为因变量,赋值:死亡=1,生存=0。自变量及回归结果见表2,表3。
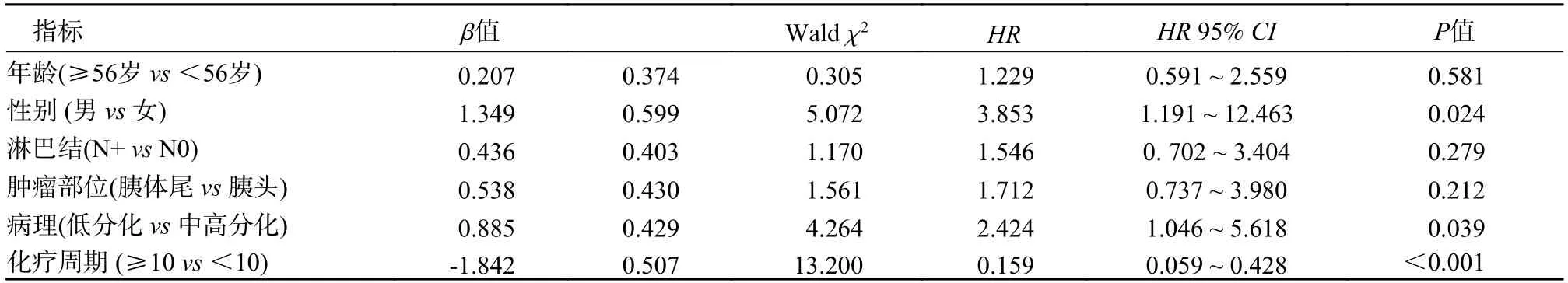
表2 胰腺癌根治术后总生存的预后关联因素Tab.2 Factors associated with overall survival after radical surgery for pancreatic cancer
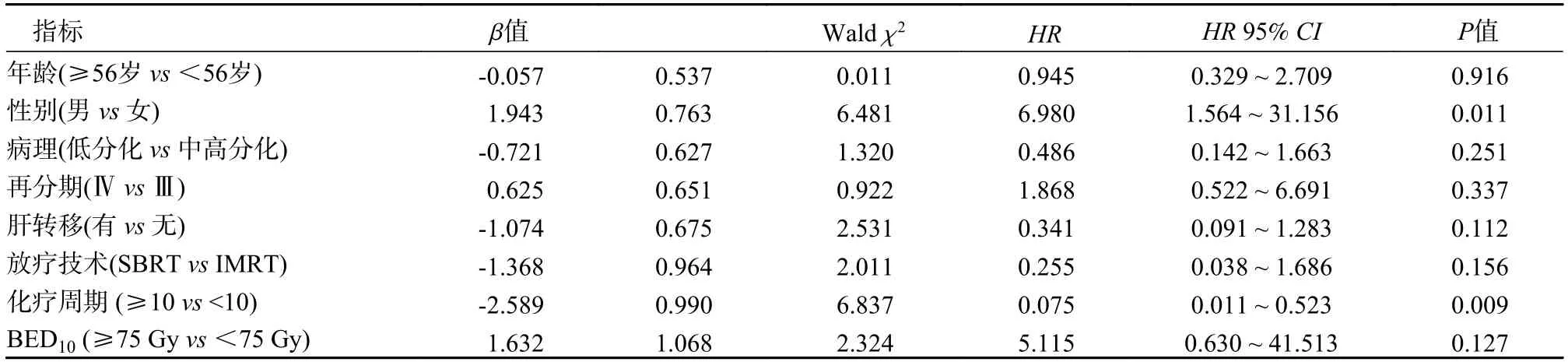
表3 复发转移后总生存的预后关联因素Tab.3 Factors associated with overall survival after recurrence or metastasis
(1)单因素分析:根治术后以及复发转移后的化疗总周期数≥10 提示有较好的OS (P=0.005、0.029)。在有无肝转移、序贯模式和BED10等方面,两组患者生存率的差异无统计学意义。见表1。
(2)多因素分析:全组患者预后多因素分析表明,性别(男vs女)、病理类型(低分化vs中高分化) 和化疗周期数(≥10vs<10) 与胰腺癌根治手术患者OS 独立关联(P=0.024、0.039、<0.001);性别(男vs女)、复发转移后化疗周期数(≥10vs<10)与术后复发转移总生存独立关联(P=0.011、0.009)。
5 治疗失败模式及结果 胰腺癌根治术后失败模式为复发转移,大多数患者(31/41,75.6%) 在术后1 年内进展,92.7(38/41) 治疗后2 年内进展。13 例(31.7%) 发生肝转移,13 例发生腹膜转移,其他常见转移部位分别为肺(3 例)、肾(1 例)和骨(1 例),19 例局部复发。见图2。
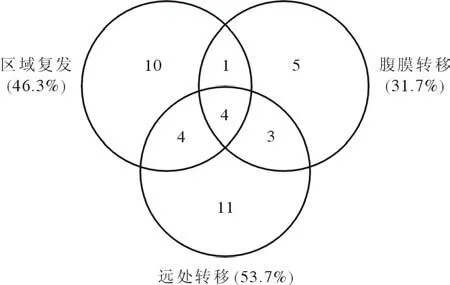
图2 治疗失败模式及结果Fig.2 Patterns of failure
讨论
本研究是一项评估化疗、放疗联合靶向和(或)免疫治疗在胰腺癌根治术后复发转移患者中预后因素的回顾性研究。胰腺癌根治术后患者mOS为26.3 (95%CI:17.5~ 35.1)个月,1年、2年、3年、5 年OS 率为90.2%、63.4%、36.6%、19.5%;根治术后mDFS 为9.79 (95%CI:8.10~ 11.5)个月,1 年、2 年、3 年、5 年的DFS 率为75.6%、19.5%、2.4%、2.4%;复发转移后mOS 为17.1 (95%CI:9.41~ 24.8)个月,1 年、2 年、3 年、5 年的OS 率分别为65.8%、44.0%、26.8%、4.8%。
对于可切除胰腺癌患者,目前仍以手术治疗为主[7]。根据AJCC 第8 版对可手术胰腺癌患者进行分期分层,ⅡA 期和ⅡB 期患者mOS 分别为32 个月和19 个月,与本研究中Ⅰ~ Ⅱ期患者24.5 个月的mOS 相近[8]。研究表明,采用少分次同步剂量递增的螺旋断层放疗对于局部晚期和转移性胰腺癌患者是一种耐受性良好的治疗模式[9]。Weibel 等[10]的研究中,术后应用放化疗或化疗的mOS 为25.5~ 28.0 个月,与我们研究结果相近。此前NCCN 指南中并未提出针对复发转移胰腺癌的最佳治疗方案,化疗或放化疗可作为推荐疗法。常规化疗包括吉西他滨单药疗法、吉西他滨联合白蛋白紫杉醇、FOLFIRINOX 方案等。一项系统性回顾研究表明,术后局部复发的胰腺癌经放化疗后mOS 为9~ 16 个月,略低于我们研究中报道的17.1 个月。Cuneo 等[11]纳入34 例局部晚期胰腺癌患者,采用吉西他滨+Wee1 激酶抑制剂AZD1775 联合放疗的方案,mOS 为21.7 (90%CI:16.7~ 24.8)个月,mPFS 为9.4 (90%CI:8.0~ 9.9)个月,生存获益优于既往以吉西他滨为主的化疗方案,但与我们的研究相比,该研究纳入的胰腺癌患者均为Ⅲ期,我们的研究Ⅲ期患者19 例,Ⅳ期患者22 例,Ⅲ期与Ⅳ期患者比例为1∶1.16。
2017年5 月,免疫检查点抑制剂Pembrolizumab 被美国食品和药物管理局(FDA)批准用于存在dMMR/MSI-H 的胰腺癌患者。Key-note 158 研究表明,在有dMMR/MSI-H 的PDAC 患者中应用Pembrolizumab,OS 和PFS 分 别为4.0 (95%CI:2.1~ 9.8)个月和2.1 (95%CI:1.9~ 3.4)个月[12]。2019 年,Chen 等[13]报道了1 例具有错配修复能力和HER-2 阳性的晚期cT4N1M1 胰腺癌患者,应用Pembrolizumab 联合抗血管生成治疗后出现部分缓解,原发灶缩小27.3%,肝转移灶缩小33.0%,肺转移灶缩小13.2%。
Zhu 等[14]研究了SBRT 联合Pembrolizumab 和Trametinib 治疗手术后局部复发胰腺癌患者的疗效,相比SBRT+Gemcitabine 治疗组,mOS 获益2.5 个月(24.9 个月vs22.4 个月,P=0.001),略高于本研究的17.1 个月。可能是因为该Ⅱ期临床研究仅纳入术后复发而未包含术后发生远处转移患者,对分期分层后,我们的Ⅲ期结果为30.9 个月,显示出更长的mOS。而Chen 等[15]的Ⅱ期临床研究中,入组人群因发生远处转移已失去手术机会,一线化疗方案失败且ECOG 评分为0~ 1,使用SBRT 联合免疫治疗,其mOS 仅为3.8 个月。
本研究预后分析表明,性别与化疗周期数≥10 不论是在胰腺癌根治术后还是在复发转移后都是明显影响预后的独立因素,与既往研究结果一致[16],男性与女性相比在两组人群中分别增加2.85(95%CI:1.19~ 12.46)倍和5.98 (95%CI:1.56~31.16)倍死亡风险。低分化病理类型相比于中高分化增加1.42 (95%CI:1.05~ 5.62)倍死亡风险,是一个预后独立危险因素,也与既往报道一致[17]。
综上所述,我们发现化疗、放疗联合免疫和(或)靶向治疗的综合治疗可能是胰腺癌患者根治术后复发转移的一种潜在治疗策略,但因本研究为回顾性、单中心临床研究,样本量较小,需大宗临床研究进一步探讨综合治疗模式在根治术后复发转移性胰腺癌患者中的治疗价值。
作者贡献王竞:总体构思,方法设计,审读,修订;吴陈陈:规范分析,调查研究,撰写初稿;曹必样、张乐天:数据的收集、处理,随访。
利益冲突所有作者声明无利益冲突。
数据共享声明本篇论文相关数据可依据合理理由从作者处获取,Email:wuchenchen301@hotmail.com。

