纳米石墨烯医用导电膏的制备及生物相容性评价
张艺耀,赵永岐,邹志康,石 进,于东睿,王雪峰,陈大伟,杨 芬
1 空军特色医学中心神经内科,北京 100042;2 军事科学院军事医学研究院,北京 100039;3 空军军医大学,陕西西安 710038;4 解放军空军招飞局,北京 100195
神经电信号、心电信号和肌电信号均以电的形式传递,从电子学角度来看,是一种形似脉冲的信号,具有幅值低、持续时间短、易干扰等特点[1-4]。目前,临床上主要应用有心电图、肌电图和脑电图等。在采集过程中,体表皮肤易受到环境温度、湿度、压力、摩擦等变化刺激的干扰[5-7],因此必须在表面皮肤和采集导联电极之间建立稳定的信号采集通道。医用导电膏作为该信号采集通道的重要媒介,可以广泛、稳定、持续性接触皮肤并与导联电极之间建立连接,从而实现信号的持续采集。目前,临床上应用的医用导电膏主要采用的原材料为无机盐、高分子黏稠剂和导电有机高分子材料等,其中高盐成分对皮肤具有一定的刺激性,使用时局部皮肤易出现脱水现象,导致采集信号不稳定[8-11]。此外,还存在部分患者感觉不适、皮肤瘙痒、皮肤局部清洁较为困难或导联电极连接易于脱落等现象。随着纳米材料的成熟和应用,纳米导电材料在临床上的应用逐渐成为材料与医疗领域应用的研究热点,纳米材料比表面积大、电信号传递稳定、易于构建网状采集单元的特点可弥补目前医疗材料众多缺陷。医用导电膏应具备测量信号传导稳定、抗干扰性强、阻抗低、生物兼容性良好和使用方便的优点[12]。结合纳米材料特性的医用导电膏理论上在神经电信号、心电信号和肌电信号的采集和传递中具备优势。本研究探讨制备纳米石墨烯医用导电膏的方法,同时表征其物理、电生理特性并评价其生物相容性,为临床患者的电信号采集提供一种全新、安全的纳米材料的导电膏。
材料与方法
1 试剂仪器 纳米石墨烯(Cas.No.1034343-98-0,上海阿拉丁生化科技股份有限公司);磷酸铝凝胶(国药准19991100,华裕(无锡) 制药有限公司),海藻酸钠(Cas.No.005-38-3,上海阿拉丁生化科技股份有限公司),吐温20(Cas.No.9005-64-5,上海阿拉丁生化科技股份有限公司),药用甘油(Cas.No.56-81-5,上海阿拉丁生化科技股份有限公司),对羟基苯甲酸丙酯(Cas.No.94-13-3,上海阿拉丁生化科技股份有限公司),羧甲基纤维素Ⅰ(Cas.No.9004-32-4,上海阿拉丁生化科技股份有限公司),磷酸盐缓冲液[Cat.No.P3912367,世瑞纳科(天津) 医疗科技有限责任公司],胎牛血清(Cat.No.10099-141C,Gibco),1640 培养基(Cat.No.10564-011,Gibco),青链霉素双抗(Cat.No.15 070063,Gibco),细胞培养胰酶(Cat.No.12604021,Gibco),IL-6 单克隆抗体(Cat.No.MAB206,R&D),IL-6 多克隆抗体(Cat.No.AF506,R&D),TNF-α 单克隆抗体(Cat.No.MAB610,R&D),TNF-α 单克隆抗体(Cat.No.AF-510,R&D),传统医用导电膏(Ten20® Conductive Paste,Weaver and Company),CCK-8 检测试剂盒(Cat.No.PA137627,Gibco),βactin 单克隆抗体(Cat.No.MAB8929,R&D)。
超声均质分散机(UX-600,日本三井电器),均质分散机(FJ200,上海沪析),研磨搅拌机(LBD-0.2,上海翎羽机电科技有限公司),数字低值直流电阻测试仪(ETCR3640,铱泰),电导率测试仪(SMP350,Fischer),微量粘度计(Lovis 2000 M,安东帕),CO2细胞培养箱(180 L,Thermo fisher),酶标仪(270,Thermo fisher)。
2 细胞及实验动物 HaCaT 人表皮细胞购自国家细胞资源中心。SD 大鼠购自北京维通利华实验动物技术有限公司(7 周龄,雌雄各15 只,SPF级别)。
3 纳米石墨烯医用导电膏制备 采用1 000 g 磷酸缓冲溶液(pH 6.5~ 7.5),加入0.01 g 纳米石墨烯,超声均质分散机进行分散混匀(能量为400~500 J,持续时间25 s,间隔20 s,操作时长20~30 min),制备成纳米材料的均质混悬液;混悬液中加入50 g 丙二醇、10 g 吐温20 和5 g 对羟基苯甲酸甲酯,用均质分散机进行分散(5 000 r/min,30 min),形成稳定相油水混合液;油水混合液中加入60 g 磷酸铝凝胶和100 g 海藻酸钠,采用研磨搅拌机进行搅拌混匀(1 000 r/mim,4 h),使磷酸铝凝胶、海藻酸钠与油水混合液研磨充分混匀,制备膏状物,导电膏(150 g/瓶),在2~ 8℃条件下冷却2~ 3 h 定型。
4 电阻检测 将纳米石墨烯医用导电膏和传统医用导电膏,分别制备成2.0 cm × 0.20 cm × 2.0 cm的薄膜,在温度25℃,湿度40%条件下,采用数字低值直流电阻测试仪伏安法检测两组导电膏的电阻值,测量5 次,计算电阻均值和标准差。
5 电导率检测 纳米石墨烯医用导电膏和传统医用导电膏,分别取2 g 溶于去离子水中,采用均值分散机分散(5 000 r/min,10 min),在温度25℃,湿度40%条件下,采用电导率测试仪检测两组分散液的电导率值,测量5 次,计算电导率均值和标准差。
6 黏附性检测 纳米石墨烯医用导电膏和传统医用导电膏,在温度25℃,湿度40%条件下,采用微量粘度计,按照设备使用操作说明分别检测两组导电膏的黏附性,测量5 次,计算黏附性均值和标准差。
7 信号稳定性检测 采用纳米石墨烯医用导电膏和传统医用导电膏分别制备直径1.0 cm,厚度0.3 cm 的圆形薄膜,在温度25℃,湿度40%条件下,采用10 mV 电压刺激薄膜不同部位6 个位点(图1),在薄膜的中心位点,采用数字低值直流电阻测试仪检测其电压信号,观察电压信号数值的变化。
8 表皮细胞培养 3.0 × 105HaCaT 人表皮细胞培养于25 cm2培养瓶中,采用1640 培养基(Cat.No.10564-011,Gibco)中加入10%的胎牛血清(Cat.No.10099-141C,Gibco)和1%青链霉素双抗(Cat.No.15070063,Gibco)。培养条件:37℃、5% CO2细胞培养箱。设空白对照组、纳米石墨烯医用导电膏组(培养基中加入0.02% g/L 纳米石墨烯医用导电膏)和传统医用导电膏组(培养基中加入0.02% g/L传统医用导电膏)。
1.1 研究对象 采用目的抽样及最大差异法选取6所院校的10名护理学全日制在读博士研究生,其培养方式均为非定向式全日制培养,无工作经历或入学前已与原单位解除劳动合同关系,毕业时面临就业问题,且自愿参与本研究。访谈对象以A~J编号。选取的样本特征能提供最大信息量或最有价值信息,代表性良好,访谈对象数量遵循信息饱和原则[7]。受访者年龄24~35岁,平均(27.40±3.47)岁,见表1。
9 CCK-8 实验检测细胞增殖 5.0 × 103HaCaT 人表皮细胞200 μL 接种于96 孔板,各组分别重复5 个复孔;在24 h、48 h、72 h、96 h 和120 h 加入CCK-8 溶液20 μL 孵育4 h,在酶标仪上450 nm波长检测其OD 数值,计算其均值和标准差,绘制其生长曲线。
10 Western blot 检测炎症因子表达水平 各组细胞均处理48 h 后,收集细胞,经磷酸盐缓冲液3 次清洗后,采用RIPA 细胞裂解液在0℃对细胞进行裂解10 min,采用低温离心机以16 000 g离心15 min,取上清液加入Loading buffer 和蛋白酶抑制剂Cocktail,95℃蛋白变性5 min,采用10%聚丙烯酰胺胶对蛋白进行分离电泳。电泳条件:电压100 V,时间90 min;采用0.22 μm 的PVDF 膜进行转膜,湿法转膜条件:温度2~8℃,电压100 V,时间12 h,IL-6 和TNF-α 抗体2~ 8℃孵育过夜,二抗室温条件孵育2 h,采用ECL 发光试剂盒进行显影。
11 导电膏动物实验30 只SD大鼠随机分为3 组,SD 大鼠脊背部剔除皮肤毛发后,空白对照组不做处理;纳米石墨烯医用导电膏组涂抹直径0.6 cm 的纳米石墨烯医用导电膏,厚度约0.20 cm;传统医用导电膏组涂抹直径0.6 cm 的导电膏,厚度约0.20 cm。实验时间共10 d,观察各组动物皮肤的变化,如颜色、脱水情况、导电膏脱落情况。实验10 d 后处死大鼠,取皮肤表皮组织定理分析后进行炎症因子的蛋白表达分析。
12 统计学方法采用SPSS 16.0进行统计分析,数据以表示,两组间比较采用t检验分析;多组间比较采用单因素方差分析(两两比较采用LSD-t);P<0.05 为差异有统计学意义。
结果
1 电学和物理性能指标 纳米石墨烯医用导电膏表现出优异的低阻抗性、导电性和信号稳定性,它和传统医用导电膏的电阻数值分别为(1.22 ±0.13) Ω 和(4.53 ± 0.51) Ω,电导率数值分别为(5.53 ± 0.027) μs/cm 和(1.48 ± 0.124) μs/cm,电压数值分别为(9.73 ± 0.027) mV 和(8.32 ± 0.12) mV,差异均有统计学意义(P<0.05)。它和传统医用导电膏的黏附性数值分别为(13 300 ± 430) mPa·s 和(12 230 ± 324) mPa·s,差异无统计学意义(P>0.05)。见表1。
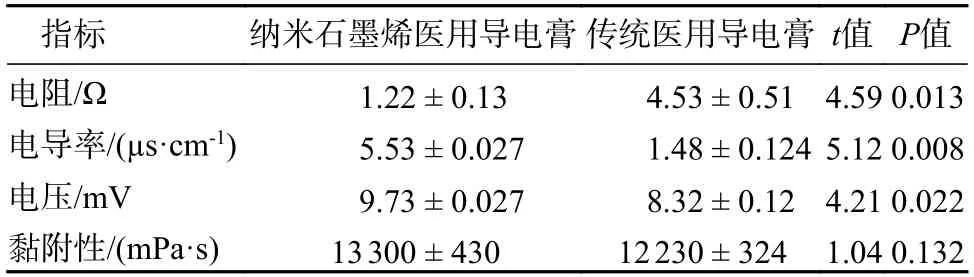
表1 纳米石墨烯医用导电膏和传统医用导电膏的电学和物理指标比较Tab.1 Comparison of electrical and physical properties between nano graphene medical conductive paste and commercially available conductive paste
2 表皮细胞生长曲线比较 CCK-8 实验显示,在24 h、48 h、72 h、96 h 和120 h 各时间点,纳米石墨烯医用导电膏组与空白对照组细胞增殖的OD 数值无统计学差异(P>0.05),由此可见纳米石墨烯医用导电膏对细胞增殖无影响;而在96 h和120 h,传统医用导电膏组细胞增殖低于空白对照组(P<0.01),提示传统医用导电膏具有抑制细胞增殖的作用。见图2。

图2 表皮细胞增殖曲线比较(aP<0.01,vs 纳米石墨烯医用导电膏组和空白对照组)Fig.2 Comparison of epidermal cell proliferation between the three groups (aP<0.01,vs nano graphene medical conductive paste group and control group)

图3 表皮细胞的Western blot 蛋白分析Fig.3 Western blot protein analysis results of human epidermal cells
4 大鼠皮肤及表皮组织的炎性表达比较 纳米石墨烯医用导电膏组的皮肤颜色无变化、无脱水现象发生、无脱落现象;传统医用导电膏组的皮肤颜色微红、无脱水现象发生、无脱落现象;空白对照组皮肤无变化。动物表皮组织Western blot 检测结果显示,纳米石墨烯医用导电膏组、传统医用导电膏组和空白对照,各组间IL-6 表达无统计学差异(P>0.05)。而传统医用导电膏组的TNF-α蛋白表达升高(P<0.05),由此说明传统医用导电膏可引起炎性反应。见图4。
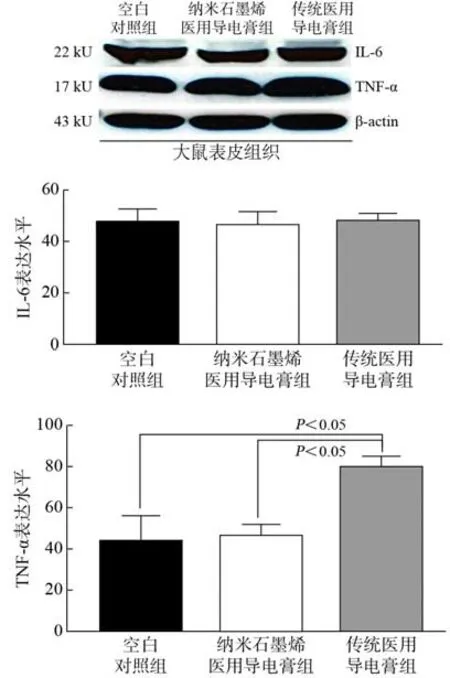
图4 大鼠表皮组织的Western blot 蛋白分析结果Fig.4 Western blot protein analysis results of rat epidermis
讨论
医用导电膏是临床上心电信号、脑电信号和肌电信号采集的重要媒介和必备品。目前,传统医用导电膏采用的原料普遍为高含量无机盐、高分子黏稠剂和导电有机高分子材料,生物相容性不佳,对患者的皮肤具有一定的刺激性,使用时局部皮肤易出现脱水现象,导致信号不稳定[6,13-14]。此外,还存在部分患者使用感觉不适或出现皮肤瘙痒现象。同时,皮肤局部清洁较为困难或易出现导联电极连接脱落等缺点[15]。
纳米石墨烯材料在医用导电膏方面的应用研究属于领域的空白。本研究成功制备了新型纳米石墨烯医用导电膏(属于原创性研发,并获得国家发明专利授权(专利号:202211009455.0);由生理浓度磷酸盐缓冲液、二维纳米石墨烯材料、表面活性剂材料、保湿剂、黏稠剂和消毒组分组成。主要组分原理分析:(1)缓冲溶液为生理浓度磷酸盐溶液,符合表皮组织的生理渗透压要求不容易造成皮肤的高渗脱水;(2)导电材料为纳米石墨烯材料,具有比表面积大、导电性良好、电阻率低的特点,在膏状物体中易于形成网状交通结构,进而加速信号的转导[13]等特性;(3)表面活性剂采用与皮肤高亲和力的吐温20 材料,该材料易于与皮肤之间建立良好的信号通道的作用[16];(4)保湿剂为丙二醇,丙二醇在该导电膏中具有保湿功效,避免局部皮肤水分的脱失;(5)黏稠剂为海藻酸钠和水性磷酸铝凝胶,使得该医用导电膏的特性具备高黏附特性和水性基材易清除的特点[17]。
该纳米石墨烯医用导电膏的电学特性实验结果显示,与传统医用导电膏对比,纳米石墨烯导电膏的电阻值低、电导率高。由此可以判定该纳米石墨烯导电膏满足阻抗低的要求[18]。信号稳定性检测结果显示,纳米石墨烯医用导电膏的电信号稳定性远超传统医用导电膏,其中传统医用导电膏组的电压信号存在衰减,因此判定该纳米石墨烯医用导电膏的电信号传导稳定。纳米石墨烯医用导电膏由于测量信号传导稳定、抗干扰性强和阻抗低的特性具有良好的临床应用前景。黏附性实验测试和动物实验结果显示,纳米石墨烯医用导电膏与传统医用导电膏的黏附性无显著差异。
生物相容性方面,表皮细胞CCK-8 细胞增殖实验显示,在120 h 内纳米石墨烯医用导电膏组与空白对照组的细胞增殖无显著差异,由此证明该纳米石墨烯医用导电膏不具有细胞毒性;而传统医用导电膏组在96 h 后细胞增殖受到影响,具有细胞毒性;表皮细胞和大鼠表皮组织的Western blot 分析显示,与空白对照组比较,纳米石墨烯医用导电膏组的IL-6 和TNF-α 炎性指标未见升高,而传统医用导电膏组引起细胞IL-6 表达升高和动物表皮组织中TNF-α 表达升高[19]。由此可见在传统医用导电膏组引起了炎性表达。动物的皮肤发红现象再次印证了炎性指标表达升高的结果,而纳米石墨烯医用导电膏并未引起局部皮肤或细胞的炎性反应。传统医用导电膏细胞与组织炎性因子的不一致,需要后续实验研究进一步探讨其机制,但并不影响本实验判断其炎性反应发生结果;动物实验结果显示,传统导电膏组大鼠皮肤出现轻微皮肤发红现象,而纳米石墨烯医用导电膏组未出现此现象,证明纳米石墨烯医用导电膏黏附性和使用性良好。
综上所述,纳米石墨烯医用导电膏制备方法简单,测量信号传导稳定,抗干扰性强,阻抗低,生物兼容性好,能够满足临床使用的要求,具有良好的临床应用前景。
作者贡献张艺耀:论文选题,数据收集,统计学分析,论文撰写,论文修改;赵永岐:论文选题,论文修改;邹志康:论文指导,论文修改;石进:论文选题,论文修改;于东睿:数据收集,统计学分析;王雪峰:数据收集,统计学分析;陈大伟:论文修改;杨芬:论文选题,论文指导,论文修改。
利益冲突所有作者声明无利益冲突。
数据共享声明本篇论文相关数据可依据合理理由从作者处获取,Email:705534469@qq.com。

