羟肟类萃取剂高效选择性分离高酸多杂钒页岩酸浸液研究
何 野, 张一敏, 黄 晶, 郑秋实
(1.武汉科技大学 资源与环境工程学院, 湖北 武汉 430081;2.国家环境保护矿冶资源利用与污染控制重点实验室, 湖北 武汉 430081;3.战略钒资源利用省部共建协同创新中心, 湖北 武汉 430081;4.湖北省页岩钒资源高效清洁利用工程技术研究中心, 湖北 武汉 430081)
从钒页岩中提取钒是国内钒资源开发利用的重要途径之一。在含钒页岩浸出过程中,不管是采用常规的高温高酸体系[1],还是外场强化体系[2-3],在破坏钒的晶格的同时[4],铁、铝、镁等杂质会同步溶出到浸出液中,导致酸浸液具有酸度高和杂质多的特点[5],给后续净化富集工序造成一定的压力。目前,溶剂萃取因其回收率高、工艺容量大等优点在工业上得到广泛应用[6-7],但P204萃取体系仍存在浸出液初始pH值需要调整、钒杂分离效果差、还原和中和过程中碱消耗量大、管道易结垢等问题[8]。因此,需开发一种pH值适应性更强、选择性更高的绿色高效萃取体系。近年来,羟肟类萃取剂由于选择性高被应用于铜和少量稀有金属的提取工艺[9-10],其中包括钒的萃取[11-12]。Mextral系列萃取剂是国内研发的羟肟类萃取剂,其中Mextral 984H具有醛肟和酮肟2种官能团,萃取能力强[13]。
本文考察了溶液pH值和杂质离子(Fe3+、Fe2+、Al3+和Mg2+)浓度对新型羟肟类萃取剂 Mextral 984H和有机磷类萃取剂P204萃钒效果的影响,对比了2种萃取剂的钒杂分离效果,并结合量子化学软件Gaussian[14],计算钒萃合物结构的静电势、化学键长值和分子能隙,从微观层面揭示了钒的高效萃取机制。
1 试验原料与方法
1.1 原料、试剂和设备
1)原料。试验原料为含V4+、Fe3+、Fe2+、Al3+和Mg2+的复配溶液及含V5+、Fe3+、Fe2+、Al3+和Mg2+的复配溶液。以上溶液是将一定量的钒化合物(VOSO4、V2O5)与硫酸盐溶解在稀硫酸溶液中制备而成。
2)主要试剂。Mextral 984H,化学纯,来自重庆康普公司;P204、TBP均为化学纯,来自上海国药集团化学试剂有限公司;磺化煤油,实验室自制;VOSO4、V2O5、Fe2(SO4)3、FeSO4·7H2O、Al2(SO4)3·18H2O、MgSO4·7H2O、NaOH和H2SO4等试剂,均为分析纯,来自国药集团化学试剂有限公司;试验用水为去离子水。
3)主要设备。79-1型磁力搅拌器来自于武汉科尔公司;pHS-3C数字式pH来自于上海仪电科学仪器有限公司;AB204-N分析天平来自于梅特勒-托利多仪仪器有限公司;HX1201T电子天平来自于慈溪市天东衡器厂;Gausian 16和Gaussian 16w来自于上海绎模信息科技有限公司。
1.2 试验方法及原理
试验用2种有机相分别为20% Mextral 984H+80% 磺化煤油(体积分数)、20% P204+5% TBP+75%磺化煤油(体积分数)。由于前期研究表明Mextral 984H的分相情况良好,且加入相调节剂后,反而萃取率会下降,故Mextral 984H有机相不添加TBP。
配制复配溶液;配制10 mol/L H2SO4和10 mol/L NaOH,用于调节复配溶液的初始pH值;将调pH值预处理后的萃原液与有机相按一定相比混匀,充分搅拌一定时间后,于分液漏斗中静置,分相。
这2种萃取剂均含有质子H,可与钒发生阳离子取代反应,同时螯合萃取还受其他配体影响,反应可逆度较低。反应方程式见式(1)~(2)。
(1)

(2)
式中:HA为Mextral 984H;HB为P204。
1.3 分析方法
通过萃取前、后金属离子浓度的变化和反萃前、后金属离子浓度的变化,分别计算金属离子的萃取率和反萃率。溶液中离子浓度由ICP-AES测定。
试验中所计算的萃合物结构采用B3LYP/6-31+G(d, p)的基组方法,进行几何优化和频率计算,计算的结构均没有虚频,处于极小值点,确保计算的可靠性。并采用Gaussian 16w绘制分子表面静电势,计算能量最低未占轨道(LUMO)和能量最高占据轨道(HOMO)。在本文中,分子能隙定义为E(LUMO)减去E(HOMO)的差值[15],见式(3)。
Egap=ELUMO-EHOMO
(3)
式中:Egap为分子能隙,eV;ELUMO为LUMO轨道能量,eV;EHOMO为HOMO轨道能量,eV。
2 结果与讨论
2.1 初始pH值对钒萃取率的影响
实际酸浸液的pH值一般在0.5左右,且含有不同浓度的四价钒和五价钒,一般进行萃取工艺前,需要对酸浸液进行氧化或还原预处理,以便更好适配萃取剂。在温度30 ℃、相比O∶A=1∶2、搅拌时间10 min的条件下,以Mextral 984H和P204为萃取剂,考察了溶液初始pH值对萃取V4+(初始质量浓度为2 g/L)和V5+(初始质量浓度为2 g/L)的影响,试验结果如图1所示。

图1 pH值对钒萃取率的影响
由图1可知,在pH值为0~1.5时,Mextral 984H对V5+的萃取率均大于80%,当pH值大于1.5后,萃取率明显下降;而对V4+的萃取率一直小于1%,表明Mextral 984H对V4+和V5+的选择分离性好。P204对钒的萃取能力为V4+>V5+,当pH值在0~1.5时,V4+与V5+萃取率相差小,表明P204在pH=0~1.5时对V4+和V5+的选择分离性较差,在pH值为1.5~2.4时,对V4+的萃取率大于80%,而在pH值为1.5时,V5+萃取率达到最大值,为69.33%,随后明显下降,V4+与V5+萃取率相差变大,表明P204在pH=1.5~2.4时对V4+和V5+的选择分离性好。因此,Mextral 984H更适用于V5+的净化富集,且酸浸液不需调节pH值(酸浸液pH值一般为0.5左右),而P204更适用于V4+的净化富集,需对酸浸液进行碱中和处理,调节酸浸液pH值在1.5~2.4。
Mextral 984H的主要成分为醛肟和酮肟,P204易形成二聚体,为了便于比较,故以萃取剂单体分子和钒的萃合物结构为单元计算静电势[16-17]。静电势是指对分子附近1个质子(或其他单位正电荷)的势能,在分子内不同区域有不同的值[18]。负静电势对应高电子密度和吸引质子的能力,相反,正静电势对应低电子密度和排斥质子的能力。通过量子力学软件Gaussian16优化出Mextral 984H和P204与钒形成的萃合物结构的能量最低构象,使用 Gaussian16w绘出表面静电势,并获得V与萃取剂上活性位点O原子的键长值、HOMO、LUMO等信息,通常最正和最负的静电势区域分别呈红色和蓝色,结果见图2和表1。

表1 钒萃合物的微观结构参数

图2 钒萃合物的静电势
从图2(a)和(b)可知,VO2+取代醛肟和酮肟中酚羟基的H原子后,V原子和萃取剂上酚羟基上的O原子、肟基上的N原子之间形成螯合环状化合物,正值最大的静电势出现在钒氧双键上的O原子上,负值最大的静电势出现在H原子上面,而V原子静电势接近于0,不容易接受电子或者失去电子,表明形成的钒萃合物结构稳定,H原子很难再与V原子发生交换,在酸性环境中能稳定存在。从图2(c)可明显看出,VO2+取代羟基上的H原子后,负值最大的静电势出现在钒氧双键上的V原子上,容易接受电子,表明形成的萃合物并不稳定,V原子不仅会与P204单体中的P-OH上的H原子发生交换,也可以与在混合相中游离的H+发生交换,在酸性环境下不容易稳定存在。结合表1可知,Mextral 984H的钒萃合物中的V—O键长值相比于P204的钒萃合物更小,分子间隙更大,而键长值越小,形成的化学键越稳定,分子间隙越大,活性越低,化学性质更稳定,这表明Mextral 984H的钒萃合物结构比P204的钒萃合物结构在稀硫酸溶液中更容易稳定存在。
综上可知,相比于P204,Mextral 984H与钒生成的钒萃合物在酸性条件下存在形式更加稳定,萃取反应受pH值的影响较小。因此,Mextral 984H比P204更适应在低pH值下高效分离钒。
2.2 杂质离子对钒萃取率的影响
不同地区钒页岩含有的元素种类和含量不同,形成的酸浸液的成分也不相同,而主要杂质Fe、Al和Mg的浓度对于钒的净化富集影响甚大,因此有必要考察杂质离子浓度对Mextral 984H和P204萃取钒与其他金属离子的影响。从2.1中可知,2种萃取剂最佳的萃钒价态和溶液pH值不同,在后续试验中,以Mextral 984H为萃取剂萃取的溶液为2 g/L V5+与不同浓度的Fe3+、Fe2+、Al3+和Mg2+的复配溶液(pH=0.5),以P204为萃取剂萃取的溶液为2 g/L V4+与不同浓度的Fe3+、Fe2+、Al3+和Mg2+的的复配溶液(pH=1.8),试验条件为温度30 ℃、相比O∶A=1∶2、搅拌时间8 min,试验结果如图3所示。分别将空白有机相和负载金属离子的有机相进行红外光谱分析,结果如图4所示。

图3 不同金属离子浓度对萃取率的影响
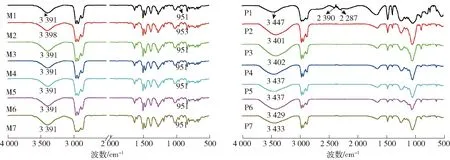
M1—Mextral 984H;M2—Mextral 984H+V(V);M3—Mextral 984H+V(IV); M4—Mextral 984H+Fe(III);M5—Mextral 984H+Fe(II);M6—Mextral 984H+Al(III);M7—Mextral 984H+Mg(II);P1—P204;P2—P204+V(V);P3—P204+V(IV);P4—P204+Fe(III);P5—P204+Fe(II);P6—P204+Al(III);P7—P204+Mg(II)
从图3可知,随着Fe3+、Al3+、Mg2+浓度的增加,Mextral 984H对V5+的萃取率维持90%左右,而对Fe3+、Al3+、Mg2+的萃取率均低于3%,这表明Mextral 984H对V5+和Fe3+、Al3+、Mg2+分离效果好。在V5+和Fe2+的复配溶液,Mextral 984H对V5+和Fe2+的萃取率均低于3%,这是由于复配溶液(在含V5+的溶液中加入Fe2+后,溶液由橙黄色变为淡蓝色)中,过量的Fe2+(≥5 g/L)将V5+(2g/L)全部还原为V4+,结合2.1中图1可知,Mextral 984H对V4+的萃取率不超过3%,可知此时复配溶液中的钒以V4+存在,铁以Fe2+和Fe3+同时存在,表明 Mextral 984H对V4+、Fe2+和Fe3+的萃取能力差,在采用Mextral 984H萃取体系时,可以将酸浸液中的V4+和Fe2+分别氧化为V5+和Fe3+,以提高钒的萃取率。
随着Fe3+浓度的增加,P204对V4+和Fe3+的萃取率逐渐下降,其中V4+的萃取率从46.92%下降到9%,Fe3+的萃取率从64.12%下降到26.88%,这表明P204对V4+和Fe3+分离效果不好,选择性为Fe3+>V4+。随着Fe2+浓度的增加,P204对V4+的萃取率基本不变,对Fe2+的萃取率由31.79%下降到6.88%,这表明P204对V4+的萃取率受Fe2+的浓度变化影响较小。在采用P204萃取体系时,可以将酸浸液中的Fe3+还原为Fe2+,增加钒的萃取率。随着Al3+浓度的增加,P204对V4+的萃取率从83.65%下降到76.19%,对Al3+的萃取率由4.56%上升到20.06%,表明Al3+浓度过高不利于P204萃取钒,且浓度超过10 g/L后,铝萃取率上升明显,为避免钒、铝共萃,在采用P204萃取体系时,控制Al3+浓度不要超过10 g/L。随着Mg2+浓度的增加,P204对V4+的萃取率基本维持在90%左右,对Mg2+的萃取率由4.46%上升到22.89%,这表明Mg2+浓度对P204萃取钒的影响较小,但Mg2+浓度过高,更多的Mg2+被共萃入有机相中,给后续反萃工序造成压力,因此在采用P204萃取体系时,Mg2+的浓度也需控制在10 g/L以下。

综上所述,Mextral 984H对V、Fe、Al和Mg的选择性为V5+>Fe3+=Fe2+=Al3+=Mg2+=V4+,钒杂选择分离性较好,不存在竞争萃取关系;P204对V、Fe、Al和Mg的选择性为Fe3+>V4+>V5+>Fe2+>Al3+=Mg2+,Fe3+和Al3+对钒的萃取率影响较大,存在竞争萃取关系。
2.3 反萃剂对钒反萃的影响
选取硫酸反萃时,Mextral 984H的负载有机相的反萃条件为温度30 ℃、相比O∶A=3∶1、搅拌时间20 min;P204的负载有机相的反萃条件为温度30 ℃、相比O∶A=8∶1、搅拌时间20 min。考察不同反萃硫酸浓度对钒单级反萃率的影响,试验结果如图5所示。

图5 硫酸浓度对钒反萃率的影响
从图5中可看出,稀硫酸溶液对Mextral 984H的负载有机相反萃效果极差,而对P204的负载有机相的反萃率随着浓度增加而上升,这侧面表明了虽然2种萃取剂同属阳离子交换机制,但是羟肟类萃取剂与钒发生的萃取反应不易逆向进行,受料液pH值影响较小,在低pH值下对钒仍保持较好的萃取效果,而P204与钒发生的萃取反应易逆向进行,受料液pH影响较大,在pH值从1.5变小时,钒的萃取率快速下降,这也符合2.1中的试验结果。


表2 反萃剂对钒反萃率的影响
由表2可知,弱碱性碳酸钠对Mextral 984H负载有机相的反萃具有一定作用,但碱容易乳化有机相,贫有机相不经过处理后直接回用萃取效果显者下降。同时钠离子富集难以高效回收,对反萃剂溶液pH值范围需要严格控制。而还原性反萃剂中草酸表现出较好的反萃效果,贫有机相不经过处理后直接回用萃取效果下降不明显。但温度过高对现场设备要求过高、有机相因挥发加大耗量等问题,因此需要进一步优化反萃工艺来降低反萃温度。
综上所述,羟肟萃取剂在正萃时表现出极佳的pH值适应性和选择性,但是反萃困难,可以考虑碱性反萃和还原反萃来实现钒萃合物螯合环的破坏,但反萃工艺均需进一步改善。而P204虽然在正萃时pH值适应性不强,选择性不高,但是可以通过还原预处理和前期除杂等方式,提高萃取效果,反萃相对简单。
3 结论
1)量子化学计算表明,相比于P204,Mextral 984H的钒萃合物的化学键键长值更小、分子能隙更大、化学性质更稳定,更适应在低pH值条件下直接进行高效萃取,从源头实现废水废渣的减量。
2)在最佳条件下,Mextral 984H对V(V)的单级萃取率为93.02%,其他杂质的萃取率均低于3%,钒杂分离效果好,且钒与杂质离子没有竞争吸附关系。P204对Fe(III)、V(IV)和V(V)均具有好的萃取性能,需要控制Al(III)和Mg(II)的离子浓度在10 g/L以下,减少共萃,钒与杂质离子有竞争吸附关系。
3)Mextral 984H正萃效果极佳,但反萃相对困难,碳酸钠和草酸均具有较好的反萃效果。P204正萃效果差,反萃相对容易,但可以通过调控杂质离子浓度和还原Fe(III)来强化萃取。

