壳聚糖/磁性核桃壳生物炭的制备及其对高浓度Pb(Ⅱ)的吸附
燕 翔,杨建东,韩 丽,王都留,袁贵霞,范秀梅,周雅丽,郭宗杰,侯 峰
(陇南师范高等专科学校 农林技术学院, 甘肃 成县 742500)
利用农林废弃物核桃壳制备生物质吸附剂处理Pb(Ⅱ)污染废水已有较多的研究,这些生物质吸附剂大多存在质量轻、粒度小、固液分离困难等缺点[1-6]。磁性生物炭不仅可提高水中重金属离子的去除率,并且可实现吸附剂的分离回收,因此,近年来核桃壳吸附剂制备研究开始转向磁性生物质炭复合材料[4,7-9]。但磁性生物炭粒子在吸附过程中多存在颗粒团聚问题。针对此,研究采用壳聚糖(chitosan,记作CS)对生物炭进行功能修饰,不仅可以克服颗粒团聚问题,同时还可引入大量—NH2、—OH等活性基团,增加生物炭粒子的反应活性和活性位点,通过螯合作用、离子交换或形成离子对等方式,提高生物炭对水中重金属离子的吸附性能[1]。刘雪梅等[10]制备的壳聚糖/磁性甘蔗渣生物炭对Cr(Ⅵ)吸附去除率为98.7%。不同赋磁方法可生成γ-Fe2O3[11]、Fe3O4[12]和纳米零价铁[13]等铁磁性化合物,也会影响磁性生物质炭的结构和吸附性能。生物炭的吸附性能与生物质原料和制备工艺有密切关系。核桃壳的含碳量高、孔隙结构发达、活性基团丰富,可用作制备生物炭的原料。近年来我国的核桃种植业规模不断扩大。据统计,2021年我国的核桃产量达110 万t[14],尤其在北方地区,核桃壳是数量可观、价廉易得的农林固体废物资源。但目前国内外关于利用核桃壳制备磁性生物炭并用于重金属离子吸附的研究报道不多。
本文以核桃壳为原料,以浸渍法制得磁性核桃壳生物炭(magnetic walnut shell biochar,记作MWSB),再以聚乙二醇为交联剂,制备了壳聚糖/磁性核桃壳生物炭复合材料(chitosan/magnetic walnut shell biochar,记作CS/MWSB),利用SEM、FT-IR、BET、XRD、XPS、VSM表征技术对材料的形貌和理化性质进行分析,并考察了溶液初始pH值、吸附剂用量、溶液的Pb(Ⅱ)初始浓度、时间等因素对CS/MWSB吸附模拟废水中重金属Pb(Ⅱ)的影响,以期为核桃壳的综合利用及含Pb(Ⅱ)废水的治理提供参考。
1 试验部分
1.1 试剂与仪器
1.1.1试验试剂
试验所用的药品与试剂见表1。

表1 试验药品与试剂
1.1.2 试验仪器
试验主要仪器、型号及生产厂家见表2。
表2 试验仪器
1.2 材料制备
1.2.1 核桃壳生物炭的制备
按核桃壳∶5%H2O2(质量分数)=1 g∶3 mL的比例,将一定量的核桃壳粉加入到H2O2溶液中,搅拌300 min,超声处理60 min,过滤,65 ℃下烘干;然后在马弗炉中400 ℃下限氧热解120 min,冷却后洗至中性,65 ℃下烘干,即得核桃壳生物炭(walnut shell biochar,记作WSB)。
1.2.2 磁性核桃壳生物炭的制备
称取10 g WSB加入到100 mL 1 mol/L的FeCl3溶液中,搅拌120 min,超声处理60 min,陈化1 440 min,过滤,马弗炉中500 ℃下限氧活化120 min,依次用水和乙醇洗涤3次,65 ℃下烘干,即得磁性核桃壳生物炭(MWSB)。
1.2.3 壳聚糖/磁性核桃壳生物炭的制备
分别称量不同质量的CS,加入到500 mL 2%(体积分数)冰乙酸溶液中,密封搅拌180 min,加入10 mL的聚乙二醇和一定量的MWSB,60 ℃水浴锅中保温120 min。过滤,用去离子水洗涤3~5次,65 ℃下烘干,得到不同壳聚糖负载量的壳聚糖/磁性核桃壳生物炭,记作x%(质量分数)CS/MWSB(x=10、20、30、40、50)。
1.3 材料的表征测试
利用电子扫描电镜(SEM)对WSB、MWSB、CS/MWSB进行微观结构和表面形态观察;利用比表面积及孔径分析仪分析样品WSB、CS/MWSB的比表面积及孔径;利用傅里叶变换红外光谱仪(FT-IR)对样品WSB、MWSB、CS/MWSB分析,扫描范围4 000~400 cm-1波数;利用X射线衍射仪对样品WSB、MWSB、CS/MWSB进行晶相分析;采用X射线光电子能谱仪(XPS)对样品WSB、CS/MWSB进行X射线光电子能分析,检测样品是否成功负载磁性Fe3O4和CS;利用多功能振动样品磁强计(VSM)测定CS/MWSB的磁性参数,测定条件为室温,磁场范围为±20 000 emu/g。
1.4 吸附试验
称取MWSB、CS以及10%~50%(质量分数)CS/MWSB各50 mg,分别加入到50 mL 100 mg/L Pb(Ⅱ)溶液。在25 ℃和150 r/min下振荡吸附720 min,过滤后采用文献[5]方法,测量溶液中Pb(Ⅱ)浓度,以确定CS/MWSB的CS最佳质量分数。
称取0.05~1.0 g的30% CS/MWSB吸附剂,分别加入到pH值为3.0~5.5、初始浓度为50~400 mg/L的Pb(Ⅱ)溶液中,在转速150 r/min、温度20~60 ℃的条件下,振荡吸附5~1 440 min,过滤后采用文献[5]方法,测量溶液中Pb(Ⅱ)浓度,以考察溶液初始pH值、初始浓度、吸附剂投放量、吸附时间、温度等因素对CS/MWSB吸附Pb(Ⅱ)的影响。
称取0.2 g 30%CS/MWSB,加入到50 mL的去离子水中,振荡后静置,将磁铁置于试剂瓶的一侧,观察并比较磁分离效果。
利用式(1)~(2)计算材料对Pb(Ⅱ)的吸附容量q(mg/g)和去除率E(%)。
(1)
(2)
式中:C0、Ct分别为Pb(Ⅱ)溶液的起始浓度和吸附后浓度,mg/L;V为Pb(Ⅱ)溶液体积,L;m为吸附剂质量,g。
1.5 吸附动力学拟合
采用准一级动力学模型和准二级动力学模型描述MWSB吸附Pb2+的动力学过程[15],模型方程分别见式(3)、式(4)。
(3)
(4)
式中:t为吸附时间,min;Qe为平衡吸附容量,mg/g;Qt为t时刻生物炭对重金属的吸附容量,mg/g;k1为准一级动力学方程反应速率常数,min-1;k2为准二级动力学方程反应速率常数,g·mg-1·min-1。
为进一步确定吸附过程实际控速步骤,应用Weber-Morris颗粒内扩散模型对试验数据进行拟合[15],模型方程见式(5)。
Qt=kidt0.5+C
(5)
式中:t为吸附时间,min;kid为颗粒内扩散速率常数,mg·g-1·min-1/2;C为与吸附剂边界层厚度有关的常数,mg/g。
2 结果与分析
2.1 CS/MWSB的壳聚糖最佳负载量
在相同的试验条件下,MWSB、CS及CS/MWSB对废水中Pb(Ⅱ)的吸附性能试验结果如图1所示。由图1可见,CS/MWSB对Pb(Ⅱ)的去除率均高于MWSB和CS,表明CS的改性可增强MWSB对Pb(Ⅱ)的吸附能力;对比不同CS负载量的CS/MWSB对Pb(Ⅱ)的去除率,30%CS/MWSB对Pb(Ⅱ)的去除率最高,达到65.40%,比CS、MWSB分别提高了13.15%、20.89%。由此得出,CS/MWSB的CS负载量为30%较佳。

图1 MWSB、CS和CS/MWSB对Pb(Ⅱ)吸附性能比较
2.2 材料的表征分析
2.2.1 扫描电镜(SEM)
通过扫描电镜观察WSB、MWSB和CS/MWSB的表面特征和微观形态,如图2所示。由图2(a)可见,WSB表面较为光滑,呈褶皱状的无规则形貌,出现了许多圆形孔隙,增大了WSB的比表面积,这种孔隙结构有利于吸入重金属离子。由图2(b)可见,MWSB的材料表面附着上的许多球状颗粒,表明Fe3O4负载成功,并且Fe3O4颗粒没有出现明显的聚集情况。从图2(c)看出,CS/MWSB表面粗糙,壳聚糖包裹在磁性Fe3O4颗粒和生物炭的表面。分析表明,经赋磁改性和壳聚糖修饰的CS/MWSB的形态结构发生较大变化,生物炭表面更粗糙、皱褶和孔隙更丰富,使改性材料具有更多的活性位点,提高了CS/MWSB的反应活性[15]。

图2 WSB、MWSB和CS/MWSB的SEM图
2.2.2 BET测试结果分析
WSB、CS/MWSB的BET测试结果见表3。由表3 可见,CS/MWSB的BET和孔体积均比WSB降低,而平均孔径增大。这可能是由于Fe3O4颗粒或壳聚糖的引入使一些小尺寸的孔隙被堵住[16],大尺寸的孔隙相对增加,致使比表面积下降,孔体积变小,平均孔径变大,导致物理吸附能力下降,但壳聚糖的引入增加了活性官能团,提升了化学吸附能力。

表3 WSB和CS/MWSB的BET分析
2.2.3 X射线衍射(XRD)分析
WSB、MWSB和CS/MWSB的X射线衍射图谱见图3。从图3可看出:在2θ=16°~30°处有1个sp3杂化碳的宽衍射峰出现,表明生物炭是非晶态的无定型结构[5];MWSB和CS/MWSB有相似的特征峰,在2θ为30.1°、35.5°、43.1°、53.4°、57.0°、62.6°、74.3°处存在较为尖锐的特征峰,符合Fe3O4晶体的特征衍射峰[17],分别对应于Fe3O4晶体的(220)、(311)、(400)、(422)、(511)、(440)、(444)晶面,表明生物炭成功负载Fe3O4;负载铁氧化物和壳聚糖后并未改变WSB结构,MWSB和CS/MWSB在2θ为33.20°和49.50°处均出现2个衍射峰,分别对应斜六方Fe2O3的(104)和(024)晶面,表明在炭化的过程中部分Fe3O4相变为Fe2O3[18]。

图3 WSB、MWSB和CS/MWSB的XRD图
2.2.4 X射线光电子能谱(XPS)分析
WSB和CS/MWSB的XPS分析如图4所示。从图4可看出:WSB在结合能为284.3 eV和532.09 eV处出现C1s和O1s的特征峰,CS/MWSB在结合能为284.15 eV、532.17 eV、399.96 eV、711.68.04 eV 出现了C1s、O1s、N1s、Fe2p的特征峰,表明Fe3O4被成功负载于核桃壳生物炭[1]。

图4 WSB和CS/MWSB的XPS全谱图
2.2.5 傅里叶红外光谱分析(FT-IR)

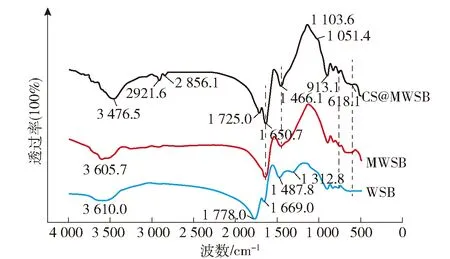
图5 WSB、MWSB和CS/MWSB的FT-IR图
2.2.6 磁滞曲线(VSM)分析
CS/MWSB磁滞曲线见图6。由图6(a)看出,磁性改性材料的磁滞回线接近“S”型,饱和磁化强度为1.984 emu/g,利用外加磁场可实现CS/MWSB的分离、回收。另外,由图6(b)看出,磁滞曲线存在明显的磁滞现象,显示出少量铁磁性,矫顽力(Hc)为149.5 G,剩余磁化强度(Mr)为0.270 0 emu/g。可能在MWSB活化过程中部分Fe3O4在高温条件下相变为Fe2O3,这与XRD测量的结果一致[21]。
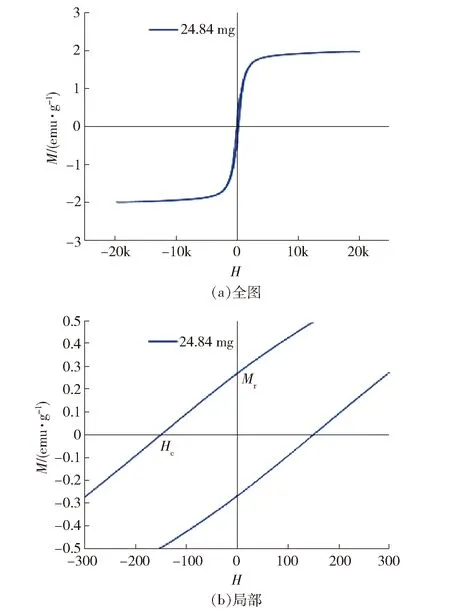
图6 CS/MWSB的磁滞曲线
2.2.7 CS/MWSB的磁性分离试验
CS/MWSB的磁性分离情况如图7(a)和图7(b)所示,结果表明该材料可被磁铁吸附而从水中分离出来,可用于重金属废水处理后CS/MWSB的回收。另外,从图7(a)可以看出,CS/MWSB在吸附Pb(Ⅱ)过程没有发生聚集现象,表明该材料相比磁性生物炭颗粒而言不容易发生聚集。

图7 CS/MWSB的磁分离结果
2.3 CS/ MWSB吸附Pb(Ⅱ)影响因素的研究
2.3.1 溶液初始pH对吸附Pb(Ⅱ)的影响
称取50 mg 30%CS/MWSB,分别加到pH值为3.0、3.5、4.0、4.5、5.0、5.5的100 mg/L Pb(Ⅱ)溶液中,在25 ℃下振荡吸附120 min,考察pH值对CS/MWSB吸附Pb(Ⅱ)的影响,试验结果见图8。当pH值为1.0~2.0时,由于CS/MWSB表面的一些酸性官能团因质子化而带正电荷,使溶液中的H+与Pb(Ⅱ)因排斥而产生竞争作用,导致吸附容量较小[22]。当pH值升高时,与Pb(Ⅱ)竞争的H+减少,吸附剂表面的酸性官能团因被去质子化而正电荷逐渐减少,H+与Pb(Ⅱ)排斥作用大幅减弱,吸附容量逐渐增加,pH值为5.0时CS/MWSB去除率达到最高。随pH值再继续增大,H+浓度逐渐减小,Pb(Ⅱ)开始以Pb(OH)+、Pb(OH)2形式存在[23],使Pb(Ⅱ)浓度降低,CS/MWSB对Pb(Ⅱ)的吸附量逐渐降低。综合分析,pH值为5.0时CS/MWSB吸附Pb(Ⅱ)的效果最佳。

图8 pH值对CS/MWSB吸附Pb(Ⅱ)的影响
2.3.2 吸附剂用量对吸附Pb(Ⅱ)的影响
量取pH=5.0、100 mg/L Pb(Ⅱ)溶液50 mL,分别加入0.05 g、0.10 g、0.20 g、0.40 g、0.60 g、0.80 g、1.00 g 30%CS/MWSB,在25 ℃下振荡吸附120 min,考察吸附剂用量对吸附Pb(Ⅱ)的影响,试验结果如图9所示。吸附剂用量在1~4 g/L时,Pb(Ⅱ)去除率由58.2%增长至75.9%。当吸附剂用量超过4 g/L后,Pb(Ⅱ)去除率升高缓慢,这可能是过量的CS/MWSB材料导致其自身颗粒发生聚集现象,使CS/MWSB的总表面积下降[24]。故后续吸附试验CS/MWSB的投加量以4 g/L为佳。
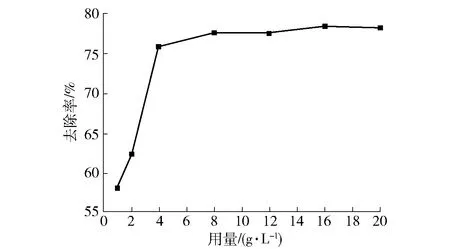
图9 CS/MWSB用量对吸附Pb(Ⅱ)的影响
2.3.3 温度对吸附Pb(Ⅱ)效果的影响
量取pH=5.0、100 mg/L Pb(Ⅱ)溶液50 mL,加入0.20 g 30%CS/MWSB,分别在20 ℃、30 ℃、40 ℃、50 ℃、60 ℃下振荡吸附120 min,考察温度对Pb(Ⅱ)效果的影响,试验结果如图10所示。由图可知:在20~40 ℃时,CS/MWSB对Pb(Ⅱ)的去除率随温度的升高而升高,当温度大于40 ℃时,随着温度升高,去除率减小。温度升高,重金属离子的布朗运动加剧,有利于重金属离子向吸附剂表面和内部扩散[25]。但温度过高会导致解吸速度加快,使吸附能力降低。故CS/MWSB吸附Pb(Ⅱ)的适宜温度为40 ℃。

图10 温度对CS/MWSB吸附Pb(Ⅱ)的影响
2.3.4 时间对吸附Pb(Ⅱ)的影响
称取0.20 g 30%CS/MWSB于50 mL的pH 5.0、100 mg/L Pb(Ⅱ)溶液中,在40 ℃下分别振荡5 min、10 min、20 min、40 min、60 min、80 min、100 min、120 min、180 min、240 min、300 min、360 min、800 min、1 440 min,考察时间对CS/MWSB吸附Pb(Ⅱ)的影响,试验结果如图11所示。由图可知:在初始的120 min内,CS/MWSB对Pb(Ⅱ)的吸附速率较快,去除率达到78.5%以上,这是由于吸附初期阶段,CMMB表面孔隙通道较多,表面官能团数量充足,能提供较多的配位位点,Pb(Ⅱ)极易被吸附在吸附剂表面或进入孔隙通道;随着吸附时间的延长,Pb(Ⅱ)占据了吸附剂更多的吸附位点,同时,颗粒内扩散也使得孔隙通道被填满,所以 Pb(Ⅱ)去除率基本保持稳定[26]。综合考虑吸附时效,以180 min为CS/MWSB吸附Pb(Ⅱ)的最佳时间。
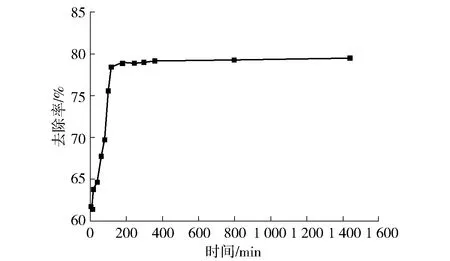
图11 时间对CS/MWSB吸附的影响
2.3.5 溶液的Pb(Ⅱ)初始浓度对吸附Pb(Ⅱ)的影响
分别量取pH=5.0、浓度为50 mg/L、75 mg/L、100 mg/L、150 mg/L、200 mg/L、300 mg/L、400 mg/L的Pb(Ⅱ)溶液50 mL,各加入0.20 g 30% CS/MWSB,在40 ℃下振荡吸附180 min,考察Pb(Ⅱ)溶液初始浓度对吸附Pb(Ⅱ)的影响,试验结果如图12所示。由图可知:当溶液中Pb(Ⅱ)浓度由50 mg/L逐渐增加到400 mg/L时,Pb(Ⅱ)的去除率由34.30%上升至90.86%,吸附量也由4.29 mg/g升到89.86 mg/g;随Pb(Ⅱ)初始浓度增加,为Pb(Ⅱ)传质提供的更大推动力,所以吸附剂单位吸附量逐渐增加;随着反应进行,吸附剂上的吸附位点逐渐饱和,吸附速率减慢,Pb(Ⅱ)去除率呈现缓慢增加趋势。可见,CS/MWSB对于高浓度的Pb(Ⅱ)溶液具有较强的去除效果,适宜于处理高浓度Pb(Ⅱ)废水。
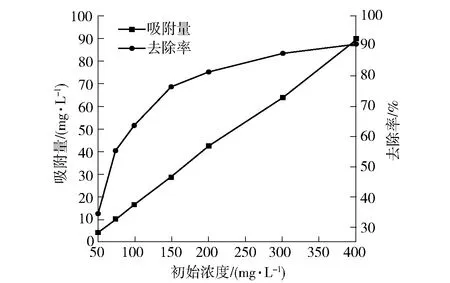
图12 Pb(Ⅱ)初始浓度对CS/MWSB吸附Pb(Ⅱ)的影响
2.4 吸附动力学研究
为研究CS/MWSB对Pb2+吸附动力学,采用式(3)、式(4)和式(5)分别以准一级动力学模型、准二级动力学模型和颗粒扩散模型对CS/MWSB吸附Pb(Ⅱ)的过程进行拟合。图13(a)、(b)、(c)分别为CS/MWSB对Pb(Ⅱ)吸附过程的3种模型的拟合曲线,各参数见表4。

图13 CS/MWSB吸附Pb(Ⅱ)的动力学曲线

表4 CS/MWSB吸附Pb(Ⅱ)的不同动力学模型的参数
由图13(a)可知,准一级动力学模型仅能描述吸附的初始阶段,而对于整个过程的拟合程度较差,R2=0.852。图13(b)反映出CS/MWSB对Pb(Ⅱ)的吸附过程与准二级动力学模型拟合程度较高,R2=0.999。准二级动力学方程拟合得到的理论平衡吸附量为15.060 mg/g,与实验平衡吸附量(14.450 mg/g)很接近,表明CS/MWSB对Pb(Ⅱ)
3 结论
1)WSB在热解后形成了丰富的孔隙结构,为负载Fe3O4和壳聚糖提供了大量的位点。MWSB和CS/MWSB表面负载Fe3O4球状颗粒,利用永久磁体可以将CS/MWSB从水溶液体系中分离出来。
2)负载Fe3O4、CS会导致WSB比表面积的减小,降低MWSB对Pb(Ⅱ)的物理吸附性能。但CS/MWSB的—NH2、含氧基团及芳香基团均有所增加,增强了对Pb(Ⅱ)的化学吸附作用。
3)CS/MWSB对于高浓度Pb(Ⅱ)废水有较好的处理效果。吸附试验表明,对于pH=5.0、初始浓度为400 mg/L Pb(Ⅱ)溶液,当吸附剂用量为4 g/L时,在40 ℃下吸附180 min,CS/MWSB对Pb(Ⅱ)吸附量为89.86 mg/g,吸附率可达90.86%。
4)吸附动力学拟合表明,准二级动力学模型可以更好描述CS/MWSB对Pb(Ⅱ)的吸附过程,CS/MWSB对Pb(Ⅱ)吸附主要是化学吸附作用。

