桂籽提取物对LPS诱导的AML12细胞的保护作用及机制研究
黄 婷,要 辉,2,张雨晨,2,吴宇培,王琢文,王洁琼,杨洪飞,葛婷婷,闵 清,2*
(1.湖北科技学院医学部药学院,湖北 咸宁 437100;2.鄂南特色中药湖北省工程研究中心)
桂花为木犀科(Oleaceae)木犀属(Osmanthus)植物,桂花果(桂花子)为其果实。桂花果一般于4~5月成熟,含有挥发油、脂肪酸、萜类、糖苷类、多酚类等多种化学成分,《植物名实图考长编》记载桂子可治心痛[1]。研究表明,桂籽中主要含有环烯醚萜苷类、红景天苷类、齐墩果酸、三萜皂苷类、黄酮类等化合物[2-4],具有抗炎镇痛、抑菌、镇静、降压、抗肿瘤、抑制血小板聚集等多种生物活性[5-7]。前期研究发现,采用本实验室方法制备的桂籽提取物中含有大量的三萜类化合物,可以保护由刀豆蛋白引起的免疫性肝损伤[8],此外桂籽提取物可以保护大鼠的急性肺损伤[9],对于LPS诱导的小鼠正常肝细胞损伤的研究未见报道。为更好地开发利用这一天然资源,在本研究中探讨了桂籽提取物在体外对于LPS诱导的肝细胞损伤的保护作用及机制,以期为桂籽的开发利用提供实验依据。
1 材料与方法
1.1 药物与试剂
小鼠正常肝细胞(AML12,湖南丰晖生物科技有限公司)。
桂籽提取物(OFSN)的制备,参照吕伟等[9]报道的方法,脱脂后用95%乙醇加热回流提取3次,合并滤液,取正丁醇萃取部位进行试验,使用时溶解于DMEM,无菌滤头过滤。
脂多糖(LPS,325D031)购于Solarbio公司;阿司匹林(Aspirin,批号A2225059)购于上海阿拉丁生化科技股份有限公司;DMEM高糖培养基购于美国Hyclone公司;胎牛血清、胰酶购于美国Gibco公司;100×青霉素-链霉素双抗、活性氧ROS试剂盒购于Biosharp公司;CCK-8试剂盒、RIPA强裂解液、蛋白酶抑制剂、Cocktail购于大连美仑生物技术有限公司;SDS-PAGE凝胶试剂盒购于武汉塞维尔生物科技有限公司;TLR4(A5258)、NF-κB p65(AP0707)、NLRP3(A12694)、COX-2(A1253)、IL-6(A0286)、GAPDH(AC001)抗体购于武汉爱博泰克生物科技有限公司;HRP-标记羊抗兔IgG(135332)购于武汉科瑞生物技术有限公司。
1.2 仪器
CO2细胞培养箱(美国Thermo公司);SPARK型酶标仪(瑞士TECAN公司);超净工作台(苏州安泰公司);低温高速离心机TGL-20M(湖南湘仪离心机仪器有限公司);电子分析天平(德国Sartorius公司);电泳仪、转印槽、免疫印迹工作站(美国BIO-RAD公司);PGH-40-AS纯水机(武汉品冠仪器设备有限公司);倒置荧光显微镜(Leica公司)。
1.3 方法
1.3.1 细胞培养
AML12培养于含有10%胎牛血清及1%双抗的DMEM完全培养基,5%CO2、37℃。当细胞密度达到80%左右时加入0.25%胰酶消化2min,1000r/min离心5min进行重悬,传代培养。
1.3.2 CCK-8法检测细胞活力
0.25%胰酶消化对数生长期的AML12,用DMEM完全培养基配制成密度为8×104个/mL的细胞悬液,按每孔100μL接种到96孔板中,置于培养箱中培养24h至细胞培养贴壁。
(1)不同时间下OFSN对细胞活力的影响。弃去原有培养基,加入含有0、50、100、200、400、800、1600、3200μg/mL OFSN的DMEM培养基,每个浓度重复3个复孔,分别孵育6、12h。结束孵育后,弃去含药培养基,加入100μL含有10% CCK-8溶液的无血清培养基,置于细胞培养箱内继续孵育2h,设置未接种细胞的孔为空白调零孔,于450nm处测定吸光度,计算细胞存活率,重复试验3次,取均值,根据结果选择合适的OFSN孵育时间。

其中,A给药为给药组的吸光值;A0为不含细胞孔的吸光值;A空白为含细胞未给药孔的吸光值。
(2)OFSN和Aspirin对LPS诱导的细胞活力的影响。分别设置零孔(不含细胞)、Control组、LPS组、OFSN组(25、50、100、200、400、800、1600、3200μg/mL)以及Aspirin组(56.25、112.5、225、450、900、1800、3600μg/mL),每组设置3个复孔,在细胞培养箱中分别孵育6h后,弃去含药培养基,PBS洗涤两次,加入含1μg/mL LPS的无血清培养基处理12h[10]。结束孵育后,按1.3.1进行处理并计算细胞存活率,重复试验3次,取均值,根据结果选择合适的OFSN与Aspirin给药浓度。
1.3.3 细胞内ROS水平的检测
按1.3.2方法消化对数生长期的细胞,调整细胞悬液密度为5×104个/mL,按每孔1mL接种到24孔板中,置于培养箱中培养24h至细胞贴壁。设置Control组、LPS组(LPS1μg/mL)、Asipirin组(Asipirin 900μg/mL+LPS1μg/mL)、低剂量组(OFSN 100μg/mL+LPS1μg/mL)、中剂量组(OFSN 200μg/mL+LPS1μg/mL)、高剂量组(OFSN 400μg/mL+LPS1μg/mL),每组设置3个复孔,Asipirin和OFSN处理6h后再经LPS处理12h。给药结束后弃去含药培养基,加入含有10μM H2DCFH-DA的无血清培养基孵育1h,用无血清培养基洗涤两次后在荧光显微镜下观察。
1.3.4 Western blot检测细胞蛋白的变化
将细胞接种于10cm培养皿中,待细胞密度达到90%时,按照1.3.3下的细胞分组及给药方式给药。培养结束,收集各组细胞,超声细胞破碎仪冰上破碎后4℃离心,取上清液即获得细胞总蛋白。采用BCA法测定蛋白浓度,制备蛋白样品。蛋白样品95℃高温变性后,进行蛋白电泳、转膜,5%脱脂奶粉封闭1h,4℃孵育TLR4、NF-κB p65、NLRP3、COX-2、IL-6、GAPDH一抗(稀释度分别为1∶1000、1∶1500、1∶1000、1∶1000、1∶1000、1∶5000)过夜;次日以TBST溶液清洗3次,每次10 min,室温孵育IgG(HRP)二抗(稀释度为1∶10000),洗膜,采用ECL显色后于蛋白成像系统中曝光。Image Lab软件分析,以目的蛋白/内参蛋白灰度值之间的比值表示相关蛋白的表达水平。
1.4 统计学方法

2 结 果
2.1 CCK-8法检测不同时间对AML12细胞的影响
在相同浓度下,6h时细胞活力较为稳定,且无明显的毒副作用。加入50、100、200、400、800、1600、3200μg/mL OFSN的DMEM培养基,12h的细胞存活率与0μg/mL组比,更具显著性差异(P<0.01)。见图1。因此,选择6h作为后续给药时间。
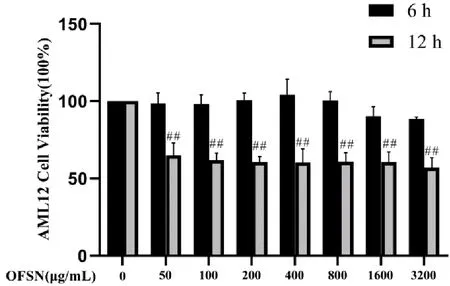
与OFSN 0μg/mL组比较,##P<0.01。
2.2 OFSN及Aspirin对LPS诱导AML12细胞活性的影响
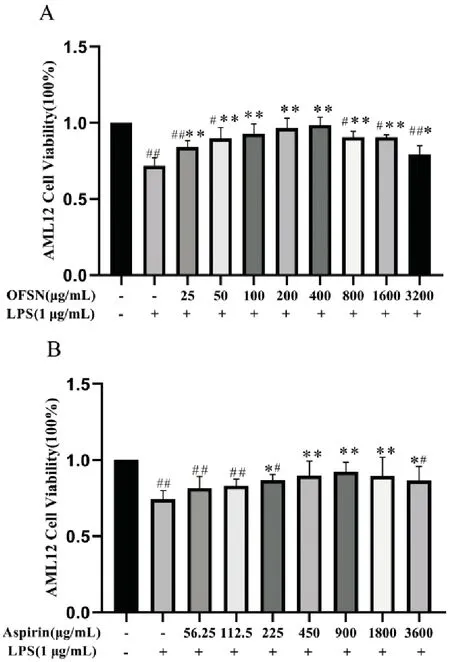
A.OFSN对LPS诱导AML12活性的影响,B.Aspirin对LPS诱导AML12活性的影响;其中不含药物与LPS组为Control组(与Control组比较,#P<0.05,##P<0.01;与LPS组比较,*P<0.05,**P<0.01)。
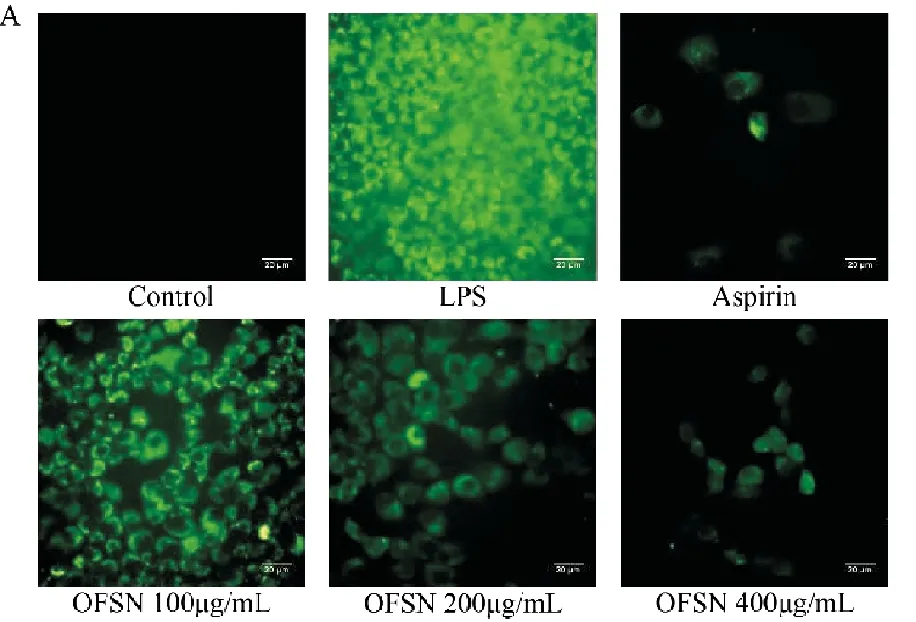
A.各组细胞荧光照片;B.荧光强度统计图(与Control组比较,##P<0.01;与LPS组比较,**P<0.01)。
与Control组相比,LPS组中细胞存活率显著减少(P<0.01);与LPS组比较,OFSN浓度为25~400μg/mL时细胞活力均升高,浓度在100~400μg/mL时细胞存活率显著增多(P<0.01),且与Control组相比无显著性差异(P>0.05),细胞活性呈现先升后降的趋势,表明OFSN对LPS诱导的细胞损伤具有保护作用,见图2A;Aspirin的浓度在225~3600μg/mL时细胞存活率升高,在900μg/mL时细胞存活率达到峰值,见图2B。因此,实验选用100、200、400μg/mL作为OFSN低、中、高剂量组,Aspirin 900μg/mL进行研究。
2.3 OFSN对LPS诱导AML12内ROS产生的影响
在装载了H2DCFH-DA荧光探针后,LPS组及各给药组细胞内都有不同强度的荧光产生,Control组偶有微弱的荧光。定量分析结果可知,LPS处理12h后的LPS组荧光强度显著高于Control组(P<0.01);与LPS组相比,OFSN中、高剂量组的荧光强度显著下降(P<0.01)。见图3。此结果可知,OFSN干预可减少LPS诱导AML12后细胞内ROS的产生。
2.4 OFSN对AML12中蛋白水平的影响
与Control组相比,LPS组中TLR4、NF-κB p65、COX-2、NLRP3及IL-6的蛋白表达量显著升高(P<0.01);各OFSN给药组中TLR4、NF-κB p65、COX-2、NLRP3及IL-6的蛋白表达含量高于Control组,但明显低于LPS组,在400μg/mL时5种蛋白的变化更为显著(P<0.01)。见图4。以上结果说明OFSN可通过抑制TLR4/NF-κB p65通路蛋白的表达,从而保护LPS诱导的AML12的损伤。
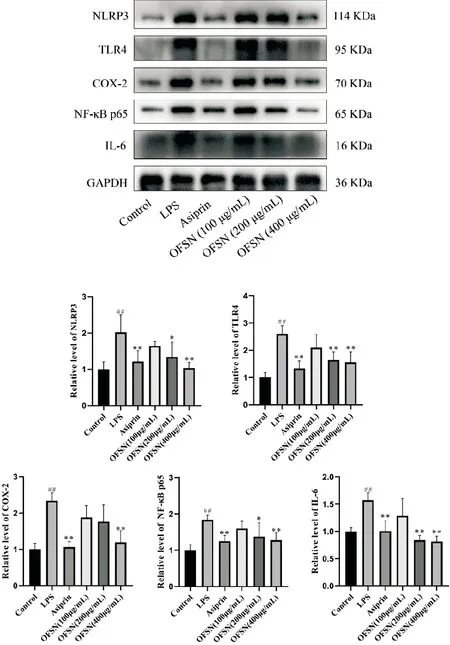
与Control组比较,##P<0.01;与LPS组比较,*P<0.05,**P<0.01。
3 讨 论
Toll样受体是一种可以识别具有保守结构分子的跨膜蛋白,其中TLR4可以识别LPS,TLR4被激活后会导致自身免疫性疾病[11];同时TLR4的激活还会引起信号级联,转录子如NF-κB活化[12],NF-κB被激活下游炎性介导因子COX-2释放增多[13],促进炎症的发生和发展,使组织器官受到损伤。Toll样受体在途径中的信号传导环节还会增强ROS的产生[14],过量的ROS会导致细胞发生氧化应激和引起细胞代谢功能受损,并可通过直接破坏必需的蛋白质、DNA或脂质而直接引起细胞死亡或导致包括炎症在内的一系列疾病的发生[15]。NLRP3炎性小体是一种重要的细胞内免疫复合物,具有调控炎症反应和促进炎性细胞因子释放的功能。在很多疾病和感染的过程中,NLRP3炎性小体的激活起着关键作用[16]。而NLRP3炎性小体的激活过程也主要与ROS的产生有关,研究者们使用了多种抗氧化剂和ROS生成抑制剂进行实验,结果发现,抑制ROS生成可以减少NLRP3炎性小体的激活和IL-6、IL-1β的分泌[17]。综上,减少TLR4/NF-κB p65蛋白的表达,从而抑制ROS的产生、减少炎症相关蛋白的表达,在减轻氧化应激及炎症损伤中起着重要作用。
在本次研究中,可以观察到LPS诱导后的AML12存活率下降,细胞内生成大量ROS,细胞进入氧化应激状态,TLR4、NF-κB p65、COX-2、NLRP3及IL-6蛋白表达增加。而经过OFSN处理后,LPS诱导的细胞存活率上升,细胞中ROS产生减少,TLR4/NF-κB p65信号通路蛋白表达下降,下游的COX-2、NLRP3、IL-6蛋白表达减少。一系列的结果都表明OFSN对LPS诱导的AML12损伤具有一定的保护作用,且作用机制可能与抑制细胞内ROS的产生及下调TLR4/NF-κB P65通路中有关蛋白的表达有关。后续我们将在动物中进行体内实验,加以验证OFSN对于LPS诱导的肝损伤的保护作用,为桂籽这一天然产物的进一步开发提供理论依据和实验支持。

