短链氯化石蜡长期低剂量暴露对小鼠肝脏的影响*
黎威巍,马 萍,杨 旭,晏 彪
(湖北科技学院基础医学研究中心,湖北 咸宁 437100)
氯化石蜡(chlorinated paraffins,CPs)被广泛应用于金属加工润滑液、密封胶添加剂、阻燃剂、聚氯乙烯增塑剂等,是一类具有持久性、生物毒性、生物富集性和长距离迁移性的有机污染物,普遍存在于环境中[1]。作为一类新型污染物,短链氯化石蜡(short-chain chlorinated paraffins,SCCPs)2017年被列入《斯德哥尔摩公约》受控名单,并引起全球的关注[2]。我国是全球SCCPs第一大生产国和出口国,居民的SCCPs负担和健康风险也随之加剧。食品消费已被确定为人类接触SCCPs的主要途径[3]。研究表明[4],江苏、湖北和浙江等省份SCCPs浓度显示出较高水平,大多数动物性食品中的SCCPs浓度高于植物性食品;SCCPs的估计每日摄入量(estimated daily intakes,EDIs)平均值为0.7μg/(kg·d),主要来自谷物、蔬菜和肉类。虽然毒理学研究已经表明高剂量SCCPs对啮齿动物具有肝毒性、肾毒性和甲状腺毒性,但环境相关剂量0.7μg/(kg·d) SCCPs可能引起的健康风险仍不清楚[5]。肝脏作为最大的解毒器官,肝脏的正常功能及其代谢对于维持健康非常重要[6]。因而,本研究旨在探究长期低剂量SCCPs暴露是否能引起肝功能及其代谢异常,为揭示SCCPs致病的分子机制提供基础数据。
1 材料与方法
1.1 实验动物及分组
4周龄SPF雄性昆明(KM)小鼠16只,体质量21~23g,购自湖北省实验动物研究中心[合格证号SYXK(鄂)2015-0052]。置于标准饲养条件下,温度20℃~25℃,湿度50%~70%,12h光照/12h黑暗周期。实验鼠随机分为对照组、SCCPs暴露组,每组8只。SCCPs所用剂量参考EDIs 0.7μg/(kg·d)与人群真实环境中的膳食暴露水平保持一致[5],通过给小鼠灌胃,建立暴露组模型。实验所有步骤均经湖北科技学院实验动物伦理委员会批准(批准号2022-03-025)。
1.2 主要仪器与试剂
5415R低温冷冻离心机(德国Eppendorf),HM 325切片机(美国Thermo),FLx 800荧光酶标仪(美国Bio-Tek),BX-53荧光正置显微镜(日本Olympus),SCCPs(CAS:85535-84-8,C10-13,美国Sigma),4%多聚甲醛固定液(P0099,碧云天),Hoechst 33258荧光染料(>99.9%,美国Sigma),谷草转氨酶(AST,CAS:C010-2-1)、谷丙转氨酶(ALT,CAS:C009-2-1)、白蛋白(ALB,CAS:A028-2-1)、乳酸(LD,CAS:A019-2-1)试剂盒购自南京建成生物工程研究所,詹纳斯绿B染色液(0.2%,CAS:G1571)、谷氨酰胺(GLN,CAS:BC5305)、谷氨酸(GLU,CAS:BC1580)、游离脂肪酸(FFA,CAS:BC0595)含量检测试剂盒购自北京索莱宝,其他试剂为国产分析纯。
1.3 取材及生化指标检测
48d后,颈椎脱臼法处死小鼠,取出约4g的肝组织经洗涤后,加入4mL预冷的匀浆液(0.25mol/L蔗糖、0.003mol/L氯化钙),用匀浆器充分研磨肝组织,离心后收集匀浆液。按照试剂盒说明书,测定生化指标ALT、AST、ALP等。
1.4 肝组织病理学观察
新鲜取材的肝组织用4%多聚甲醛固定,常规脱水,分别用苏木素-伊红(H&E)和甲苯胺蓝染色石蜡包埋后对小鼠肝脏进行病理学观察。垂直切片厚度5μm,所有切片均通过NDP view 2软件(日本Hamamatsu)扫描并分析。
1.5 肝脏细胞线粒体的分级分离与特异染色
通过分级分离得到的组分,可用特异染色的方法进行形态和功能鉴定。取约1g的肝组织洗涤后置入小平皿中,充分剪碎肝组织。经过滤后首先以2000rpm离心7min,收集上清液于1.5mL离心EP管,然后10 000rpm离心5min,弃上清液,将沉淀重悬,再10 000rpm离心5min,将所得沉淀制成涂片,詹纳斯绿B染液染色后用BX53显微镜镜检并拍片。应用Image J软件中Mitochondria Analyzer插件对线粒体数量和形态进行分析[7-8]。
1.6 肝组织Hoechst 33258荧光染色
常规包埋、切片、脱蜡、透明后,用磷酸盐缓冲液(PBS)水洗两次,每次2min,吸弃液体,手动摇晃数次,加入0.5mL Hoechst 33258工作液(浓度5μg/mL),染色5min,用PBS洗去多余染色液,经Hoechst 33258染色后的切片滴加一滴抗淬灭封片液,盖上洁净盖玻片,然后用BX-53荧光显微镜观察并拍片。应用Image J软件对荧光图片进行半定量分析,平均荧光强度(Mean)=该区域荧光强度总和(IntDen)/该区域面积(Area)。
1.7 统计学方法

2 结 果
2.1 SCCPs对KM鼠肝功能的影响
SCCPs暴露对KM鼠肝功能生化指标有显著影响(图1)。与对照组比较,SCCPs暴露组AST、ALT和ALP水平显著升高,AST/ALT比值显著降低,差异均有统计学意义(P均<0.05)。
2.2 SCCPs对KM鼠肝脏的组织病理学影响
SCCPs暴露组KM鼠肝组织出现一定程度的病理学改变(图2)。HE病理学结果显示,与对照组比较,SCCPs暴露组可见小叶结构不清、肝索变窄、胞浆疏松化、略见气球样变(图2A)。甲苯胺蓝病理学结果显示,与对照组比较,SCCPs暴露组可见肝细胞肿大,肝细胞空泡化结构(图2B)。
2.3 SCCPs对KM鼠肝细胞线粒体的影响
线粒体含有细胞色素氧化酶系使詹纳斯绿B保持氧化状态而显绿色,在高倍镜下观察到亮绿色的颗粒状或棒状结构即为线粒体。SCCPs暴露对KM鼠肝细胞线粒体的形态和大小均有不同程度的影响,詹纳斯绿B染色结果显示,与对照组比较,SCCPs暴露组肝细胞线粒体出现肿胀、体积增大,见图3。异常的线粒体数量显著增多,相应的面积比也显著增大,差异均有统计学意义(P<0.05),见表1。
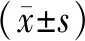
表1 各组小鼠肝细胞异常的线粒体变化
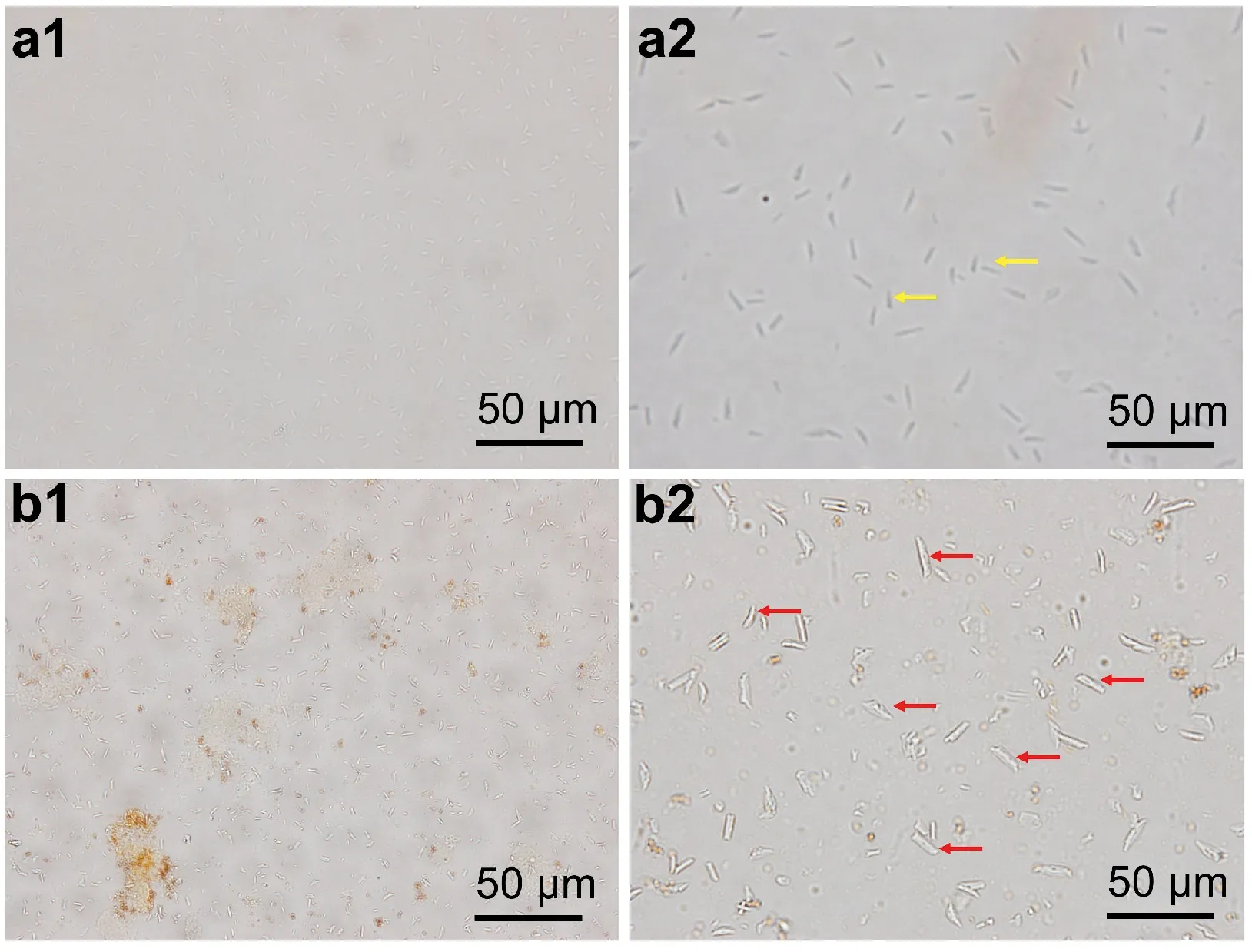
a1、a2.对照组;b1、b2.SCCPs暴露组;a2、b2×40倍;bar=50μm;黄色箭头表示正常线粒体形态、红色箭头表示异常线粒体形态。
2.4 SCCPs对KM鼠肝细胞凋亡的影响
荧光染色结果显示,对照组正常肝细胞为浅蓝色,而SCCPs暴露组凋亡细胞为高亮蓝色、细胞核内凋亡小体明显增多(图4A)。与对照组相比,SCCPs暴露组的平均荧光强度显著升高,差异有统计学意义(P<0.05),见图4B。

A.Hoechst 33258荧光染色;B.平均荧光强度;a.对照组;b.SCCPs暴露组(bar=50μm);SCCPs暴露组与对照组比较,*P<0.05。
3 讨 论
SCCPs在人体的血液和乳液中被高丰度检出,其健康影响不容忽视[9]。现有研究表明[10],SCCPs慢性口服暴露可导致F344/Nd大鼠和B6C3F1小鼠的肝癌。SCCPs还可能通过与过氧化物酶体增殖物激活受体α(PPARα)相互作用,破坏雄性大鼠肝脏的脂肪酸代谢[11]。本研究进一步发现,长期低剂量SCCPs暴露可引起受试鼠肝功能异常,使肝细胞肿大、呈现空泡化病理结构,损伤肝细胞线粒体形态和结构,紊乱线粒体代谢功能。由此推测,SCCPs的肝毒性机制或与其致肝细胞线粒体功能障碍有关。
肝脏可能是SCCPs毒作用的靶器官之一。本研究结果表明,ALT、AST、ALP升高及AST/ALT比值降低提示SCCPs暴露对肝脏的损害,病理学观察则进一步证实了这一结果。其他研究报道[12],SCCPs暴露后SD大鼠肝脏中参与代谢反应的重要基因cyp2b1、ugt1a1和oat2的表达水平显著升高。Yang等[5]基于超高效液相色谱(UPLC-Q-TOF-MS)的血浆代谢组学研究了SCCPs在SD大鼠体内的毒性。高剂量SCCPs暴露后,肝、肾损伤迅速发生,SCCPs可抑制三羧酸(TCA)循环,干扰能量代谢、氨基酸代谢等途径。Geng等[13]毒理学研究表明,环境剂量0.01mg/(kg·d)的SCCPs毒性不明显,高剂量100mg/(kg·d)的SCCPs可抑制大鼠的生长速度,增加SD大鼠的肝脏重量;代谢组学分析表明,SCCPs的毒性在环境相关剂量下即可被触发,SCCPs暴露抑制能量代谢,使血糖下降,引起TCA循环功能障碍。
SCCPs诱导的肝损伤或与肝细胞线粒体功能紊乱存在着密切的联系。许多研究证实[14-15],在肝损伤和其他多种肝脏病变时,肝细胞线粒体从数量、形态和功能上均有不同程度的变化。作为细胞代谢的中心枢纽,线粒体是细胞内最为敏感且关键的一个细胞器,其结构完整性和功能稳定性对于维持细胞的能量与物质代谢至关重要[15]。本研究表明,SCCPs暴露可改变KM鼠肝细胞中线粒体的形态和功能。许多病理情况下线粒体首先出现形态改变,有资料表明[16],在肝病理状态下,琥泊酸脱氢酶、ATP酶等的活性均显著降低,这从组织化学角度提示线粒体功能的下降。此外,Geng等[17]研究表明,环境剂量(<100μg/L)SCCPs显著抑制HepG2细胞活力,并能改变细胞内的氧化还原状态;刺激不饱和脂肪酸和长链脂肪酸的β氧化,导致能量代谢紊乱。在氨基酸中,谷氨酰胺是一类含量丰富、可进一步转化为乙酰辅酶A等前体参与TCA循环的非必需氨基酸,其代谢产物谷氨酸直接参与谷胱甘肽的合成,为细胞提供还原力。当一些线粒体结构遭到损坏,有氧呼吸能力下降,细胞可以通过促进这部分线粒体和正常的线粒体融合以抵御代谢压力,维持代谢稳态;然而,谷氨酰胺的缺乏导致线粒体无法融合,破坏了细胞内氧化还原反应平衡与能量代谢稳态[18]。由此,本研究推测SCCPs暴露可能增加葡萄糖的糖酵解途径,增加乳酸、脂肪酸氧化水平,干扰线粒体内有氧代谢即TCA循环途径,降低线粒体的能量代谢功能,进而导致肝损伤。
综上,本研究探究了环境相关浓度SCCPs暴露对肝脏的潜在影响及其可能机制;线粒体结构及功能异常可作为SCCP致肝损伤的指标之一。开展对肝脏线粒体结构和功能的深入研究,可以进一步阐明SCCPs的致病机制,为SCCPs相关肝病的防治提供理论基础。

