还原型谷胱甘肽联合苯巴比妥治疗新生儿黄疸的疗效分析*
陆佳赟,尤忠,姜云云,宋明媚
(1.联勤保障部队第904医院 药剂科,江苏 无锡 214000;2.无锡市第五人民医院儿科,江苏 无锡 214100)
新生儿黄疸是由血清总胆红素升高引起的,临床表现为皮肤、巩膜和黏膜黄染,大多数新生儿生理性黄疸在出生后1~2周可自行消退,但也可因为免疫功能低下等生成过量胆红素积聚,导致病理性黄疸[1-2]。约60%足月和80%早产新生儿出生后第1周可出现病理性黄疸,这也是造成新生儿再次入院的常见原因之一[3-5]。蓝光与药物治疗是新生儿黄疸较常用的治疗方案,通过光疗可将体内过量胆红素变为水溶性异构体排出,但患儿会出现皮疹、腹泻等不良反应,不宜长时间治疗[6]。肝酶诱导剂苯巴比妥是临床治疗新生儿黄疸的常用药物,可通过提高未结合胆红素、葡萄糖醛酸结合功能,降低血清胆红素[7]。还原型谷胱甘肽属于肽类制剂,具有加快胆红素排出的作用[8]。还原型谷胱甘肽联合苯巴比妥应用于新生儿黄疸是否能够进一步增强临床疗效,尚鲜有报道。笔者采用临床对照研究,分析上述2种药物联合治疗新生儿黄疸的效果,以便分析其联合治疗的临床价值。
1 资料与方法
1.1 一般资料
选取2015年4月—2019年12月联勤保障部队第904医院收治的84例黄疸新生儿为研究对象,以随机数字表法分为研究组和对照组,每组42例。两组性别构成、胎龄、出生体重、身高、分娩方式构成、出生日龄、总胆红素水平比较,差异均无统计学意义(P>0.05),具有可比性(见表1)。本研究经医院伦理委员会审批,监护人均签署知情同意书。
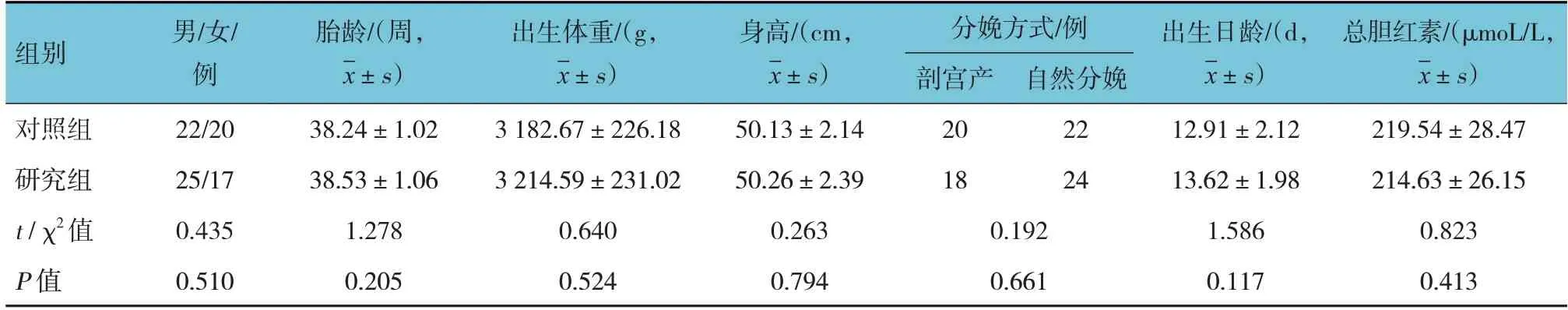
表1 两组患儿临床资料比较 (n =42)
1.2 纳入与排除标准
1.2.1 纳入标准 ①符合新生儿黄疸诊断标准[9];②单胎;③符合蓝光治疗指征。
1.2.2 排除标准 ①继发性黄疸、生理性黄疸;②伴先天性心脏病、发育缺陷、遗传综合征等先天疾病;③伴血液系统疾病、自身免疫性疾病、感染性疾病;④对本研究治疗药物过敏。
1.3 方法
两组患儿均给予常规光疗:遮蔽患儿双眼、会阴、肛门,采用蓝光温箱(型号:SYL68YXK-7,北京海富达科技有限公司)照射,波长设置为420~480 nm,每天持续照射4 h,照射3~5 d。对照组在常规治疗基础上服用苯巴比妥片(国药准字H31022038,上海信谊药厂有限公司),5 mg/(kg·次),2次/d。研究组在对照组基础上再给予还原型谷胱甘肽(国药准字H20030001,山东绿叶制药有限公司),0.6 g还原型谷胱甘肽加入100 mL 5%葡萄糖注射液中静脉滴注,1次/d。两组均持续治疗7 d观察效果。
1.4 观察指标
1.4.1 光疗及退黄时间 统计两组患儿光疗时间、皮肤退黄时间(治疗起始至黄疸临床症状消失时间)。
1.4.2 肝功能 治疗前、持续治疗7 d后采集患儿清晨空腹静脉血,用全自动生化分析仪(AU5400型,美国贝克曼奥林巴斯公司)测定丙氨酸氨基转移酶(alanine aminotransferase,ALT)、天门冬氨酸氨基转移酶(aspartate aminotransferase,AST)、总胆红素(total bilirubin,TBIL)水平。
1.4.3 临床疗效 ①痊愈:患儿治疗后黄疸等临床症状全部消退,TBIL等实验室指标恢复至正常范围;②好转:黄疸等临床症状明显好转,TBIL等实验室指标改善但未恢复至正常范围;③无效:未达到上述标准[9]。总有效率 = 痊愈率 + 好转率。
1.4.4 外周血细胞因子 治疗前后采集患儿空腹静脉血,分离收集血清,采用酶联免疫吸附试验检测转铁蛋白(Transferrin,TRF)、总胆汁酸(total bile acid,TBA)。
1.4.5 免疫功能 两组治疗前后,空腹抽取静脉血,用流式细胞仪(美国贝克曼库尔特公司,FACSCalibur型)检测全血CD4+、CD8+,计算CD4+/CD8+。
1.4.6 药物安全性 统计两组治疗期间皮疹、恶心呕吐、腹泻等不良反应发生情况。
1.5 统计学方法
数据分析采用SPSS 18.0统计软件。计量资料以均数±标准差(±s)表示,比较用t检验;计数资料以构成比或率(%)表示,比较用χ2检验。P<0.05为差异有统计学意义。
2 结果
2.1 两组光疗时间、皮肤退黄时间比较
两组光疗时间、皮肤退黄时间比较,经t检验,差异均有统计学意义(P<0.05);研究组光疗时间、皮肤退黄时间均低于对照组。见表2。
表2 两组光疗时间、皮肤退黄时间比较 (n =42,±s)
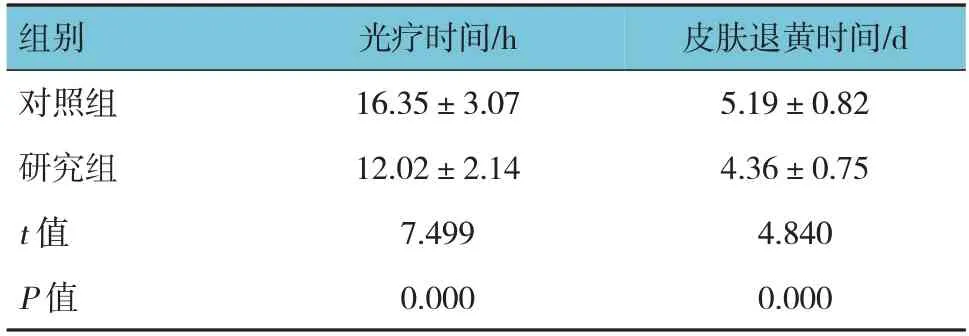
表2 两组光疗时间、皮肤退黄时间比较 (n =42,±s)
组别对照组研究组t 值P 值光疗时间/h 16.35±3.07 12.02±2.14 7.499 0.000皮肤退黄时间/d 5.19±0.82 4.36±0.75 4.840 0.000
2.2 两组肝功能指标的变化
两组治疗前后ALT、AST、TBIL的差值比较,经t检验,差异均有统计学意义(P<0.05);研究组治疗前后ALT、AST、TBIL的差值均高于对照组。见表3。
表3 两组治疗前后肝功能指标的差值比较 (n =42,±s)
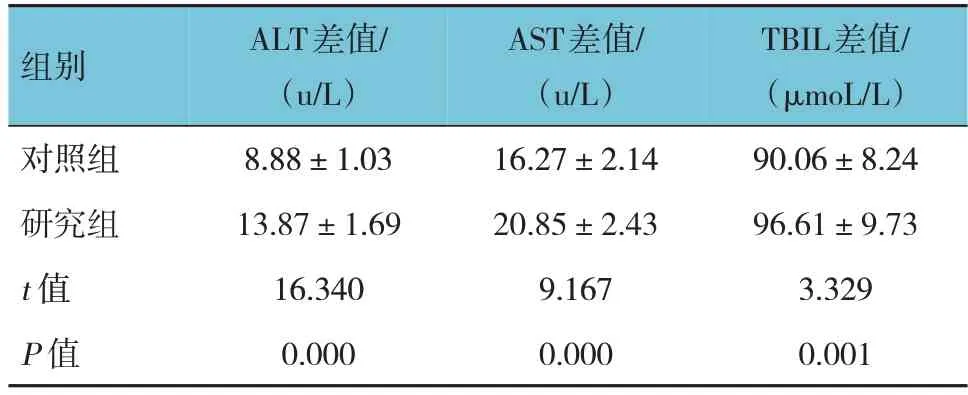
表3 两组治疗前后肝功能指标的差值比较 (n =42,±s)
组别对照组研究组t 值P 值ALT差值/(u/L)8.88±1.03 13.87±1.69 16.340 0.000 AST差值/(u/L)16.27±2.14 20.85±2.43 9.167 0.000 TBIL差值/(μmoL/L)90.06±8.24 96.61±9.73 3.329 0.001
2.3 两组临床疗效比较
两组总有效率比较,经χ2检验,差异有统计学意义(χ2=3.896,P=0.048);研究组总有效率高于对照组。见表4。
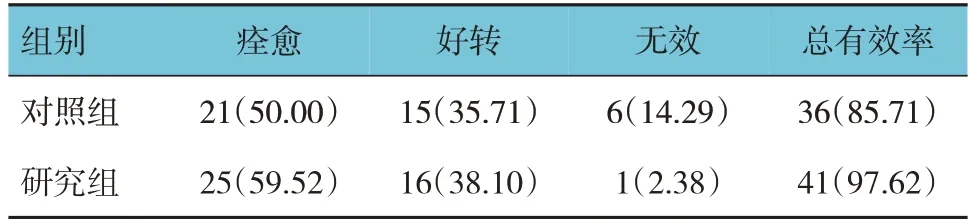
表4 两组临床疗效比较 [n =42,例(%)]
2.4 两组治疗前后外周血细胞因子的变化
两组治疗前后TRF、TBA的差值比较,经t检验,差异均有统计学意义(P<0.05);研究组治疗前后TRF、TBA的差值均高于对照组。见表5。
表5 两组治疗前后外周血细胞因子的差值比较(n =42,±s)
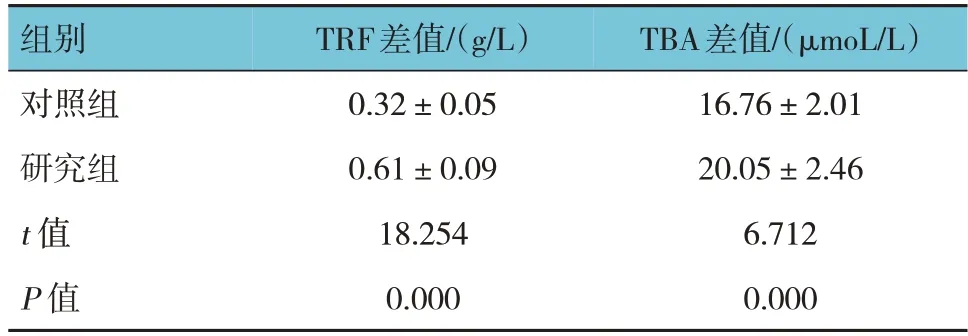
表5 两组治疗前后外周血细胞因子的差值比较(n =42,±s)
组别对照组研究组t 值P 值TRF差值/(g/L)0.32±0.05 0.61±0.09 18.254 0.000 TBA差值/(μmoL/L)16.76±2.01 20.05±2.46 6.712 0.000
2.5 两组治疗前后免疫功能指标的变化
对照组、研究组治疗前后CD4+/CD8+的差值分别为(0.16±0.03)、(0.27±0.05),经t检验,差异有统计学意义(t=12.226,P=0.000);研究组治疗前后CD4+/CD8+的差值高于对照组。
2.6 两组药物安全性比较
两组不良反应总发生率比较,经χ2检验,差异无统计学意义(χ2=0.156,P=0.693)。见表6。

表6 两组不良反应发生情况 [n =42,例(%)]
3 讨论
胆红素具有潜在神经毒性,过量胆红素可导致不可逆脑损伤[10-11]。新生儿黄疸筛查是临床常规医疗措施,严重新生儿黄疸的总体风险有所下降,但新生儿黄疸发生率仍较高[12]。目前综合治疗逐渐被临床用于治疗新生儿黄疸,本研究基于常规光疗,给予新生儿黄疸还原型谷胱甘肽、苯巴比妥,观察临床疗效,以期为临床治疗新生儿黄疸提供参考。
本研究结果显示,研究组光疗时间、皮肤退黄时间低于对照组,研究组总有效率高于对照组,提示还原型谷胱甘肽联合苯巴比妥治疗新生儿黄疸可增强治疗效果,缩短光疗时间,促进黄疸消退。苯巴比妥作为肝酶诱导剂可通过诱导更多肝细胞微粒体产生,促进葡萄糖醛酸转移酶生成,从而增加肝脏代谢胆红素的能力,降低血清胆红素水平,此外苯巴比妥也可通过促进肝细胞内Y蛋白合成及增加肝细胞膜通透性,提高肝细胞结合自由胆红素的功能;还原型谷胱甘肽为三肽类化合物,其可通过激活巯基酶将黄疸患儿体内未结合胆红素转移至微粒中,并与葡萄醛酸相互作用,促进胆红素排出;笔者推测还原型谷胱甘肽联合苯巴比妥治疗新生儿黄疸可更全面促进体内未结合胆红素排出,从而增强疗效。
本研究结果显示,研究组治疗前后ALT、AST、TBIL的差值均高于对照组,说明还原型谷胱甘肽联合苯巴比妥治疗新生儿黄疸可改善肝功能,笔者推测可能与体内未结合的胆红素排出有关。TRF主要在肝细胞内合成,可运载消化道吸收的铁、红细胞降解的铁,在新生儿黄疸等肝部疾病发生时可出现TRF降低,其表达与新生儿黄疸病情严重程度紧密相关。肝脏是胆汁酸合成的主要部位,新生儿黄疸患儿因肝细胞损伤、肝细胞膜功能及结构改变,造成胆汁合成障碍,致使外周血中TBA异常升高[13]。本研究中研究组治疗前后TRF、TBA的差值高于对照组,提示还原型谷胱甘肽联合苯巴比妥治疗新生儿黄疸可改善外周血TRF、TBA表达,笔者推测研究组TRF、TBA水平改变更明显可能与其疗效更佳有关。刘蕾[14]的研究结果显示,新生儿黄疸患儿外周血TBA异常升高。新生儿免疫体系未完全发育,免疫功能低下,免疫系统抑制炎症因子分泌、炎症因子反应、致病菌入侵功能减弱,胆红素可抑制人体单核巨噬细胞系统吞噬功能,T细胞增殖、分化功能降低,抑制细胞免疫功能。本研究结果显示,研究组治疗前后CD4+/CD8+的差值高于对照组,提示还原型谷胱甘肽联合苯巴比妥治疗新生儿黄疸可改善其免疫功能,笔者推测还原型谷胱甘肽联合苯巴比妥促进其体内胆红素代谢功能,避免因黄疸造成的单核细胞凋亡,促进T淋巴细胞要群平衡,进而改善患儿的免疫抑制作用。LI等[15]的研究结果显示,新生儿黄疸患儿免疫功能低下,治疗后可改善其免疫功能。袁立等[16]研究指出,新生儿黄疸患儿有效治疗后CD4+/CD8+明显提升。韦艳等[17]的研究结果表明,还原型谷胱甘肽可改善晚期恶性肿瘤患者免疫功能。两组治疗期间不良反应轻微,治疗方案安全可靠。
综上所述,还原型谷胱甘肽联合苯巴比妥治疗新生儿黄疸可增强疗效,缩短光疗时间,促进黄疸消退,改善肝功能、TRF、TBA及免疫应答功能,且安全性良好。本研究样本量有限,后期仍需针对不足之处开展多中心研究,并开展更多临床与基础研究以佐证本研究结论。

