雌激素联合保妇康栓治疗绝经后宫颈人乳头瘤病毒感染的临床疗效分析*
胡媛媛,周佼佼,张蓓
(无锡市第九人民医院 妇产科,江苏 无锡 214000)
宫颈癌是一种常见的女性恶性肿瘤,其病死率、发病率居高不下,流行病学调查结果显示,其发病年龄趋于年轻化,给女性的生命健康带来严重影响[1]。有研究指出,宫颈高危人乳头瘤病毒(human papilloma virus,HPV)持续感染是宫颈癌发生、发展的重要原因[2]。绝经后女性卵巢功能衰退,雌激素水平降低,出现神经功能紊乱、代谢障碍等改变,机体免疫功能逐渐衰退,增加了宫颈HPV感染风险,绝经后宫颈HPV感染若未能及时治疗,极易引发宫颈癌,给患者的生命安全带来巨大威胁[3]。因此,寻求一种安全可靠的治疗方法阻断疾病进展、清除宫颈HPV感染有重要的临床意义。
目前,临床上多采用雌激素治疗绝经后宫颈HPV感染,其可有效补充机体缺失的雌激素,有效抑制炎症反应,但单独用药作用效果有限[4]。保妇康栓为一种临床上常见的中成药,主要成分为莪术油,具有行气破瘀、生肌止痛之功。现代医学研究表明,保妇康栓具有抗细菌、抗病毒等作用[5]。大量研究证实,保妇康栓可改善宫颈HPV感染患者的临床症状,疗效确切,可提高HPV转阴率[5-6],但目前用于绝经后宫颈HPV感染的报道有限,且联合雌激素是否可增强临床疗效尚不清楚。鉴于此,本研究选取89例绝经后宫颈HPV感染患者进行治疗,现报道如下。
1 资料与方法
1.1 一般资料
选取2019年2月—2022年7月无锡市第九人民医院收治的绝经后宫颈HPV感染患者89例,按治疗方法不同分为研究组(46例)和对照组(43例)。两组患者年龄、生育次数、HPV感染类型构成、病程比较,差异均无统计学意义(P>0.05),具有可比性(见表1)。本研究经医院医学伦理委员会批准,所有患者及家属签署知情同意书。
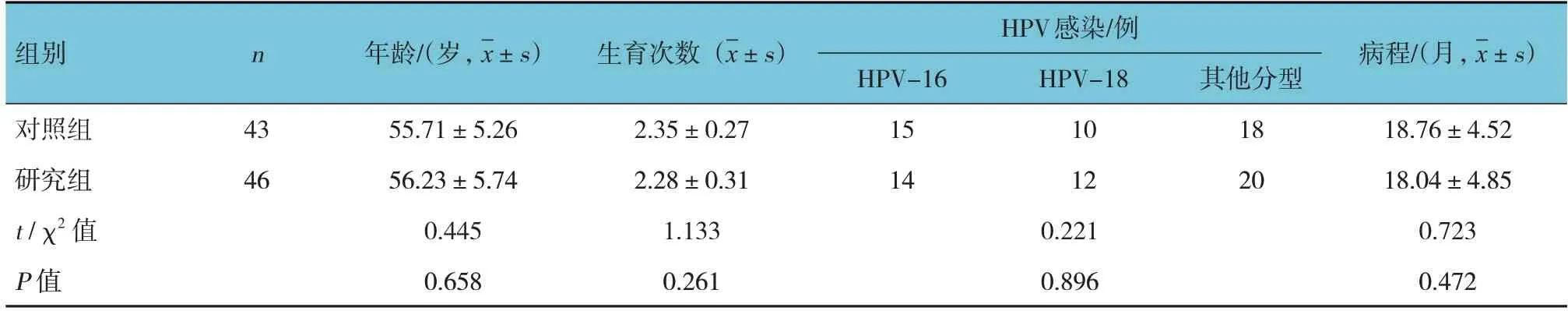
表1 两组患者临床资料比较
1.2 纳入与排除标准
1.2.1 纳入标准 ①符合宫颈HPV感染的诊断标准[7];②绝经后女性。
1.2.2 排除标准 ①合并霉菌性阴道炎、滴虫性阴道炎等其他妇科疾病;②合并恶性肿瘤;③肝、肾功能严重障碍;④凝血功能障碍;⑤对本研究治疗药物过敏;⑥哺乳或妊娠期女性。
1.3 方法
1.3.1 对照组 对照组接受雌激素治疗。患者阴道用结合雌激素乳膏(国药准字H20051718,新疆新姿源生物制药有限责任公司)0.5~2.0 g/d,将乳膏涂于外阴及阴道口周围,然后以食指和中指将剩余的乳膏均匀涂抹于阴道内壁。
1.3.2 研究组 研究组在对照组基础上接受保妇康栓治疗。睡前清洗会阴与外阴后给药,将1或2粒保妇康栓(国药准字Z46020058,海南碧凯药业有限公司,规格:1.74 g/粒)塞入阴道深处,1次/d。两组均持续治疗3个月,用药期间避免同房,饮食清淡。
1.4 观察指标
1.4.1 异常分泌物持续时间、HPV转阴时间 治疗期间每6个月复查1次,每次复查间隔时间≥6月,在不区分HPV亚型的情况下,HPV-DNA载量<1.0 pg/mL为HPV转阴[7]。记录异常分泌物持续时间、HPV转阴时间。
1.4.2 临床疗效 治疗后评估两组临床疗效。所有高危HPV亚型转阴为痊愈;≥1种高危HPV亚型转阴为有效;高危HPV亚型均未转阴为无效。总有效率=(有效+痊愈)例数/总例数×100%[7]。
1.4.3 炎症因子 治疗前后分别抽取患者4 mL空腹静脉血,3 000 r/min离心15 min,半径12 cm,分离血清,通过酶联免疫吸附试验测定白细胞介素-4(Interleukin-4,IL-4)、γ干扰素(Interferon-γ,IFNγ)、白细胞介素-2(Interleukin-2,IL-2)、肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α),试剂盒由上海江莱生物科技有限公司提供。
1.4.4 免疫功能 治疗前后分别抽取患者空腹静脉血5 mL,采用NovoCyte D1040型流式细胞仪(杭州艾森生物有限公司)测定CD3+、CD19+、CD3+CD8+、CD3-CD56+水平。
1.4.5 液基薄层细胞学检查(liquid-based cytology test,LCT)评分、宫颈炎症评分 LCT检测方法:患者取样前1 d没有性行为,取样前3 d内没有阴道冲洗。通过宫颈刷取宫颈口鳞柱交界区样本进行LCT检查。上皮细胞病变为无病变;鳞状细胞癌为重度病变;无明确意义的不典型鳞状细胞、鳞状上皮内病变、不能排除高度鳞状上皮内流变的不典型鳞状细胞为轻度病变;其余为中度病变。LCT评分[8]:按照重度、中度、轻度、无病变分别计为3、2、1、0分。宫颈柱状上皮异位评分:按照重度、中度、轻度、无宫颈柱状上皮异位分别计为3、2、1、0分。宫颈炎症评分=宫颈柱状上皮异位评分+LCT评分[6]。
1.4.6 不良反应 记录两组治疗期间瘙痒、发热、局部灼烧感等不良反应发生情况。
1.5 统计学方法
数据分析采用SPSS 25.0统计软件。计量资料以均数±标准差(±s)表示,比较用t检验;计数资料以构成比或率(%)表示,比较用χ2检验。P<0.05为差异有统计学意义。
2 结果
2.1 两组异常分泌物持续时间、HPV转阴时间比较
两组异常分泌物持续时间、HPV转阴时间比较,经t检验,差异均有统计学意义(P<0.05),研究组均短于对照组。见表2。
表2 两组异常分泌物持续时间、HPV转阴时间比较(d,±s)
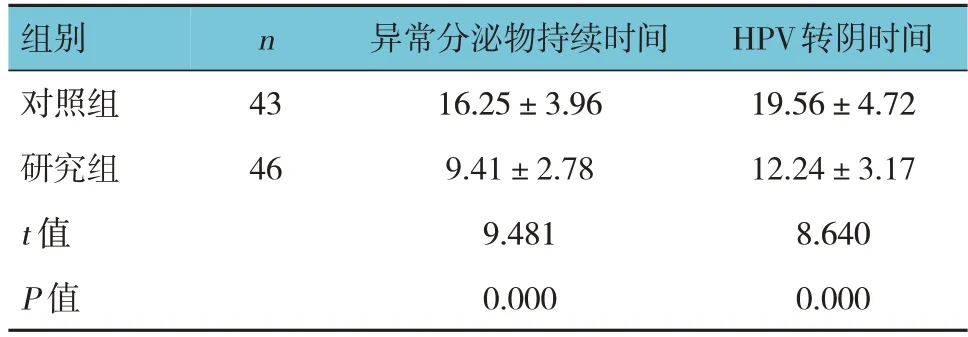
表2 两组异常分泌物持续时间、HPV转阴时间比较(d,±s)
组别对照组研究组t 值P 值n 43 46异常分泌物持续时间16.25±3.96 9.41±2.78 9.481 0.000 HPV转阴时间19.56±4.72 12.24±3.17 8.640 0.000
2.2 两组临床疗效比较
两组总有效率比较,经χ2检验,差异有统计学意义(χ2=4.990,P=0.026),研究组总有效率高于对照组。见表3。
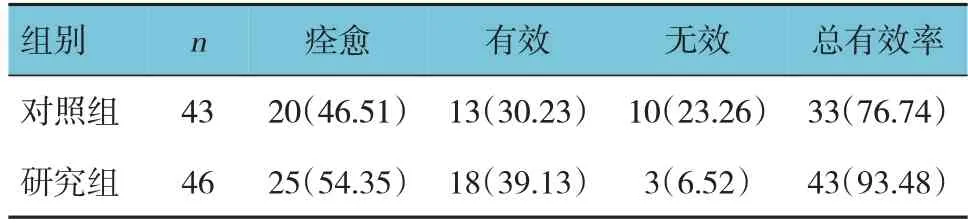
表3 两组临床疗效比较 例(%)
2.3 两组治疗前后炎症因子的变化
两组治疗前后IL-4、IFN-γ、IL-2、TNF-α的差值比较,经t检验,差异均有统计学意义(P<0.05),研究组治疗前后IL-4、IFN-γ、IL-2、TNF-α的差值均高于对照组。见表4。
表4 两组治疗前后炎症因子的差值比较 (±s)
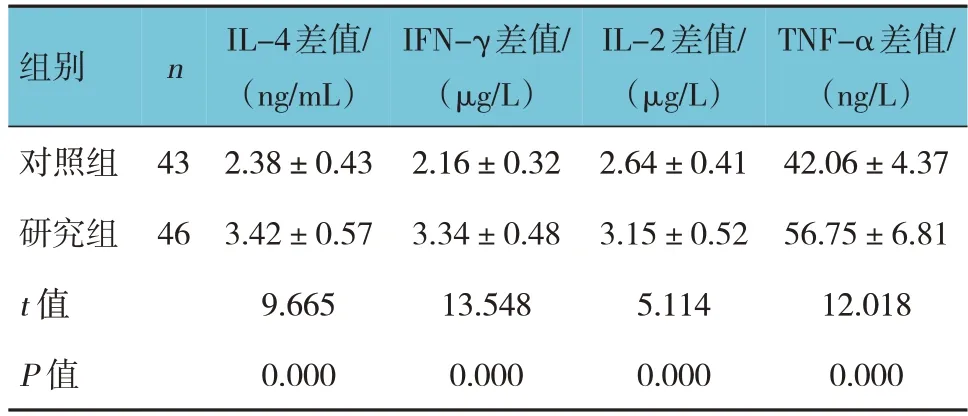
表4 两组治疗前后炎症因子的差值比较 (±s)
组别n对照组研究组t 值P 值43 46 IL-4差值/(ng/mL)2.38±0.43 3.42±0.57 9.665 0.000 IFN-γ差值/(μg/L)2.16±0.32 3.34±0.48 13.548 0.000 IL-2差值/(μg/L)2.64±0.41 3.15±0.52 5.114 0.000 TNF-α差值/(ng/L)42.06±4.37 56.75±6.81 12.018 0.000
2.4 两组治疗前后免疫功能的变化
两组治疗前后CD3+、CD19+、CD3+CD8+、CD3-CD56+的差值比较,经t检验,差异均有统计学意义(P<0.05),研究组治疗前后CD3+、CD19+、CD3+CD8+、CD3-CD56+的差值均高于对照组。见表5。
表5 两组治疗前后免疫功能的差值比较 (%,±s)
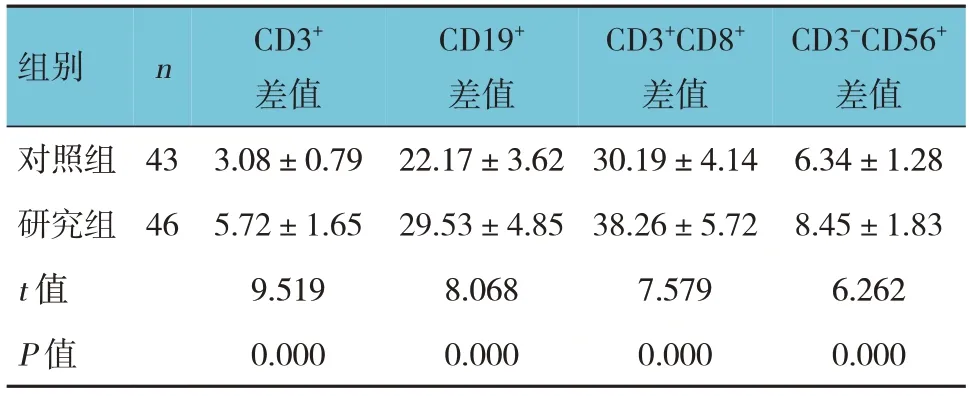
表5 两组治疗前后免疫功能的差值比较 (%,±s)
组别n对照组研究组t 值P 值43 46 CD3+差值3.08±0.79 5.72±1.65 9.519 0.000 CD19+差值22.17±3.62 29.53±4.85 8.068 0.000 CD3+CD8+差值30.19±4.14 38.26±5.72 7.579 0.000 CD3-CD56+差值6.34±1.28 8.45±1.83 6.262 0.000
2.5 两组LCT评分、宫颈炎症评分比较
两组治疗前后LCT评分、宫颈炎症评分的差值比较,经t检验,差异均有统计学意义(P<0.05),研究组治疗前后LCT评分、宫颈炎症评分的差值均高于对照组。见表6。
表6 两组LCT评分、宫颈炎症评分比较 (分,±s)
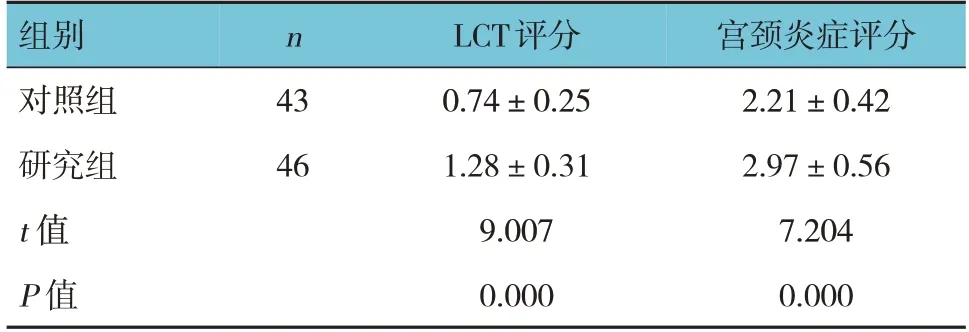
表6 两组LCT评分、宫颈炎症评分比较 (分,±s)
组别对照组研究组t 值P 值n 43 46 LCT评分0.74±0.25 1.28±0.31 9.007 0.000宫颈炎症评分2.21±0.42 2.97±0.56 7.204 0.000
2.6 两组不良反应比较
两组不良反应总发生率比较,经χ2检验,差异无统计学意义(χ2=40.718,P=0.397)。见表7。
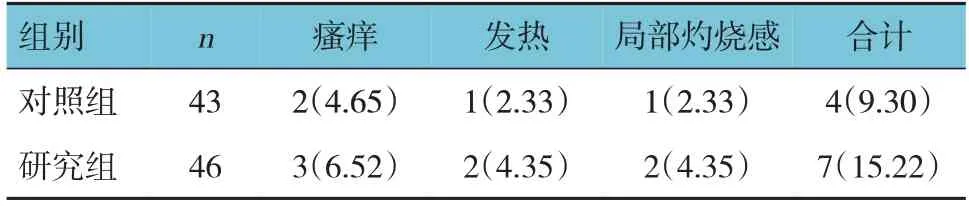
表7 两组不良反应发生率比较 例(%)
3 讨论
围绝经期女性雌激素水平明显降低,生殖系统感染风险增加。SHEN等[9]调查1 060例绝经后女性结果显示,绝经后女性高危型HPV感染风险较高。另有研究表明,绝经后HPV感染与pH值异常改变、阴道微生态失调关系密切[10]。由此可知,绝经后女性面临较高的宫颈HPV感染风险,持续宫颈HPV感染会加速低度宫颈上皮内瘤变恶化,从而增加宫颈癌的发生风险,因此采取积极的干预措施用于绝经后女性宫颈HPV感染意义重大。目前,临床上尚无特效药物治疗绝经后宫颈HPV感染,雌激素可恢复绝经后宫颈HPV感染患者机体雌激素水平,但其单独用药难以满足患者的需求[4],因此,寻求一种安全有效的药物用于辅助雌激素治疗绝经后宫颈HPV感染具有重要的临床意义。
本研究中,研究组异常分泌物持续时间、HPV转阴时间比对照组短,研究组总有效率比对照组高。分析其原因为雌激素能改善绝经后女性阴道宫颈萎缩,有助于细胞成熟与上皮细胞增生,改善机体雌激素水平,促进HPV转阴;保妇康栓可通过抑制TLRs/NF-κB通路,激活调控细胞侵袭、凋亡、增殖相关基因表达来提高HPV转阴率。既往研究指出,保妇康栓联合重组人干扰素α-2b可提高患者HPV转阴率,临床疗效确切[11],与本研究结果类似。当绝经患者宫颈HPV感染时,机体会启动一系列免疫应答来清除HPV病毒。国外有研究指出,HPV能够参与多种免疫信号通路,HPV感染在免疫反应中扮演着重要角色[12]。HPV感染造成的免疫应答主要包括体液免疫与细胞免疫,其中细胞免疫的关键成分为T淋巴细胞及其亚群组成,CD3+为成熟的T淋巴细胞,其表面的CD分子能够依照表达不同分成CD8+、CD4+淋巴细胞,CD4+为启动细胞免疫的重要分子,CD8+能够执行细胞免疫应答[13]。根据分泌的细胞因子不同,CD4+能够分成Th2、Th1,Th2型细胞因子可分泌IL-4等细胞因子,其可通过激活体内浆细胞来参与B细胞的成熟、分化与增殖,有助于生成抗体,增强体液免疫应答反应;而Th1型细胞因子可分泌TNF-α、IL-2、IFN-γ等细胞因子,Th1型细胞因子可参与细胞免疫反应[14]。相关研究指出,在正常情况下,外周血Th1/Th2比值处于动态平衡,当Th2细胞占优势时,会抑制细胞免疫,减少T细胞的抗肿瘤反应[15]。有研究指出,CD8+可通过释放颗粒酶与杀伤介质穿孔素来参与靶细胞的裂解,通过诱导靶细胞的凋亡来清除体内病原体[16]。在抗原作用下,CD19能够转化为浆细胞,分泌具有抗体特异性的免疫性球蛋白,如IgM、IgG等,从而调节体液免疫[17]。本研究中,研究组治疗前后CD19+CD3+、CD19+、CD3+CD8+、CD3-CD56+、IL-4、IFN-γ、IL-2、TNF-α的差值均比对照组高。分析其原因可能为结合雌激素乳膏对阴道有一定的抗感染作用。这是因为雌激素可以使阴道内的pH值保持在酸性,维持良好的益生菌群落,从而抑制病原菌的生长繁殖;并且雌激素还可以促使阴道黏膜上皮增生,增加黏膜厚度和黏液分泌量,提高阴道自我防御机制,减轻阴道受感染的风险。保妇康栓可有效增强吞噬细胞的吞噬能力,有助于增强局部免疫反应,不仅能全面杀灭引起宫颈感染的病原微生物,而且有助于损伤黏膜或组织的修复和更新,促进糜烂面愈合,减轻炎症反应,从而加速局部组织对HPV的清除,两者联合可发挥药物的协同作用增强疗效。既往研究指出,相比于雌激素单独作用于萎缩性阴道炎,联合保妇康栓治疗效果更佳[18],与本研究结果类似。本研究中,研究组治疗前后LCT评分与宫颈炎症评分的差值更高,可能与雌激素联合保妇康栓更有助于减轻宫颈炎症反应有关。本研究中,两组不良反应总发生率对比无差异,提示雌激素联合保妇康栓治疗绝经后宫颈HPV感染安全性良好。
综上所述,雌激素联合保妇康栓治疗绝经后宫颈HPV感染疗效确切,可加快HPV转阴,改善患者免疫功能,减轻宫颈炎症反应,且安全可靠。本研究仍存在一定不足之处,如样本量较少、单中心研究等,故研究结论可能存在一定的偏倚,后续可增加样本量进行多中心研究。

