匹多莫德辅助化疗对肺结核大鼠外周血T淋巴细胞亚群的影响及其机制探讨*
雷雪,张培源,王美玉,张红月,冯雪影
[大庆龙南医院(齐齐哈尔医学院第五附属医院) 临床药学科,黑龙江 大庆163453]
肺结核是由于机体免疫功能下降导致的一种肺部感染性疾病。我国肺结核疫情严重,且目前治疗方案疗效不佳,寻找治疗肺结核的新型有效药物至关重要[1-2]。肺结核化疗仅对结核杆菌具有一定的杀菌作用,在改善机体免疫上疗效不佳[3]。匹多莫德是一种二肽小分子,可有效改善固有免疫及获得性免疫,已有研究证实其对儿童哮喘、复发性生殖器疱疹T淋巴细胞亚群具有重要的调节作用[4-5]。但目前匹多莫德辅助化疗对肺结核的T淋巴细胞亚群影响较少,且作用机制尚不明确。本研究通过复制肺结核大鼠模型,探究匹多莫德辅助化疗对肺结核大鼠疗效及外周血T淋巴细胞亚群的影响及其作用机制。
1 材料与方法
1.1 实验动物
SPF级、SD雄性大鼠65只,8周龄,体重185~235 g,平均(210±15)g,购自北京中国食品药品检定研究院,实验动物生产许可证号:SCXK(京)2019-0017,实验动物使用许可证号:SYXK(黑)2022-013。结核分歧杆菌标准菌株(H37Rv)购自北京结核病防治所。
1.2 主要试剂与仪器
异烟肼(国药准字H44020699,广东华南药业集团有限公司,规格:0.1 g),注射液用利福霉素钠(赛瑞辰)(国药准字H20050375,江西赣南海欣药业股份有限公司,规格:0.25 g),匹多莫德片(国药准字H20010091,唐山太阳石药业有限公司,规格:0.4 g),中性多聚甲醛上海(赫澎生物科技有限公司),大鼠免疫球蛋白G(immunoglobulin G,IgG)酶联免疫试剂盒(北京索莱宝科技有限公司),CD3、CD4、CD8 FITC单克隆抗体(湖北艾美捷科技有限公司),兔抗大鼠Toll样受体4(toll like receptor 4,TLR4)、核转因子κB(nuclear factor-κB,NF-κB)、髓样细胞分化因子88(myeloid differentiation factor 88,MyD88)单克隆抗体及山羊抗兔TLR4、MyD88、NF-κB二抗(湖北艾美捷科技有限公司)。
高速冷冻离心机(型号:Neofuge13,武汉益普生物科技有限公司),全光谱流式细胞仪(型号:Northern Lights,美国Cytek Biosciences公司),全自动生化分析仪(型号:PUZS-300,上海帝博思生物科技有限公司),石蜡切片机(型号:HS-3315,北京巴古顿生物科技有限公司),伯乐同用电泳仪(型号:XY-11014,上海信裕生物科技有限公司)。
1.3 方法
1.3.1 大鼠模型复制及分组 随机选取15只大鼠为对照组,其余大鼠复制肺结核模型。将H37Rv菌株培养20 d后,取部分菌落,加生理盐水(含5%吐温80)制成1×107cfu/mL菌悬液,取0.4 mL菌悬液,对大鼠进行尾静脉注射。约1个月后,大鼠出现皮毛颜色暗淡、稀疏凌乱,食欲不振,体重下降,活动明显减少,嗜睡,即大鼠肺结核模型复制成功[6]。其中5只大鼠模型复制过程中死亡,其余大鼠随机分为模型组、化疗组和联合治疗组,每组15只。
1.3.2 药物处理 模型复制成功后,根据人与大鼠的体重及给药剂量换算公式[7],化疗组给予异烟肼50 mg/(kg·d),利福霉素钠50 mg/(kg·d),均腹腔注射。联合治疗组给予异烟肼50 mg/(kg·d),利福霉素SV钠50 mg/(kg·d),匹多莫德200 mg/(kg·d),均腹腔注射[8]。对照组与模型组给予等量的生理盐水。均连续治疗8周。
1.3.3 流式细胞术检测外周血T淋巴细胞亚群 治疗8周后,采集大鼠眼眶静脉血2 mL,加入肝素抗凝剂及红细胞裂解液,混匀后加入1 mL缓冲液,2 000 r/min离心10 min,去除上清液再加入缓冲液0.1 mL,冲洗2次后分别加入CD3+、CD4+及CD8+T淋巴细胞单抗各1 μL,混匀后孵育30 min,采用流式细胞仪进行检测,记录细胞阳性染色百分比[9]。
1.3.4 大鼠胸腺指数和血清IgG水平 治疗8周后,采集大鼠眼眶静脉血2 mL,离心后取上清液,采用IgG酶联免疫试剂盒,按照说明书进行操作,梯度稀释标准品100 μL,加入50 μL上清液后混匀,依次加入酶标记物,显色剂A、B进行显色及终止液终止反应后,采用全自动生化分析仪检测血清IgG水平。采集血液后,对所有大鼠进行称重,并记录其体重。称重后所有大鼠腹腔注射2%戊巴比妥钠麻醉处理,每组取4只大鼠处死,取胸腺,采用滤纸擦干胸腺表面水分,采用电子天平进行称重,根据公式计算胸腺指数(胸腺指数=胸腺质量/体重)[10]。
1.3.5 大鼠肺组织病理学变化 取出4只大鼠胸腺后,立即取出其肺组织,清洗后置于4%中性多聚甲醛固定,使肺组织蛋白质凝固,采用酒精脱去肺组织中的水分,再溶于二甲苯中进行透明处理,将透明后的肺组织于溶化的石蜡中包埋,冷却后用石蜡切片机切成厚度为4 μm的切片,脱蜡后进行苏木精-伊红(hematoxylin eosin,HE)染色,于光镜下观察肺组织病理学变化[11]。
1.3.6 Western blotting检测脾脏TLR4、MyD88、NF-kB蛋白的表达 另取5只大鼠,处死后取出肺组织,液氮中冷冻。取100 mg冷冻肺组织,研磨成匀浆后加入细胞裂解液,对肺组织细胞进行裂解,测定肺组织蛋白浓度,在蛋白样品中加入上样缓冲液,进行电泳,分离TLR4、MyD88、NF-κB蛋白,转膜后洗去转膜液,室温封闭60 min,分别加入TLR4、MyD88、NF-κB及内参一抗、二抗,孵育后进行显影、定影,洗片后计算TLR4、MyD88、NF-κB蛋白相对表达量。蛋白相对表达量=目的蛋白光密度值/β-Actin光密度值[12]。
1.4 统计学方法
数据分析采用SPSS 22.0统计软件,计量资料以均数±标准差(±s)表示,比较用方差分析,两两比较用LSD-t检验。P<0.05为差异有统计学意义。
2 结果
2.1 各组大鼠外周血T淋巴细胞亚群变化
对照组、模型组、化疗组、联合治疗组CD3+、CD4+、CD8+比较,经方差分析,差异有统计学意义(P<0.05)。与对照组比较,模型组、化疗组CD3+、CD4+降低,CD8+升高(P<0.05);与模型组比较,化疗组及联合治疗组CD3+、CD4+升高,CD8+降低(P<0.05);与化疗组比较,联合治疗组CD3+、CD4+升高,CD8+降低(P<0.05)。见表1。
表1 各组大鼠外周血T淋巴细胞亚群变化 (n =15,%,±s)
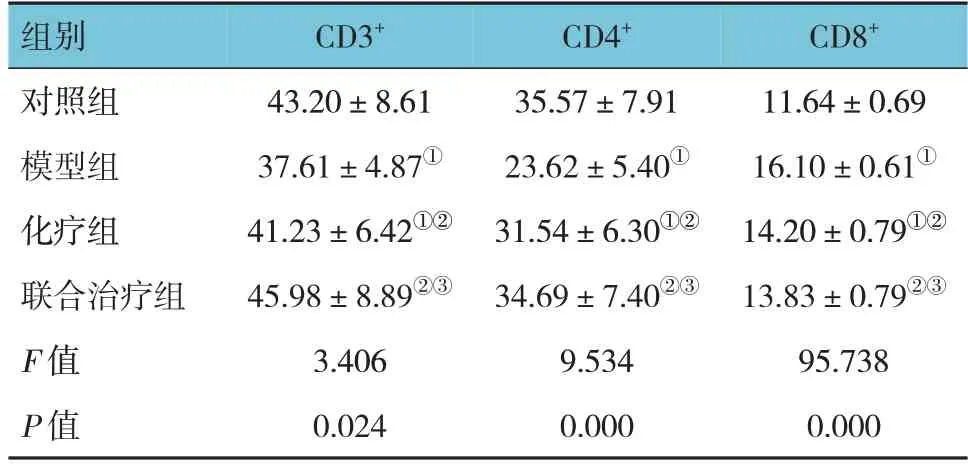
表1 各组大鼠外周血T淋巴细胞亚群变化 (n =15,%,±s)
注:①与对照组比较,P <0.05;②与模型组比较,P <0.05;③与化疗组比较,P <0.05。
CD8+11.64±0.69 16.10±0.61①14.20±0.79①②13.83±0.79②③95.738 0.000组别对照组模型组化疗组联合治疗组F 值P 值CD3+43.20±8.61 37.61±4.87①41.23±6.42①②45.98±8.89②③3.406 0.024 CD4+35.57±7.91 23.62±5.40①31.54±6.30①②34.69±7.40②③9.534 0.000
2.2 各组大鼠胸腺指数和血清IgG水平比较
对照组、模型组、化疗组、联合治疗组胸腺指数和IgG水平比较,经方差分析,差异均有统计学意义(P<0.05)。与对照组比较,模型组,化疗组胸腺指数和IgG水平均降低(P<0.05);与模型组比较,化疗组及联合治疗组胸腺指数和IgG水平均升高(P<0.05);与化疗组比较,联合治疗组胸腺指数和IgG水平升高(P<0.05)。见表2。
表2 各组大鼠胸腺指数和血清IgG水平比较 (n =15,±s)
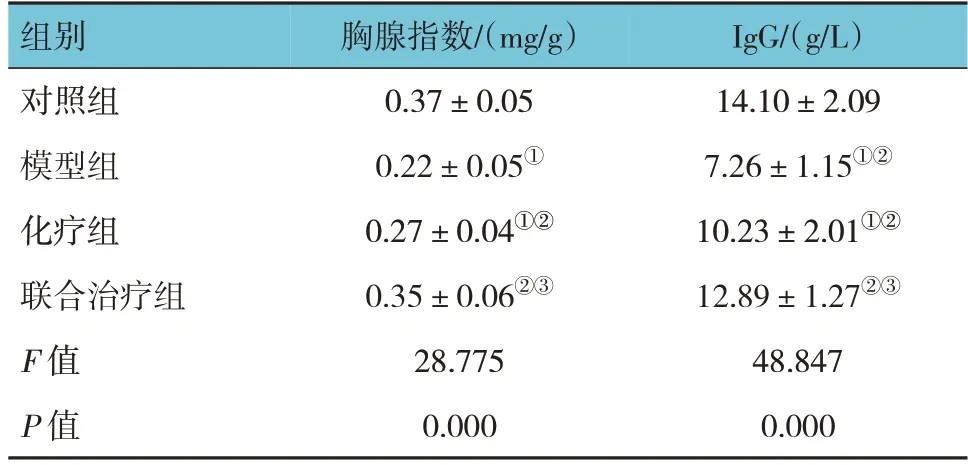
表2 各组大鼠胸腺指数和血清IgG水平比较 (n =15,±s)
注:①与对照组比较,P <0.05;②与模型组比较,P <0.05;③与化疗组比较,P <0.05。
IgG/(g/L)14.10±2.09 7.26±1.15①②10.23±2.01①②12.89±1.27②③48.847 0.000组别对照组模型组化疗组联合治疗组F 值P 值胸腺指数/(mg/g)0.37±0.05 0.22±0.05①0.27±0.04①②0.35±0.06②③28.775 0.000
2.3 各组大鼠肺组织的病理检测结果
对照组肺组织形态完整,肺泡清晰可见,无明显病理变化;模型组肺组织出现坏死、渗出,可见纤维组织增生及炎症细胞浸润;化疗组肺组织局部可见坏死、渗出,纤维组织增生及炎症细胞浸润减少;联合治疗组肺组织形态基本完整,仅少量纤维组织增生及炎症细胞浸润,肺组织坏死、渗出基本改善。见图1。
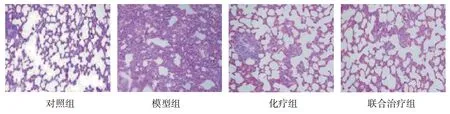
图1 各组大鼠肺组织病理切片 (HE染色×100)
2.4 各组大鼠肺组织TLR4、MyD88、NF-κB蛋白相对表达量比较
对照组、模型组、化疗组、联合治疗组肺组织TLR4、MyD88、NF-κB蛋白相对表达量比较,经方差分析,差异均有统计学意义(P<0.05)。与对照组比较,模型组、化疗组TLR4、MyD88、NF-κB蛋白相对表达量均升高(P<0.05);与模型组比较,化疗组和联合治疗组TLR4、MyD88、NF-κB蛋白相对表达量均降低(P<0.05);与化疗组比较,联合治疗组TLR4、MyD88、NF-κB蛋白相对表达量均降低(P<0.05)。见表3和图2。
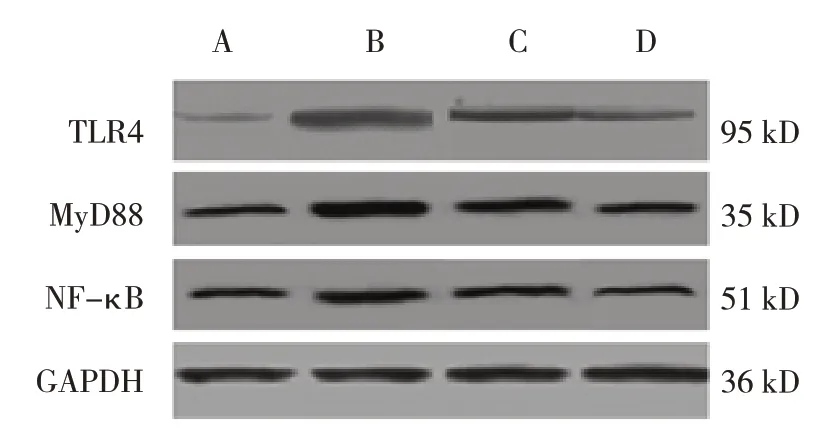
图2 各组大鼠肺组织TLR4、MyD88、NF-κB蛋白表达
表3 各组大鼠肺组织TLR4、MyD88、NF-κB蛋白相对表达量比较 (n =5,±s)

表3 各组大鼠肺组织TLR4、MyD88、NF-κB蛋白相对表达量比较 (n =5,±s)
注:①与对照组比较,P <0.05;②与模型组比较,P <0.05;③与化疗组比较,P <0.05。
NF-κB 0.28±0.06 1.25±0.24①0.69±0.17①②0.35±0.08②③121.922 0.000组别对照组模型组化疗组联合治疗组F 值P 值MyD88 0.59±0.12 1.46±0.21①0.93±0.18①②0.53±0.09②③110.197 0.000 TLR4 0.32±0.10 1.72±0.35①0.84±0.16①②0.47±0.18②③124.060 0.000
3 讨论
肺结核一般发生于免疫力低下时,发病机制较复杂,涉及结核分枝杆菌的感染、复活和存活,免疫反应和炎症反应等多个环节[13]。临床上一般采用抗结核杆菌药物进行治疗,但疗效欠佳[14]。T淋巴细胞是免疫系统的重要组成部分,可通过分泌细胞因子和表达受体来调节免疫应答,在肺结核感染后,特别是在原发性感染时,T淋巴细胞参与对抗结核分枝杆菌的免疫应答的调节,激活巨噬细胞和其他免疫细胞,促进免疫反应形成[15-16]。因此,探究可有效改善T淋巴细胞亚群的方式对提高肺结核疗效具有重要意义。
胸腺是机体的免疫器官及T淋巴细胞分化成熟的部位,胸腺指数可直接反映机体的免疫能力[17]。本研究中肺结核大鼠外周血T细胞亚群及肺组织病理结果显示,模型组能够降低胸腺指数及CD3+、CD4+,提高CD8+,同时大鼠肺组织出现坏死、渗出、纤维组织增生及炎症细胞浸润等现象,表明机体免疫功能下降,肺组织损伤。经过化疗或匹多莫德辅助化疗后,胸腺指数及CD3+、CD4+升高,CD8+下降,免疫反应增强,肺组织病理明显改善。匹多莫德作为一种免疫调节剂,可调节Th1和Th2免疫应答平衡,促进细胞免疫应答(增加免疫调节细胞如调节性T细胞的数量和功能,有助于调节T淋巴细胞的活性;促进干扰素γ、白细胞介素-2生成,促进T细胞的活化和功能增强)。此外,匹多莫德还有抗氧化和抗炎作用,可减轻炎症反应并保护免疫细胞免受氧化应激损害,有助于维持T淋巴细胞的正常功能和活性[18-19]。张辉等[20]研究认为,匹多莫德可有效调节病毒感染相关性疾病CD4+、CD8+T淋巴细胞及两者比值,从而改善疗效。
本研究结果显示,治疗后模型组TLR4、MyD88、NF-κB蛋白相对表达量升高,而化疗组与联合治疗组降低,表明肺结核能够激活TLR/NF-κB通路,化疗及联合化疗均能抑制该通路。有研究发现,TLR/NF-κB信号通路在结核分歧杆菌感染中发挥重要作用[12]。结核分歧杆菌通过其表面的抗原与宿主TLR相互作用激活下游信号转导NF-κB信号通路。NF-κB是一种重要的转录因子,在调控多种炎症反应和免疫反应中发挥关键作用。在肺结核中,TLR激活可促使NFκB进入细胞核并结合到靶基因的启动子区域,从而引发炎症因子和免疫调节因子的启动。匹多莫德能够通过优化Th1/Th2免疫功能,抑制TLR/NF-κB通路,缓解炎症反应,部分炎症因子会引发机体固有免疫反应,促进细胞免疫应答,并将固有免疫逐步转化为获得性免疫反应,从而发挥更好的治疗效果。
综上所述,匹多莫德辅助化疗可改善肺结核大鼠外周血T淋巴细胞亚群,增强免疫功能,其作用机制可能与抑制TLR/NF-κB信号通路有关。本研究仍存在一定不足,如尽管人类与大鼠存在诸多相似之处,但仍面临着许多重要的生物学差异。通过动物实验获得的结果未必能直接适用于人类,可能会导致转化医学的困境,即难以将动物实验结果推广到人类疾病的治疗上。因此,今后研究中应鼓励和支持使用替代方法,如体外细胞模型、计算模拟和人体志愿者研究等,以提高研究结果的可靠性和可转化性。

