二甲双胍通过COX-2/PGE2/STAT3途径抑制结直肠癌的机制研究*
穆刘凡,黄煌,郑鹏远,米阳,刘思濛,梅璐,荣康,南梦娇
(郑州大学第五附属医院 消化内科,河南 郑州 450052)
根据世界卫生组织2020年公布的数据,在世界范围内结直肠癌在所有恶性肿瘤中发病率排第3位,而病死率排第2位[1]。2020年结直肠癌在我国所有恶性肿瘤中的发病率排第3位(0.239‰),病死率排第5位(0.12‰)[2]。目前临床对结直肠癌采用以手术为主的综合治疗,包括化学治疗、放射治疗、靶向治疗、免疫治疗等,但其术后转移率仍较高。在大多数情况下,转移性结直肠癌仍是一种无法治愈的疾病。也是导致患者死亡的常见原因[3]。既往研究发现,环氧化酶-2(Cyclooxygenase-2,COX-2)的过表达与结直肠癌发生相关[4]。前列腺素E2(prostaglandin E2,PGE2)是COX-2的主要下游催化产物,在结直肠癌中也发挥着关键作用,其通过刺激前列腺素E2受体信号传导,促进肿瘤细胞增殖,抑制细胞凋亡,促进血管生成[5]。目前已证明在前列腺癌、肺癌和胆管癌中,活化的COX-2/PGE2和转录激活因子3(signal transducer and activator of transcription 3,STAT3)信号传导途径之间存在紧密关系[6-8]。近年来有学者发现,用于治疗2型糖尿病的经典口服药物二甲双胍(Metformin)具有降低恶性肿瘤发病率及改善恶性肿瘤患者生存预后的作用[9]。研究表明,二甲双胍能够通过抑制COX2/PGE2/STAT3途径来抑制前列腺癌细胞上皮间质转换(epithelial-mesenchymal transition,EMT)[10];通过激活AMP活化蛋白激酶(AMP-activated protein kinase,AMPK)来抑制COX-2的产生,并抑制乳腺癌细胞的增殖[11];通过COX2/PGE2/STAT3途径抑制癌症干细胞再繁殖,从而抑制膀胱癌的进展[12]。综上所述,结直肠癌疾病负担较重,是当前肿瘤领域的研究热点。本研究旨在探索二甲双胍是否可以通过COX-2/PGE2/STAT3途径抑制结直肠癌的发生、发展。
1 材料与方法
1.1 实验细胞、动物及主要试剂
人结肠癌细胞SW480和小鼠结肠癌细胞MC38购自中国科学院典型培养物宝藏委员会细胞库;28只7周龄无特定病原体级雄性C57BL/6N小鼠,购自北京维通利华实验动物技术有限公司[实验动物生产许可证号:SCXK(浙)2019-0001,实验动物使用许可证号:SYXK(豫)2020-0008]。在恒压、恒温、恒湿条件下喂养,每日光照12 h,使用辐照灭菌维持饲料(江苏省协同医药生物工程有限公司)喂养。动物研究方案已得到郑州大学第五附属医院动物伦理委员会批准同意(伦理编号:KY2022046)。
CCK-8试剂盒(广州Biosharp公司,批号:BS350C),凋亡试剂盒(江苏凯基生物技术股份有限公司,编号:KGA108),二甲双胍(上海麦克林生化科技有限公司,编号:M813341),氧化偶氮甲烷(Azoxymethane,AOM)(美国Sigma公司,批号:A5486),葡聚糖硫酸钠(dextran sulfate sodium salt,DSS)(美国MP Biomedicals公司,编号:02160110-CF)。COX-2一抗(英国Abcam公司,批号:ab179800),磷酸化转录激活因子3一抗(p-signal transducer and activator of transcription 3,p-STAT3)(英国Abcam公司,编号:ab76315),STAT3一抗(英国Abcam公司,批号:ab68153),酶联免疫吸附试验(enzyme linked immunosorbent assay,ELISA)试剂盒(武汉Elabscience公司,批号:E-IR-R212),中国上海博谷生物科技有限公司,批号:HEP016)。
1.2 方法
1.2.1 细胞培养 MC38细胞在含有10%胎牛血清、100 μL/mL链霉素、100 μL/mL青霉素的1640培养基中培养;SW480细胞在含有10%胎牛血清、100 μL/mL链霉素、100 μL/mL青霉素的DMEM培养基中培养。两种结直肠癌细胞均在37 ℃、5%二氧化碳和高湿度的培养箱中生长。将含有细胞的培养皿放置在显微镜样品台上,使培养皿位于镜头下方。调节焦螺旋,使视野清晰度达到最佳,通过显微镜观察细胞。
1.2.2 CCK-8法检测细胞活力 将两种结直肠癌细胞(5×103个/孔)分别接种到96孔板上,加入100 μL培养基,贴壁后,用不同浓度(0、5、10、20、30和40 mmol/L)的二甲双胍处理24 h,使用CCK-8试剂盒检测细胞活力。即将CCK-8试剂加入细胞,并孵育2 h,在450 nm波长处测定光密度值(optical density,OD)。细胞活力=(ODn-OD0)/(ODc-OD0)×100%(OD0:空白;ODc:未处理对照;ODn:二甲双胍处理)。
1.2.3 流式细胞术检测细胞凋亡 将两种结直肠癌细胞(2×105个/孔)分别接种到6孔板上,用20 mmol/L二甲双胍处理48 h,收集细胞培养基中的细胞,使用不含EDTA的胰酶消化细胞,收集细胞。用磷酸盐缓冲液洗涤细胞2次,以2 000 r/min离心5 min,加入500 μL的Binding Buffer、5 μL Annexin V-FITC、5 μL Propidium Iodide,混匀,避光孵育10 min,用流式细胞分析仪(美国BD公司)对染色细胞进行分析,计数细胞凋亡比例。
1.3 模型复制
1.3.1 动物实验分组 采用完全随机法将小鼠分为生理盐水对照组(NaCl组)、造模组(AOM + DSS组)、治疗组(AOM + DSS + Met组)、二甲双胍对照组(Met组),分别有6、8、8和6只。
1.3.2 复制结直肠癌小鼠模型 小鼠适应性喂养1周后,于第9周单次腹膜内注射AOM(10 mg/kg);第10周,动物饮用水中加入2% DSS,持续5 d;第11、12周正常饮用水;第13周动物饮用水中加入2% DSS,持续5 d;第14、15周正常饮用水;第16周动物饮用水中加入2% DSS;第17、18周正常饮用水;第19周处死小鼠[13]。
1.3.3 干预措施 在第10周进行药物干预。NaCl组、AOM + DSS组均用0.9% NaCl溶液300 μL/(d·只)灌胃处理,AOM + DSS + Met组、Met组均用二甲双胍250 mg/(kg·d·只)灌胃处理,具体干预措施见图1。干预期间小鼠保持基础饮食。第19周,小鼠空腹12 h后,以4%水合氯醛400 mg/kg腹腔麻醉后,眼球取血,处死小鼠,分离结肠组织,进行下一步研究。
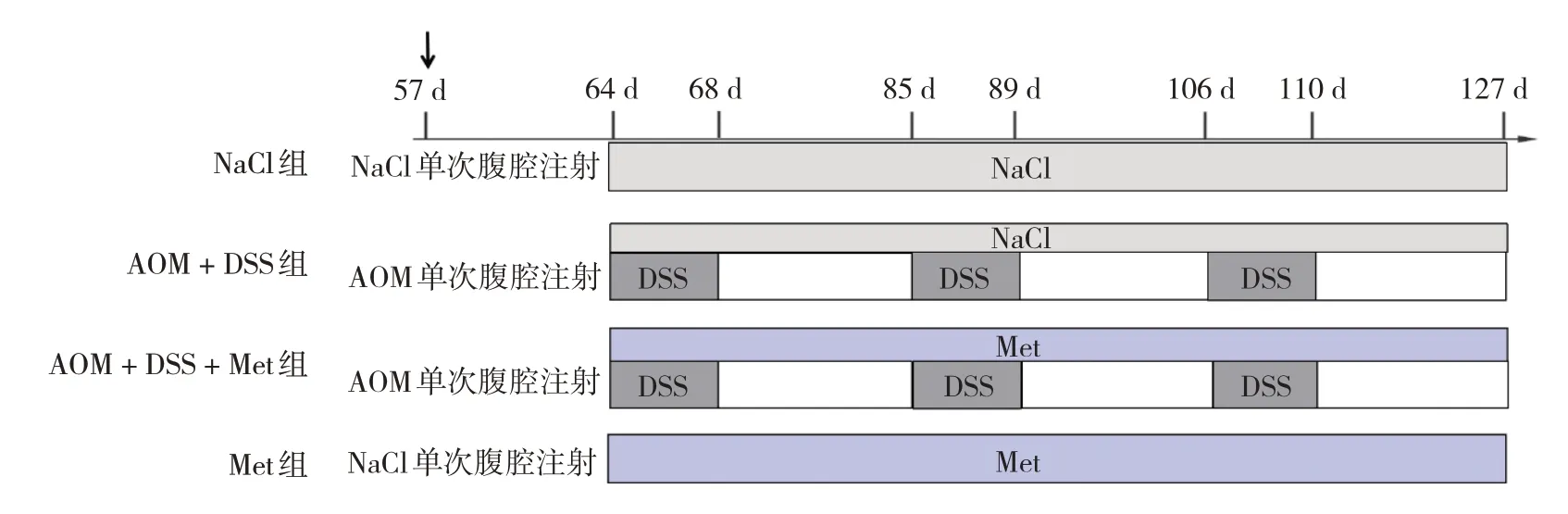
图1 小鼠模型复制及处理
1.4 二甲双胍活性成分-靶点分子对接
为观察二甲双胍进入机体后能否与机体的COX-2靶蛋白结合进而发挥药效。笔者以“Metformin”为检索词在PubChem数据库中搜索二甲双胍的分子结构,下载SDF格式的3D Structures,通过RCSB PDB数据库筛选COX-2的最佳蛋白结构,并下载PDB格式文件。借助PyMOL对核心基因蛋白结构进行除水、去配体等操作,通过OpenBabel将二甲双胍的SDF格式转换为mol2格式。运行AutoDockTools 1.5.6软件进行分子对接,搜集结合能分值,最后利用PyMOL进行可视化分析。
1.5 苏木精-伊红染色观察细胞形态
苏木精-伊红(hematoxylin-eosin staining,HE)染色操作如下。截取部分结肠组织,甲醛固定,石蜡包埋,切片。组织切片分别放于二甲苯、无水乙醇中脱蜡、脱苯。从蒸馏水中取出后,放入苏木精溶液中染色10~30 min;将切片放入1%的盐酸酒精数秒至切片变红即可,流水冲洗使切片返蓝;再次脱水处理;用0.5%伊红乙醇溶液染色2~5 min;切片脱水透明。将切片从二甲苯拿出来稍晾干,中性树胶封片,做好标记便于后续观察。
1.6 免疫组织化学染色观察结肠组织病理变化
截取部分结肠组织,用福尔马林固定,石蜡包埋,切片。组织切片分别放于二甲苯、无水乙醇中脱蜡、脱苯;加入柠檬酸钠抗原修复15 min。用3%过氧化氢去离子水和山羊血清依次封闭15 min,兔COX-2一抗(1∶500)4 ℃温育过夜。次日洗去一抗,采用50 μL生物素化二抗和辣根酶标记链霉卵白素依次温育20 min,二氨基联苯胺染色2 min,苏木精复染细胞核1 min,脱水、透明、中性树胶封片。空白对照组使用抗体稀释液温育,其余处理相同。
1.7 Western blotting检测COX-2、STAT3、p-STAT3蛋白表达
按照试剂盒说明书的方法制备电泳凝胶,电泳按照110 V、90 min一步法进行,结束后取出凝胶,制作转膜三明治结构,按300 mA、90 min恒流电转。取出硝酸纤维素膜,置于含5%脱脂奶粉封闭液中封闭1 h,分别加入鼠GAPDH抗体(1∶10 000)、兔COX-2抗体(1∶4 000)、兔p-STAT3抗体(1∶10 000)、兔STAT3抗体(1∶1 500),4 ℃温育过夜。次日回收一抗,充分清洗后二抗室温孵育1 h,结束后充分清洗,曝光仪(美国Bio-RAD公司)曝光拍照分析。
1.8 酶联免疫吸附试验检测PGE2表达
采用酶联免疫吸附试验(enzyme linked immunosorbent assay,ELISA)检测细胞上清液以及动物血清中的PGE2表达。细胞:将两种结直肠癌细胞(2×105细胞/孔)分别接种到6孔板上,用20 mmol/L二甲双胍处理24 h,收集培养基,离心取上清。动物:收集动物眼球血,离心后收取上清液。
1.9 粪便16S rDNA测序
送检前在超净工作台内将粪便样本整合,每个样本3~5粒粪便,每组样本分别放入密封袋内,置于干冰,避免污染,同时标记样本类型、组别和编号,送至上海美吉生物医药科技有限公司,进行16S rDNA测序。
1.10 统计学方法
数据分析采用SPSS 26.0统计软件,作图使用GraphPad Prism 8.0和Adobe Photoshop软件。计量资料以均数±标准差(±s)或中位数和四分位数间距M(P25,P75)表示,比较用单因素方差分析、t检验或Kruskal-Wallis检验,两两比较用LSD-t检验或Wilcoxon检验。P<0.05为差异有统计学意义。
2 结果
2.1 二甲双胍与COX-2蛋白核心成分有较好的结合活性
使用AutoDockTools 1.5.6软件,将二甲双胍与COX-2蛋白核心成分进行分子对接,判断二甲双胍进入机体后能否与COX-2蛋白核心成分稳定结合。软件的分子对接结果是以能量的高低来判断二甲双胍与靶蛋白结合程度。获得的连接能量为-5.44 kJ/moL。一般认为连接能量< -5 kJ/moL表示化合物与靶点之间结合活性较好。分子对接结果表明二甲双胍与COX-2蛋白核心靶点之间结合活性较好。见图2。
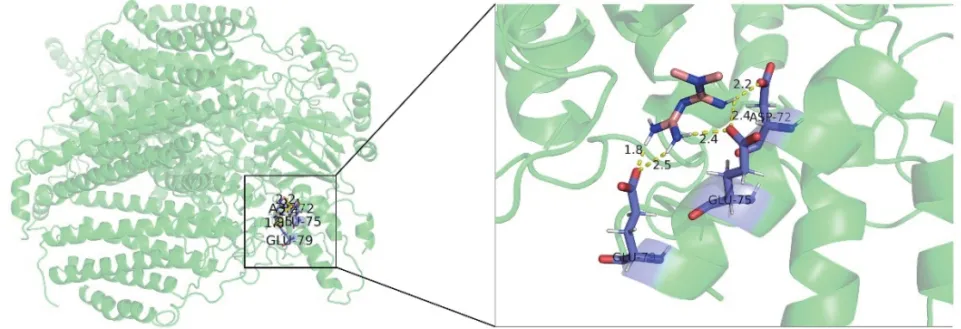
图2 成分-靶点对接相互作用模式图
2.2 二甲双胍可抑制结肠癌细胞增殖并促进其凋亡
使用不同浓度的二甲双胍分别处理MC38细胞和SW480细胞24 h,在显微镜下观察细胞形态变化。可以看到,随着二甲双胍浓度的增加,肿瘤细胞数量明显减少。见图3。
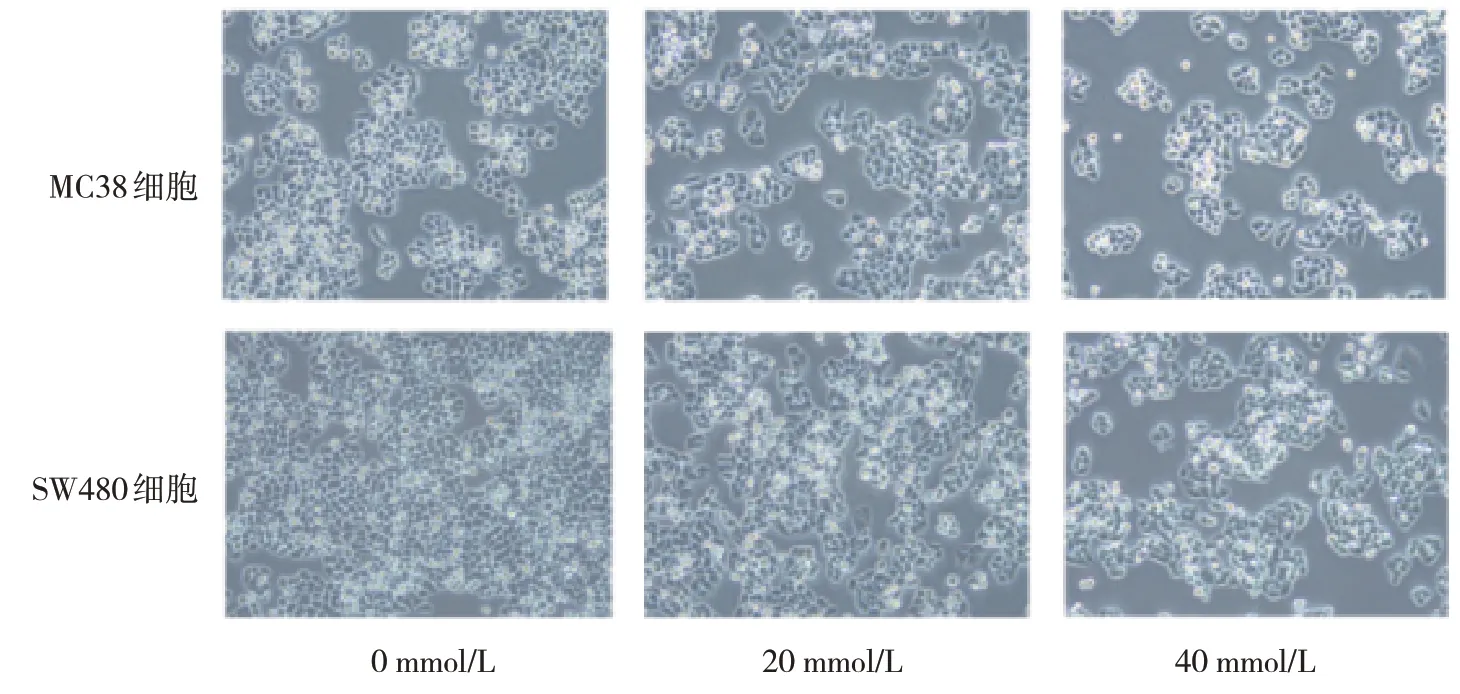
图3 MC38、SW480细胞添加不同浓度二甲双胍后的形态 (×40)
CCK-8法结果表明,随着二甲双胍浓度的增加,2种结直肠癌细胞活性率受到抑制(见表1)。随后,笔者又检测了二甲双胍对结直肠癌细胞凋亡情况的影响,MC38细胞加入0、20 mmol/L二甲双胍的细胞凋亡率分别为(4.13±0.26)%、(12.59±0.65)%,SW480细胞分别为(5.31±2.13)%、(32.76±7.26)%。2种结直肠癌细胞细胞凋亡率比较,差异均有统计学意义(t=-36.197和-10.883,均P=0.000),加入20 mmol/L二甲双胍后结直肠癌细胞的凋亡率明显增加。见表1。
表1 两种结直肠癌细胞不同浓度二甲双胍影响下细胞活性率比较 (%,±s)
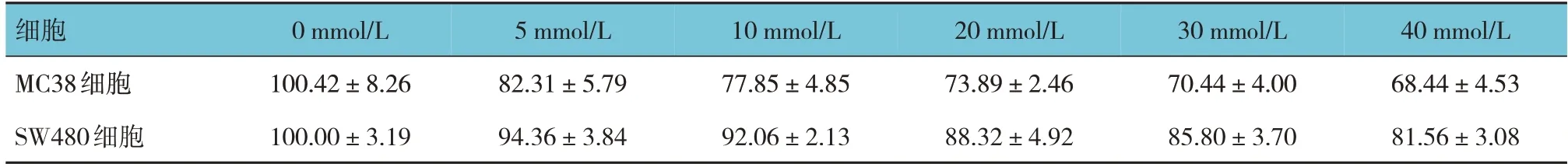
表1 两种结直肠癌细胞不同浓度二甲双胍影响下细胞活性率比较 (%,±s)
细胞MC38细胞SW480细胞0 mmol/L 100.42±8.26 100.00±3.19 5 mmol/L 82.31±5.79 94.36±3.84 10 mmol/L 77.85±4.85 92.06±2.13 20 mmol/L 73.89±2.46 88.32±4.92 30 mmol/L 70.44±4.00 85.80±3.70 40 mmol/L 68.44±4.53 81.56±3.08
2.3 二甲双胍可在体外通过COX2/PGE2/STAT3途径抑制结直肠癌细胞增殖并促进其凋亡
0、5、10、20 mmol/L二甲双胍处理MC38细胞后COX-2蛋白相对表达量分别为(0.89±0.19)、(0.59±0.38)、(0.36±0.18)、(0.17±0.04),0、5、10、20 mmol/L二甲双胍处理SW480细胞后COX-2蛋白相对表达量分别为(1.01±0.16)、(0.83±0.18)、(0.53±0.14)、(0.44±0.24)。不同浓度二甲双胍处理MC38、SW480细胞后COX-2蛋白相对表达量比较,差异有统计学意义(F=5.460、6.574,P=0.024、0.015)。二甲双胍干预可抑制COX-2蛋白的表达,且随着浓度的增加,COX-2蛋白表达呈药物剂量依赖性减低。见图4。
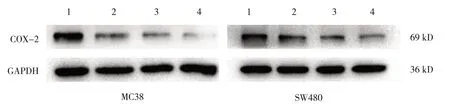
图4 MC38、SW480细胞添加不同浓度二甲双胍后COX-2蛋白的表达情况
0、20 mmol/L二甲双胍处理MC38细胞后PGE2水平分别为(7.40±0.14)、(6.16±0.07)pg/mL,0、20 mmol/L二甲双胍处理SW480细胞后PGE2水平分别为(7.91±0.36)、(3.82±0.10)pg/mL。不同浓度二甲双胍处理MC38、SW480细胞后PGE2水平比较,差异有统计学意义(t=13.853、18.778,均P=0.000)。0、5、10、20 mmol/L二甲双胍处理MC38细胞后p-STAT3相对表达量分别为(1.17±0.26)、(0.87±0.32)、(0.60±0.33)、(0.51±0.24)pg/mL,0、5、10、20 mmol/L二甲双胍处理SW480细胞后p-STAT3相对表达量分别为(1.14±0.19)、(0.78±0.08)、(0.45±0.07)、(0.24±0.11)pg/mL。不同浓度二甲双胍处理MC38细胞后p-STAT3相对表达量比较,差异无统计学意义(F=3.164,P=0.086)。不同浓度二甲双胍处理SW480细胞后p-STAT3相对表达量比较,差异有统计学意义(F=32.626,P=0.000)。二甲双胍的干预可以降低STAT3的磷酸化,且随着浓度的增加,p-STAT3相对表达量逐渐减低,但对STAT3相对表达量无抑制作用(见图5)。说明二甲双胍可以通过COX2/PGE2/STAT3途径对结肠癌细胞发挥抑制作用。
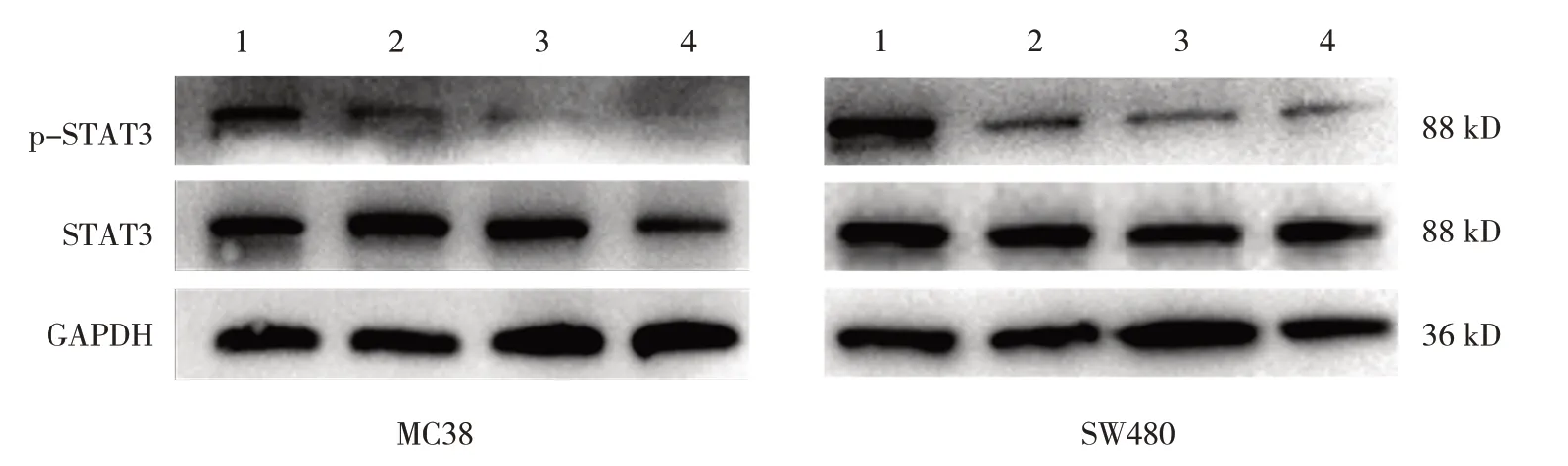
图5 MC38、SW480细胞添加不同浓度二甲双胍后p-STAT3、STAT3蛋白的表达情况
2.4 二甲双胍干预可抑制结直肠癌小鼠的肿瘤生长、分化
2.4.1 各组小鼠肿瘤数量、体积及结肠长度比较NaCl组和Met组小鼠结肠外观无明显异常,而AOM +DSS组和AOM + DSS + Met组小鼠结肠腔内可看到个数及体积不等的肿瘤。见图6。

图6 各组小鼠结肠外观
各组小鼠结肠肿瘤数量、肿瘤体积及结肠长度比较,差异有统计学意义(P<0.05)。进一步两两比较结果显示,AOM + DSS组较NaCl组肿瘤数量增多、体积增大、结肠长度缩短(P<0.05),AOM + DSS + Met组较Nacl组结肠肿瘤数量增多、体积增大、结肠长度缩短(P<0.05),AOM + DSS + Met组较AOM + DSS组结肠肿瘤数量减少、肿瘤体积减小(P<0.05)。见表2。
表2 各组小鼠结肠肿瘤数量、肿瘤体积及结肠长度比较(±s)
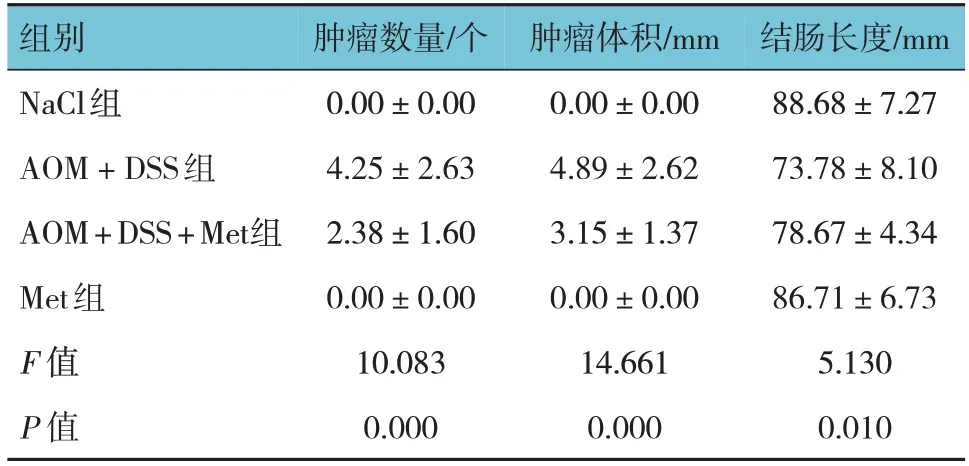
表2 各组小鼠结肠肿瘤数量、肿瘤体积及结肠长度比较(±s)
组别NaCl组AOM + DSS组AOM + DSS + Met组Met组F 值P 值肿瘤数量/个0.00±0.00 4.25±2.63 2.38±1.60 0.00±0.00 10.083 0.000肿瘤体积/mm 0.00±0.00 4.89±2.62 3.15±1.37 0.00±0.00 14.661 0.000结肠长度/mm 88.68±7.27 73.78±8.10 78.67±4.34 86.71±6.73 5.130 0.010
2.4.2 HE染色结果分析 NaCl组和Met组小鼠结肠低倍镜下观察无异常,高倍镜下可见成型的腺体规则排列,腺体厚度无明显改变,细胞形状规则,细胞核清晰可见,并可见大量的杯状细胞。AOM +DSS组小鼠结肠低倍镜下观察可见到明显的外生型肿瘤;高倍镜下,大部分腺体排列紊乱,异型增生明显。部分异形细胞成团聚集,腺体形状不可明视。细胞核异型性明显,核大深染,边界不清。与AOM+DSS组比较,AOM+DSS+Met组小鼠结肠低倍镜下未见肿瘤生长,高倍镜下可见部分腺体排列紊乱,但腺体轮廓大致可见,腺体结构可见。见图7。
2.4.3 二甲双胍降低结直肠癌小鼠结肠组织COX-2、PGE2及p-STAT3相对表达量 NaCl组、AOM + DSS组、AOM + DSS + Met组、Met组小鼠COX-2蛋白相对表达量分别为(0.40±0.10)、(1.00±0.03)、(0.55±0.18)、(0.14±0.02),经方差分析,差异有统计学意义(F=48.404,P=0.000)。AOM + DSS组COX-2蛋白的表达较NaCl组和Met组高。AOM + DSS + Met组COX-2蛋白的表达较AOM + DSS组低,但仍高于Nacl组和Met组。见图8。
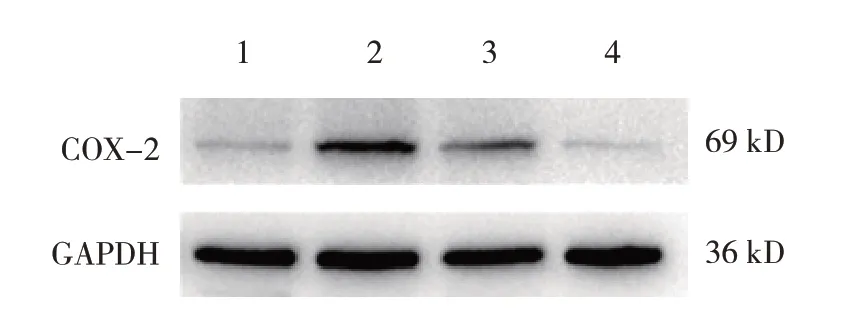
图8 各组小鼠结肠组织COX-2蛋白的表达
免疫组织化学结果显示,AOM + DSS组COX-2高表达,用二甲双胍处理后,AOM + DSS + Met组COX-2表达降低,NaCl组和Met组几乎不表达。见图9。
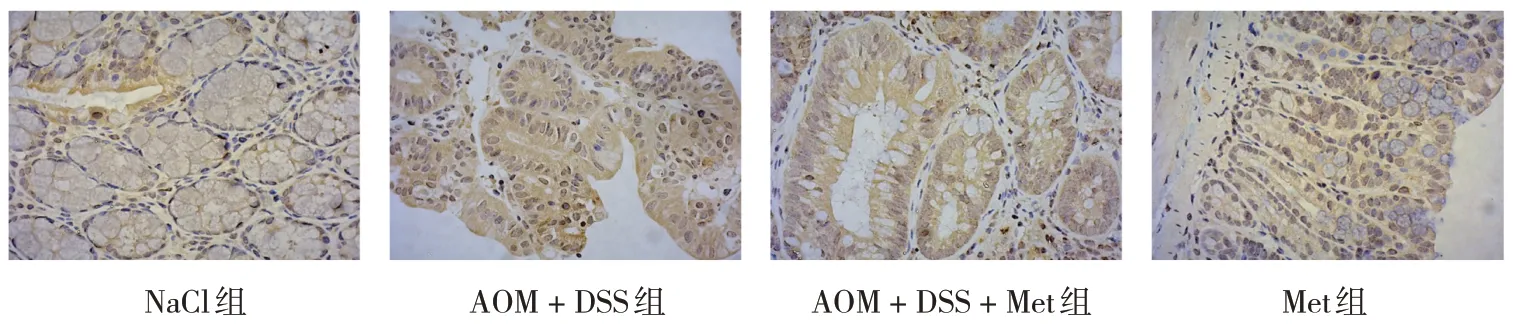
图9 各组小鼠结肠COX-2蛋白免疫组织化学染色
NaCl组、AOM + DSS组、AOM + DSS + Met组、Met组小鼠PGE2蛋白水平分别为(1.00±0.53)、(11.16±1.18)、(5.53±1.22)、(0.29±0.10)pg/mL,经单因素方差分析,差异有统计学意义(F=119.555,P=0.000)。进一步两两比较结果发现,AOM + DSS +Met组PGE2蛋白水平较AOM + DSS组低,但高于NaCl组和Met组(P<0.05)。
NaCl组、AOM + DSS组、AOM + DSS + Met组、Met组小鼠STAT3蛋白相对表达量分别为(1.03±0.19)、(1.03±0.13)、(0.78±0.18)、(1.15±0.74),经方差分析,差异无统计学意义(F=3.301,P=0.079)。NaCl组、AOM + DSS组、AOM + DSS + Met组、Met组小鼠p-STAT3蛋白相对表达量分别为(0.20±0.22)、(1.06±0.09)、(0.59±0.21)、(0.06±0.05),经方差分析,差异有统计学意义(F=23.535,P=0.000)。在体内实验中,AOM + DSS组p-STAT3表达量较NaCl组、Met组高,较AOM + DSS组低(P<0.05)。而各组小鼠STAT3蛋白相对表达量无明显差异。结果表明,二甲双胍的干预可以降低STAT3的磷酸化,而对STAT3总蛋白的表达没有抑制作用。见图10。
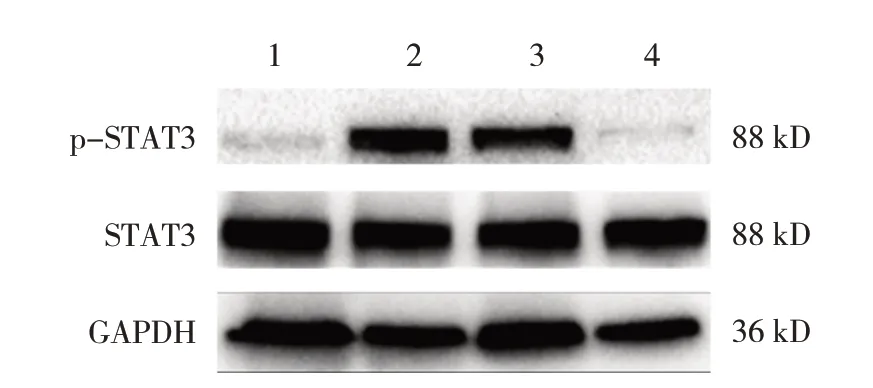
图10 各组小鼠结肠组织p-STAT3、STAT3蛋白的表达
2.5 结直肠癌小鼠肠道菌群16S rDNA高通量测序
2.5.1 高通序质量评价 共收集到25个样本,其中NaCl组6个,AOM+DSS组5个,AOM+DSS+Met组8个,Met组6个。共获得967 272条优化序列,序列平均长度为418 bp,共得到11门15纲42目73科159属256种660个操作分类单元。Sobs指数升高代表菌群丰度增加,多样性指数(Shannon指数)表示菌群多样性。Shannon指数稀释曲线趋向平坦,达到平台期,说明测序数据量足够大,该测序深度可覆盖全部物种。可以反映样本中绝大多数的微生物多样性信息。见图11。
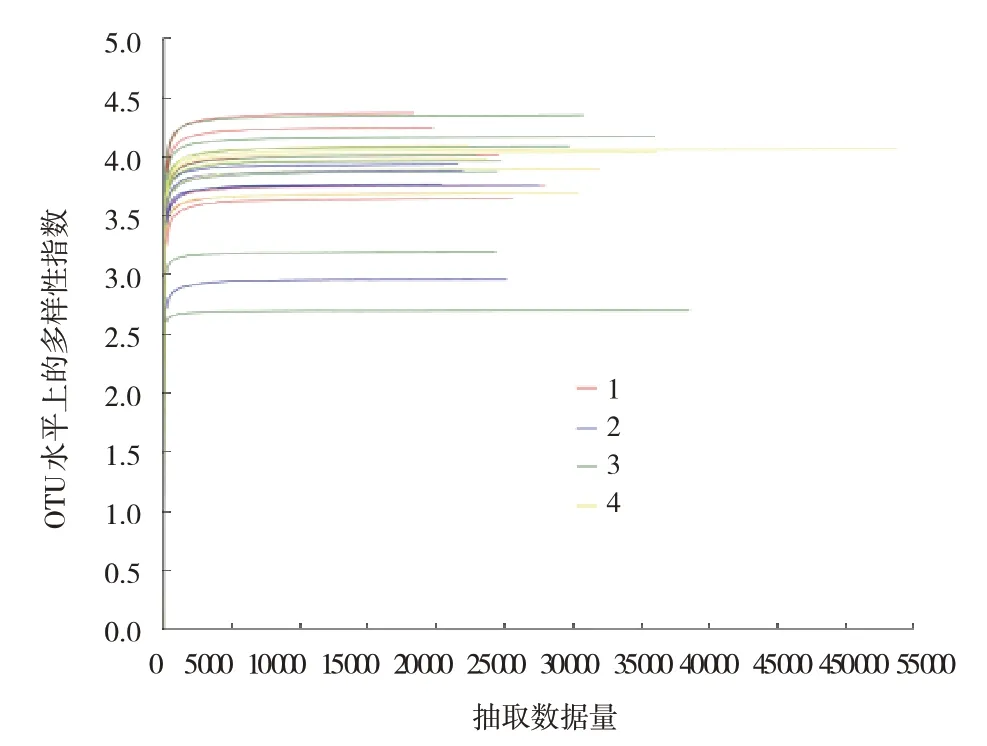
图11 各样本多样性指数稀释曲线
2.5.2 属水平PCoA多样性分析及指数组间差异性检验 不同颜色或形状的点代表不同分组的样本,两样本点越接近,表明两样本组成越相似。可以看出,在属水平上,NaCl组与Met组物种组成基本一致,而NaCl组,AOM+DSS组,AOM + DSS + Met组之间的物种组成均有所差异。见图12。
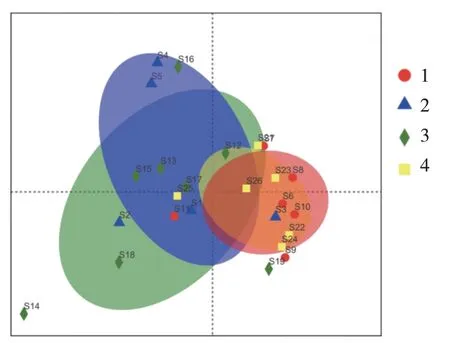
图12 属水平PCoA多样性分析
NaCl组Sobs指数为354.00(313.75,386.25),AOM+DSS组Sobs指数、Shannon指数分别为284.00(237.50,306.00)、3.765(3.357,3.908),AOM+DSS+Met组分别为365.50(348.50,382.25)、4.048(3.941,4.215)。NaCl组与AOM + DSS组Sobs指数比较,差异有统计学意义(Z=-2.191,P=0.028),AOM+DSS组较NaCl组低。AOM + DSS组与AOM+DSS+Met组Sobs指数、Shannon指数比较,差异有统计学意义(Z=-2.739和-2.373,P=0.006和0.018),AOM+DSS+Met组较AOM+DSS组高(P<0.05)。表明二甲双胍治疗会使菌群丰度以及多样性增加。
2.5.3 各组物种门水平、属水平群落丰度比较 各组放线菌门、变形菌门、髌骨细菌门、内脏臭气杆菌属、普雷沃菌属、双歧杆菌属、粪厌氧棒杆菌属、埃希氏-志贺氏菌属群落丰度比较,差异有统计学意义(P<0.05)。NaCl组与AOM + DSS组放线菌门、普雷沃菌属群落丰度比较,差异均有统计学意义(P<0.05)。NaCl组与AOM + DSS + Met组变形菌门、粪厌氧棒杆菌属、内脏臭气杆菌属、埃希氏-志贺氏菌属群落丰度比较,差异均有统计学意义(P<0.05)。AOM + DSS组与AOM + DSS + Met组变形菌门、放线菌门、粪厌氧棒杆菌属、埃希氏-志贺氏菌属、普雷沃菌属群落丰度比较,差异均有统计学意义(P<0.05)。NaCl组与Met组放线菌门、髌骨细菌门、变形菌门、双歧杆菌属群落丰度比较,差异均有统计学意义(P<0.05)。见表3。
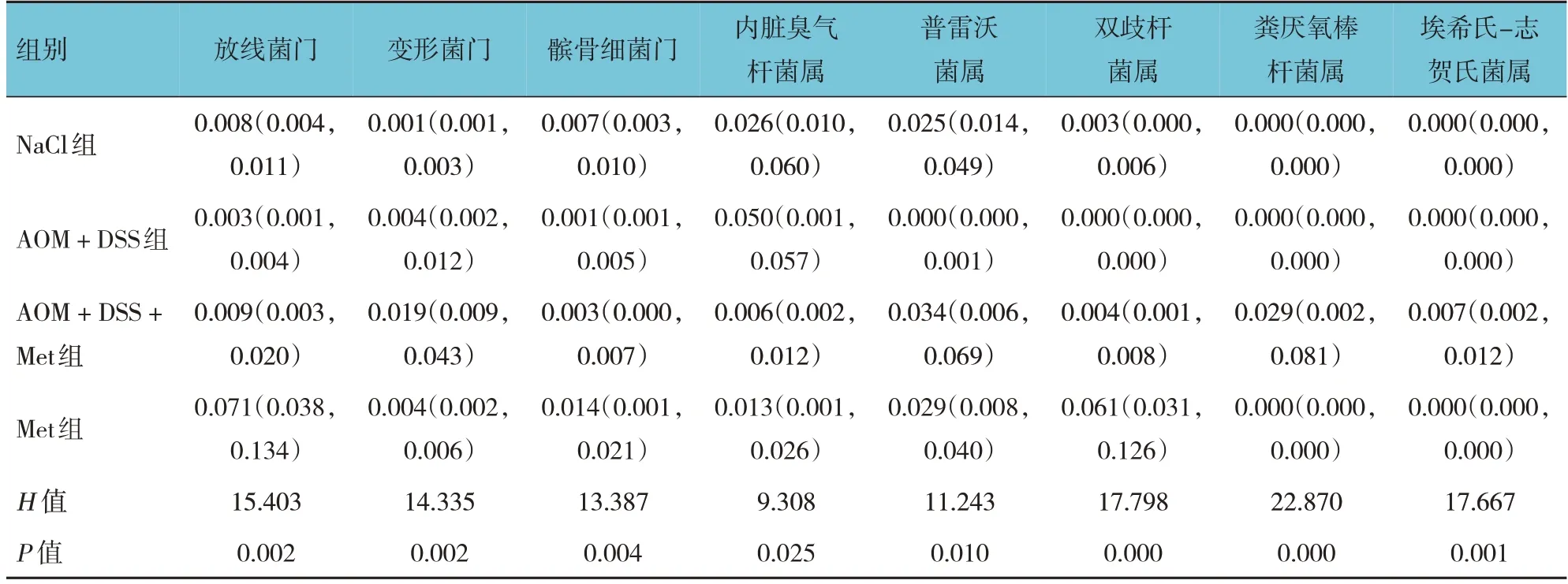
表3 各组物种门水平、属水平群落丰度比较 M(P25,P75)
3 讨论
在全球范围内结直肠癌的发病率和病死率逐年上升。预计到2030年全球发病率将增加60%[14],严重影响患者的生活质量,并且给社会带来极大的疾病负担。目前临床对于结直肠癌多采用以手术为主的治疗,但术后转移率高。结直肠癌目前已成为亟待解决的公共卫生问题,研究者也在积极探讨有效的治疗方法及药物。本研究结果证实了二甲双胍在体内和体外均可以抑制结直肠癌的生长和分化,并阐明了这种抑制作用是通过COX-2/PGE2/STAT3途径来实现的。
本研究结果首先证实了二甲双胍与COX-2具有较高的结合活性。然后使用不同浓度的二甲双胍分别对小鼠结肠癌细胞系MC38和人结肠癌细胞系SW480进行处理,结果表明,二甲双胍可以抑制两种结肠癌细胞的生长和增殖,促进结肠癌细胞的凋亡。同时,二甲双胍还可以抑制两种结直肠癌细胞系COX-2、PGE2以及p-STAT3的表达。接下来,笔者使用AOM和DSS诱导的结直肠癌的小鼠模型,二甲双胍干预后进行取材分析,发现二甲双胍也可以减少肿瘤的数量以及体积。同样,笔者检测了小鼠结肠中COX-2、PGE2、STAT3、p-STAT3蛋白的表达情况,与体外实验的结果一致,二甲双胍也可以抑制小鼠结肠组织中COX-2、PGE2以及p-STAT3的表达,但不影响STAT3蛋白的含量。
有临床研究表明,二甲双胍也可降低直肠癌新辅助同步放化疗患者中癌症复发的风险[15]。而其对于结直肠癌的抑制作用可能是通过以下机制发生的:二甲双胍可以通过AMPK和胰岛素/胰岛素样生长因子途径靶向作用于哺乳动物雷帕霉素靶蛋白,抑制结直肠肿瘤的发生、发展[16-17];SABER等[18]证明二甲双胍与5-氨基水杨酸组合可抑制炎性介质,如白细胞介素-1β、白细胞介素-6、COX-2等,灭活核因子κB和STAT3进一步降低基质金属蛋白酶2和基质金属蛋白酶9的表达,减少结直肠癌细胞的增殖、迁移和侵袭能力;二甲双胍可以使细胞周期停滞[19]。而本研究阐明了二甲双胍抑制结直肠癌的新途径:二甲双胍可以通过COX-2/PGE2/STAT3信号通路来抑制结直肠癌的发生、发展。COX-2是催化花生四烯酸转化为PGE2的一种限速酶,PGE2作为COX-2的下游产物,能促进肿瘤细胞生长、迁移和侵袭,促进血管生成,并抑制肿瘤细胞凋亡。有文献表明,在结直肠肿瘤中,COX-2/PGE2与STAT3关系密切[20]。p-STAT3蛋白变构后可转移到细胞核内,参与调节肿瘤细胞的生长、凋亡和转移等[21]。并且有研究者发现,PGE2抑制剂如非甾体抗炎药可通过抑制COX-2/PGE2途径降低结直肠癌的发生[22]。本研究结果发现,二甲双胍也可以通过COX-2/PGE2通路抑制结直肠癌的生长,这种作用是通过抑制STAT3的磷酸化来实现的。而已有的研究表明,在前列腺癌[10]、膀胱癌[12]中,二甲双胍均可以抑制COX-2/PGE2/STAT3信号通路来抑制肿瘤的迁移和侵袭,这与本研究结果是一致的,提示这可能是二甲双胍发挥抗肿瘤作用的机制之一。结直肠癌主要包括三种来源:散发性、遗传性、与结肠炎相关,其中85%~90%的散发性结直肠癌均来源于腺瘤-腺癌途径[23]。从腺瘤发展到腺癌需要数年的时间,除了生活方式的干预,化学预防也是一个重要手段。本研究结果表明,使用二甲双胍干预的小鼠模型,结直肠癌生长的数量、体积以及细胞异型性均显著低于实验组。而HIGURASHI等[24]研究也表明,口服二甲双胍(250 mg/d)的结肠息肉量和腺瘤发生的概率明显低于安慰剂组(38.0% vs 56.6%,30.6%vs 51.6%)。且二甲双胍价格低廉、易获得、副作用小,是很有潜力的化学预防药物。
肠道由丰富多样的微生物群落组成,统称为“肠道微生态”[25]。肠道微生态组成的改变被认为是一种生态失调,与许多人类疾病有关,包括肿瘤[26]。结直肠癌的已知危险因素,如饮食习惯、吸烟、肥胖等[27-28],可以改变肠道微生态的组成。因此,研究者推测,某些结肠微生物或原籍菌的改变可能产生促进肿瘤发生、发展的微环境。有证据表明,二甲双胍会引起人类肠道微生物群(如肠道细菌丰度降低)和肠道代谢组(如丁酸盐产生增加)的显著变化[29-30]。而其是否能够通过改变肠道菌群来抑制结直肠肿瘤的发生、发展,还需进一步阐明。因此,本研究16S rDNA测序结果显示,AOM+DSS组的群落丰度减少,而经过二甲双胍治疗后,群落丰度有所增加。在成人中,正常肠道菌群的主要细菌门是厚壁菌门、拟杆菌门、变形菌门和放线菌门,前2个在健康成人中普遍存在[31];而主要的细菌属是厌氧菌属,如拟杆菌属、真杆菌属、梭菌属、瘤胃球菌属和粪杆菌属。大多数厚壁菌门是革兰氏阳性细菌,可以水解肠道中的碳水化合物和蛋白质。拟杆菌门主要有助于多糖吸收和蛋白质合成的类固醇、多糖和胆汁酸,其成员可以将肠道中的多糖分解为短链脂肪酸,从而增加肠黏膜的通透性并促进炎症,两者相辅相成,促进宿主体内能量的吸收。本研究结果中,在门水平上,与NaCl组相比,AOM+DSS组的小鼠放线菌门平均相对丰度明显下降,而与AOM+DSS组相比,AOM+DSS+Met组的小鼠变形菌门、放线菌门的平均相对群落丰度增加,表明二甲双胍可以改善肠道菌群,使之趋向正常化。丁酸梭菌是一种来自转基因的益生菌,通过在肠道中发酵纤维来产生丁酸盐。而有文献指出,丁酸盐处理可以显著降低小胶质细胞COX-2水平[32]。本研究尚未发现二甲双胍与丁酸梭菌的关系,在后续研究中笔者将进一步展开探索。
综上所述,二甲双胍可以通过COX-2/PGE2/STAT3途径抑制结直肠癌的发生、发展,促进肿瘤细胞的凋亡;另外,二甲双胍可以促使结直肠癌模型小鼠的肠道菌群向正常菌群改变。虽然其临床有效性、安全性还有待进一步探讨,但基于以上研究成果,二甲双胍有望成为一种新型的预防、辅助治疗结直肠癌的药物。

