血浆置换联合持续性血液净化治疗血栓性血小板减少性紫癜伴多器官功能衰竭1例
周向军 陈淑婷 曾育平
血栓性血小板减少性紫癜(Thrombotic thrombocytopenic purpura,TTP)是一种主要以微血管内广泛血小板血栓形成为特征的血栓性微血管病,属于临床急危重症,年发病率约为10/100 万,其发病急骤,病情凶险,死亡率高[1]。TTP 的典型临床表现为血小板减少、微血管病性溶血、神经系统症状、不同时期发热及肾脏损害等“五联征”。血浆置换是首选治疗措施,能使患者生存率大大提高[2]。本文报告中山大学附属第三医院粤东医院成功救治TTP 伴多器官功能衰竭患者1 例的病例资料,并结合文献讨论,以提高对TTP 的认识。
1 病例资料
患者男性,22 岁,因“发热、身黄、尿黄及乏力呕吐3天”入院。既往健康状况良好;否认过敏史。2023 年7 月17 日旅游期间进食生腌虾及贝壳类食物,当晚出现胃肠不适和腹泻,自服藿香正气水、速效止泻胶囊、头痛散(阿加芬散)等药物,症状稍有改善。7 月21 日返家后发现皮肤有散在出血点,并开始出现畏寒、发热,解浓茶样小便,伴头晕乏力,恶心,呕吐非咖啡色样胃内容物,腹胀,腹部隐痛,于2023 年7 月23 日来中山大学附属第三医院粤东医院急诊科就诊后收入院。体查:T 36.4℃,P76 次/分,R20 次/分,BP140/96 mmHg。神志清楚,精神疲倦,呼吸平稳,对答切题。皮肤黏膜黄染,皮肤散在出血点。全身浅表淋巴结无肿大。腹部平坦,腹部未触及明显包块,无反跳痛,肝、脾未触及,肠鸣音4 次/分。双下肢无浮肿。
主要辅助检查:头颅CT:无异常。上腹部螺旋CT 平扫:左侧肾前筋膜增厚,胰腺炎待排;双肾周围轻度炎症。入院时实验室检查:D-二聚体定量587 ng/ml;白细胞8.34×109/L,血红蛋白浓度124 g/L,血小板6×109/L;尿素14.35 mmol/L,肌酐275.9 μmol/L,钾3.75 mmol/L;尿常规分析+沉渣:蛋白质2+,潜血3+;脑B 型利钠肽(BNP)255 pg/ml;C 反应蛋白(CRP)32.3 mg/L,白蛋白46.9 g/L,总胆红素120.8 μmol/L,直接胆红素31.4 μmol/L,间接胆红素89.4 μmol/L,丙氨酸氨基转移酶33 IU/L,天冬氨酸氨基转移酶56 IU/L,乳酸脱氢酶2392 U/L;高敏肌钙蛋白63.7 pg/ml,肌红蛋白48.4 ng/ml。入院诊断:1.血小板减少查因:血液病?感染性?2.发热查因:感染性?自身免疫性?3.肝功能不全;4.肾功能不全;5.急性腺炎待排;6.脂肪肝。
住院期间诊治经过:入院后予地塞米松20 mg、血小板1 治疗量、重组人血小板生成素注射液、多西环素等治疗后尿色转清,尿量正常,胆红素较前有下降;2023 年7 月25日患者突然全身抽搐,口吐白沫,短暂性神志不清,烦躁不安,转ICU 治疗;转入ICU 时患者极度烦躁,给予镇静,尿液酱油样。进一步检查:血小板相关抗体(-);伤寒O 抗原、H 抗原试验1:40(阴性),副伤寒甲、乙试验1:40(阴性),变形杆菌(OX2)、(OX19)、(OXK)1:40(阴性);肝病寄生虫抗体全套检验报告(-);感染八项(-)。血管性血友病因子(vWF)裂解酶(ADAMTS13)4.53%(活性低下),ADAMTS13 活性抑制性抗体(+),血管性血友病因子(vWF:Ag)免疫比浊法>420.0。转入诊断:1.血小板减少查因:血栓性血小板性紫癜?2.多器官功能衰竭。治疗上给予气管插管接呼吸机辅助通气、血浆置换(3000 ml/次)、连续性血液净化治疗(CRRT:CVVH)、地塞米松20 mg、大剂量静注人免疫球蛋白冲击(25 g/天)、多西环素等。患者仍反复高热,体温高达40.5℃,使用“头孢他啶2 g 静滴q8h”效果不佳,调整为美罗培南+奥马环素联合抗感染。治疗经过和效果,见图1-3。
患者症状逐渐好转,血小板、凝血功能、胆红素、转氨酶基本正常,血红蛋白无继续下降,肾功能恢复期,尿量正常。已出院,可独立自主生活,恢复社会能力。
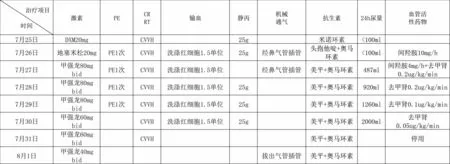
图1 治疗经过(DXM:地塞米松;PE:血浆置换;CRRT:连续性血液净化治疗)
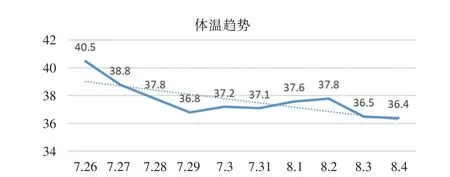
图2 体温(℃)
2 讨 论
3.1 TTP的诊断 TTP 症状与免疫性贫血、溶血尿毒症性综合症、ITP、噬血细胞综合征等疾病症状相似,临床上有时候难以诊断明确。TTP 发病机制主要与血浆中ADAMTS13 活性缺乏相关,当ADAMTS13 活性降低10%甚至更低时,血浆中会存在大量大分子量vWF 多聚体,导致与血管内皮细胞vWF 异常释放、补体异常活化、血小板异常活化等相关。血浆中ADAMTS13 活性缺乏导致内皮细胞异常释放的超大分子vWF(UL-vWF)不能及时降解,ULvWF 可自发结合血小板,导致微血管内血栓形成、微血管病性溶血,进而引起相应器官缺血、缺氧及功能障碍,引起临床症候群,严重者发生多器官功能衰竭。ADAMTS13 活性在TTP 发病过程中起非常重要作用,是诊断TTP 特异性指标,也是治疗效果评估的关键点。本病例患者诱发TTP的原因未明,可能是肠道感染和口服非甾体类抗炎药物所诱发。实验室检查发现ADAMTS13 活性低下,ADAMTS13活性抑制性抗体阳性,血管性血友病因子(vWF:Ag)免疫比浊法升高,诊断TTP 诊断明确。
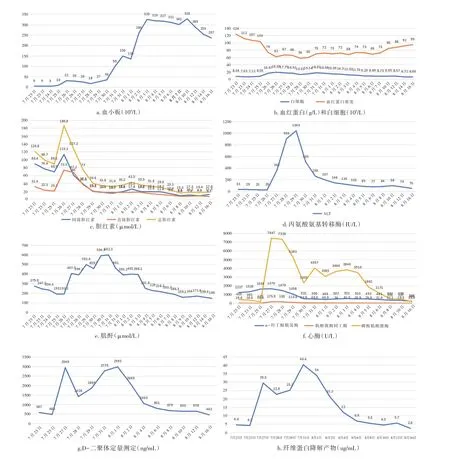
图3 实验室相关指标情况
3.2 TTP的治疗 (1)血浆置换仍是目前治疗TTP 的主要措施,其可快速提高TTP 患者体内ADAMTS13 水平,同时清除ADAMTS13 抗体、抑制物及大分子量vWF 多聚体,从而改善患者总体生存率。临床上一旦怀疑或确诊TTP应尽早给予血浆置换治疗[3]。对合并肾功能衰竭、感染性休克患者应早期联合CRRT 治疗,清除炎症介质和保护机体功能。(2)糖皮质激素可抑制自身抗体的产生,减轻炎症反应,保护器官功能,作为与血浆置换联合应用治疗TTP的辅助手段[4]。可以采用甲泼尼龙(80-120 mg/d)或地塞米松(15-20 mg/d)静脉输注,病情缓解后可过渡至泼尼松[1-2 mg/(kg· d)],并逐渐减量至停用。(3)人免疫球蛋白[400 mg/(kg·d)]也是重要的辅助治疗。(4)合并严重溶血时,输注洗涤红细胞,增加血栓性疾病的安全性,避免新的红细胞内含有引起机体再次免疫应答加重症状。(5)CD20单抗利妥昔单抗通过选择性耗竭B 淋巴细胞而降低ADAMTS13 抑制物或IgG 抗体滴度,有效恢复血浆ADAMTS13活性。临床研究证实,免疫性TTP(iTTP)急性发作期使用CD20 单抗利妥昔单抗可提升治疗有效率、降低早期死亡率、减少复发率、延长缓解期。本例经过血浆置换联合CRRT 治疗联合糖皮质激素、人免疫球蛋白治疗,效果明显,故没有使用。在后续的随诊中,可以根据患者ADAMTS13 水平决定患者是否需要使用。
3.3 诊疗体会本病例亮点在于及早采取血浆置换(3000 ml/次)联合CRRT,患者溶血采用输注洗涤红细胞治疗,避免免疫二次激活损伤。因此,当临床初步诊断为TTP,而实验室检查不够完善,不足以确诊时,应快速行血浆置换联合CRRT 治疗;当患者合并溶血,在不知是否由自身免疫产生溶血的前提下,应采用输注洗涤红细胞以改善贫血。本例入院时已经出现血小板减少,重度贫血,对症治疗效果不佳、症状恶化转重症医学科,从病程上有延误病情的可能。因此,医院需要对出凝血性疾病制定相应的院内管理流程,让出凝血性疾病得到早期诊断、早期治疗、早期评估,使患者得到恰当、及时的救治,达到出凝血性疾病的同质化管理。TTP 的预后取决于早期诊断和早期应用血浆置换及免疫治疗等综合治疗,本例虽未使用免疫抑制剂,对于治疗药品相对不足的基层医院,具有很好的借鉴效应。

