大黄素的药理作用机制研究进展
吴丛宇,周 悦,上官璐茜,杨雅妮,王晶雅,余俊河,宫帅帅,寇俊萍
(中国药科大学中药学院中药药理与中医药学系,江苏省中药评价与转化重点实验室,南京 211198)
大黄素,又称泻素,其化学名为1, 3, 8-三羟基-6-甲基蒽醌(化学结构如图1 所示),属于羟基蒽醌类化合物,在大黄(Rheum palmatumL.)、虎杖(Polygonum cuspidatumSieb. et Zucc.)、何首乌(Polygonum multiflorumThunb.)等中药材中含量丰富[1]。近年来大量研究证实大黄素具有抗肿瘤、抗炎、免疫调节、抗菌和抗病毒等多种药理活性,涉及肝癌、结肠癌、胰腺癌、非小细胞肺癌、心力衰竭、心肌肥大、心肌梗死、心肌炎、缺血再灌注损伤、神经退行性疾病、糖尿病、骨质疏松症等多种疾病[2],相关分子机制研究也日益深入。本文总结了近5 年来发表于国内外期刊有关大黄素的药理作用机制的研究进展,重点介绍大黄素的抗肿瘤、抗炎和免疫调节、保护心脑血管、抗纤维化等方面药理作用及其分子机制,以期为基于大黄素的新药研制和临床应用提供一定参考依据和线索。
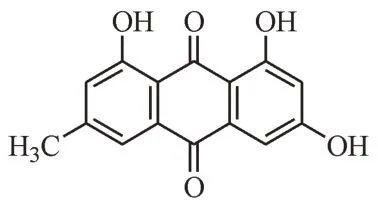
图1 大黄素(1, 3, 8-三羟基-6-甲基蒽醌)的化学结构
1 抗肿瘤作用
据报道,肿瘤已成为世界上继心血管疾病的第二大死因,患者数逐年增加[3]。研究表明大黄素可以通过影响肿瘤发生的各个阶段,包括细胞增殖、凋亡、上皮-间质转变、细胞迁移和血管生成等途径发挥抗肿瘤活性。
1.1 抑制癌细胞增殖并诱导凋亡
细胞增殖或细胞死亡的失调是癌症的决定性特征。所有肿瘤病灶的特征是无限的细胞增殖,而细胞凋亡引起的细胞死亡是肿瘤病灶的重要抑制机制[4]。研究显示,大黄素10 ~ 80 µmol/L 可明显降低结肠癌细胞活力,诱导结肠癌细胞的细胞周期阻滞和细胞凋亡[5];大黄素25 ~ 100 µmol/L 可抑制MCF-7人乳腺癌细胞的增殖[6];大黄素30 µmol/L可以通过调节细胞周期抑制非小细胞肺癌细胞的增殖[7]。此外,大黄素可以通过影响胱天蛋白酶-3(cysteine aspartic acid specific protease-3, caspase-3)和caspase-9 的表达诱导肿瘤细胞凋亡,发挥对胰腺癌[8]的治疗作用。核因子κB (nuclear factor-κB,NF-κB)和信号转导及转录激活因子(signal transduction and activator of transcription, STAT)已成为肿瘤相关炎症的主要调节因子。大黄素15 µmol/L处理48 h可以通过调节人结肠癌细胞COLO 201的IκB 激酶β(inhibitor kappa B kinase β, IKKβ)/NFκB 和STAT 等分子信号通路调节B 细胞淋巴瘤2(B cell lymphoma 2, Bcl-2)家族蛋白的表达和定位从而调节肿瘤细胞的增殖、分化及凋亡[5]。体内实验表明,在LLC 肺癌细胞的荷瘤小鼠模型中,大黄素可抑制C57 小鼠分泌型小分子磷脂酶A2-IIa(secretory small molecular phospholipase-IIa, sPLA2-IIa)水平,从而抑制NF-κB 活性,导致非小细胞肺癌细胞死亡[9]。
此外,研究表明大黄素15 ~ 60 µmol/L 处理48 h 后,可通过抑制磷脂酰肌醇3-激酶(phosphoinositide 3-kinase, PI3K)/蛋白激酶B(protein kinase B, Akt)抑制细胞增殖,诱导S期和G2/M细胞周期停滞,促进HepG2 细胞凋亡[10]。当大黄素和小檗碱联合使用,可通过抑制盐诱导激酶3(saltinducible kinases 3, SIK3)/哺乳动物雷帕霉素靶蛋白(mammalian target of rapamycin, mTOR)通路,抑制乳腺癌细胞中有氧糖酵解和细胞生长,并通过SIK3 激酶减弱 Akt 抑制的乳腺癌细胞G1/S 周期阻滞和凋亡[11]。大黄素1.25 ~ 5 µmol/L 处理6 ~ 24 h还可激活胞外信号调节激酶(extracellular signalregulated kinase, ERK), c-Jun 氨基端激酶(c-Jun Nterminal kinase, JNK)和p38丝裂原激活的蛋白激酶(p38 mitogen-activated protein kinase, p38 MAPK)等MAPKs,促进子宫内膜癌细胞的分化和凋亡[12]。
1.2 抑制肿瘤侵袭、转移
上皮-间质转化(epithelial-mesenchymal transition, EMT)是上皮细胞获得间质特征的过程,是原发肿瘤侵袭的起始步骤之一。同时,EMT 与癌症干细胞样细胞(cancer stem-like cells, CSC)自噬过程被认为是促进肿瘤细胞转移的主要因素[13]。研究表明,大黄素40 µmol/L 处理48 h 后可明显增加人胰腺癌SW1990 细胞microRNA-1271 的表达水平,从而抑制EMT[14]。在手术切除乳腺肿瘤之前短期给予大黄素,发现其可通过减少促瘤巨噬细胞和抑制原发性肿瘤中的 EMT和CSC形成来阻止乳腺癌术后肺部转移复发[15]。大黄素5 ~ 20 µmol/L可明显抑制结肠癌细胞Wnt/β-catenin 通路,增加E-cadherin 的mRNA 水平和降低N-cadherin 的表达抑制EMT,同时抑制侵袭和迁移标志蛋白,如基质金属蛋白酶-7(matrix metalloproteinase-7, MMP-7)、MMP-9,从而抑制结肠癌细胞的侵袭和转移[16]。此外,大黄素还可诱导M2 巨噬细胞向M1 巨噬细胞的转化,从而抑制与M2 巨噬细胞共培养介导的肝癌细胞的增殖和侵袭[17]。
另据报道,长链脂酰辅酶A 合成酶(long-chain acyl-CoA synthetase, ACSL)在结肠癌组织中高表达,ACSL4 下调可降低细胞增殖和侵袭,而ACSL4与血管内皮生长因子(vascular endothelial growth factor, VEGF)及其受体VEGFR1、VEGFR2 水平呈正相关,并与结肠癌患者的生存时间较短有关。分子对接模拟和微量热泳动(microscale thermophoresis, MST)分析证实,大黄素可直接与ACSL4蛋白结合形成2 个氢键,且解离常数为20 µmol/L。而在过表达ACSL4 的结肠癌细胞中,大黄素20 µmol/L 处理48 h 后,对人结肠癌细胞HCT116增殖和侵袭的抑制作用明显减弱甚至被抵消。此外,大黄素25, 50 mg/kg 灌胃给药8 周,可以抑制VEGF 分泌、ACSL4 和VEGFR 的表达,从而抑制体内结肠癌的发生。上述研究证实大黄素通过靶向ACSL4 来减少VEGF 分泌以及VEGFR1 和VEGFR2 的表达,从而抑制结肠癌细胞的增殖和侵袭,降低小鼠的死亡率和肿瘤发生[18]。
1.3 抑制肿瘤血管生成
血管生成是肿瘤发生的关键和早期步骤,被认为是实体瘤的标志和肿瘤复发的关键特征[19]。研究表明,丝氨酰-tRNA合成酶(seryl-tRNA synthetase, SerRS)是一种 VEGFA 强效转录抑制因子,大黄素体外5 ~ 20 µmol/L 可明显增加三阴性乳腺癌细胞中的SerRS 表达,减少VEGFA 转录;25, 100 mg/kg 腹腔注射,可显著抑制小鼠的血管生成。同时,分子对接结果表明大黄素与核受体辅助抑制因子2(nuclear receptor corepressor 2, NCOR2)的组蛋白相互作用域SANT2结合,使SerRS启动子复合物解离,打开启动子构象,增强SerRS转录,在三阴性乳腺癌中发挥抗血管生成功能[20]。此外,大黄素可通过激活肿瘤坏死因子受体相关因子6(tumor necrosis factor receptor associated factor 6, TRAF6)介导的相关信号通路在间变性甲状腺癌中发挥抗血管生成活性[21]。
2 抗炎和免疫调节作用
炎症是免疫系统保护生物体免受有害因素影响的生物反应,过度和不受控制的炎症与多种破坏性慢性疾病有关[22],多项体内外研究发现,大黄素在治疗和预防各种炎症疾病方面具有潜在的药理作用。急性肺损伤是大量粒细胞浸润导致的过度炎症反应,大黄素5 ~ 20 mg/kg 腹腔注射给药可通过调节急性肺损伤大鼠粒细胞功能来发挥抗炎作用[23]。同时,大黄素可通过调控JNK/神经生长因子诱导的基因B(nerve growth factor-induced gene B, Nur77)/c-Jun[24]、抑制mTOR/缺氧诱导因子-1α(hypoxia inducible factor-1, HIF-1α)/VEGF 信号通路[25],抑制小鼠巨噬细胞RAW264.7的炎症因子生成和氧化应激,在急性肺损伤中发挥抗炎作用。急性胰腺炎是胰酶在胰腺内被激活后引起胰腺组织自身消化、水肿、出血甚至坏死的炎症反应。大黄素通过抑制NOD 样受体热蛋白结构域相关蛋白3(NOD-like receptor thermal protein domain associated protein 3, NLRP3)/caspase-1/GasderminD 蛋白(GSDMD)介导的肺泡巨噬细胞(alveolar macrophages, AMs)焦亡[26]、抑制P2X7/NLRP3 信号通路降低血浆中白细胞介素-1β(interleukin-1β, IL-1β)和IL-18的浓度[27],降低促炎因子,有利于急性胰腺炎的恢复。此外,大黄素可显著降低病毒性心肌炎小鼠模型血清肿瘤坏死因子α(tumor necrosis factor-α, TNF-α)和IL-6 及心肌肌钙蛋白和脑钠肽等的水平,升高心肌超氧化物歧化酶水平,改善病毒性心肌炎小鼠心脏指数和病理评分[28]。在疾病进展中,各种促炎基因的转录需要NF-κB 的参与,大黄素可通过调节NF-κB 信号通路,调节白介素水平,改善炎症引起的肠道溃疡等损伤[29]。
免疫失调可导致多种疾病,其特征是过度炎症反应和免疫抑制[30]。多项研究表明,大黄素可干预多条信号通路,发挥免疫调节作用。大黄素通过调节沉默调节蛋白1(sirtuins 1, SIRT1)/过氧化物酶体增殖受体γ 辅激活因子α(peroxisome proliferators-activated receptor γ coactivator 1alpha, PGC-1α)/NLRP3 信号通路、髓样分化因子88(myeloid differentiation primary response gene 88, MyD88)/PI3K/Akt/NF-κB 信号通路,抑制小胶质细胞活化,以此减轻自身免疫性脑脊髓炎症状[31-32]。而对于柯萨奇病毒B3m 诱导的手足口病脑炎,大黄素则通过抑制Toll 样受体3(Toll-like receptor 3, TLR3)通路调节免疫功能[33]。大黄素还可通过提高调节性T 细胞免疫力和叉头样转录因子3 的表达,增加相关抗炎因子水平,调节肠道免疫,控制肠道炎症[34]。此外,大黄素通过介导Bcl-2 相关X 蛋白(Bcl-2-associated X protein, Bax)/Bcl-2/caspase-3 途径抑制细胞凋亡,调节T 细胞比例,保护肠道屏障并抑制严重急性胰腺炎免疫反应[35]。
3 抗菌和抗病毒作用
研究表明,大黄素能通过抑制ERK1/2 的磷酸化和抑制F-肌动蛋白聚合来抑制细菌入侵[36]。大黄素8.75, 17.5, 35 mg/kg 灌胃给药可减轻大肠埃希菌O1引起的肠道损伤并通过增加肠道有益菌群的丰度和抑制有害菌的丰度来改善小鼠的肠黏膜屏障功能,从而缓解腹泻[37]。大黄素75 mg/kg 灌胃给药可显著激活甲型流感病毒感染小鼠的过氧化物酶体增殖物激活受体α/γ(peroxisome proliferators-activated receptors α/γ, PPARα/γ)和腺苷酸活化蛋白激酶(adenosine monophosphate-activated protein kinase, AMPK)途径,进而增加细胞内三磷酸腺苷(adenosine-triphosphate, ATP)水平,发挥抗甲型流感病毒活性[38]。此外,大黄素能诱导猪肺泡巨噬细胞系中的TLR3、干扰素-α 和干扰素-β 的表达,抑制猪繁殖和呼吸综合征病毒[39]。通过硅胶薄层色谱法分离,LC-MS 分析鉴定生物活性的化合物,结果显示大黄素可作为抗菌和抗真菌抗生素的生物利用度增强剂,揭示了其在治疗多药耐药性方面的潜力[40]。此外,大黄素0.04 ~ 40 µmol/L感染Vero E6 细胞96 h,浓度依赖性地显著减少病灶数量,并可直接损害寨卡病毒颗粒,用于治疗寨卡病毒感染患者和进行预防性治疗[41]。
4 心肌保护作用
心血管疾病在全球有高发病率高病死率。多项研究表明,大黄素具有抑制心肌细胞死亡、抗心肌肥大等活性,为临床治疗心血管疾病提供实验依据[42]。
4.1 抑制心肌细胞死亡
ERK 通路参与调节心肌细胞凋亡,激活后造成心肌损伤[43]。聚焦于心肌梗死后心力衰竭大鼠心肌细胞能量代谢和ERK 通路调节的报道表明,大黄素20, 40, 60 mg/kg 连续灌胃14 d 能显著降低冠脉结扎4 周诱导的心力衰竭模型大鼠心肌组织凋亡率,改善大鼠心脏功能[44]。此外,大黄素15 µmol/L 通过上调混合谱系酶3 调节的miR-138以及激活SIRT1/Akt 和Wnt/β-catenin 途径来减少心肌细胞凋亡,从而减轻缺氧诱导大鼠H9c2 心肌细胞损伤[45]。
调节细胞焦亡可在一定程度上缓解心肌缺血再灌注损伤[46]。研究证实大黄素2.5, 5, 10 µmol/L通过抑制Toll 样受体4(Toll-like receptor 4, TLR4)/髓样分化因子88(myeloid differentiation primary response gene 88, MyD88)/NF-κB/NLRP3 炎症小体途径减少心肌细胞焦亡[47]。此外,通过对心肌缺血再灌注损伤小鼠模型的mRNA 和miRNA 进行测序,并运用多学科交叉技术发现大黄素可以通过调节RUNT 相关转录因子1(RUNX family transcription factor 1, RUNX1)/miR-142-3p/多巴胺受体D2(dopamine receptor D2, DRD2)途径来抑制NF-κB增强引发的心肌缺血再灌注损伤[48]。
4.2 抑制心肌肥大
心肌肥大特征是左心室肥厚,射血分数保留或增加,会引发心力衰竭和心源性猝死等疾病[49]。体内外研究表明,大黄素通过激活过氧化物酶体增殖物激活受体γ 辅助活化因子1-α,活化沉默调节蛋白3(sirtuins 3, SIRT3)信号通路来缓解异丙肾上腺素及腹主动脉狭窄诱导的小鼠心肌肥大[50]。另外大黄素10 µmol/L 可抑制牛血清白蛋白中的组蛋白去乙酰化酶(histone deacetylase, HDAC)活性及肾上腺素和佛波酯诱导的新生大鼠心肌细胞中的HDAC 活性,并抑制STAT3,p38,蛋白激酶D(protein kinase D, PKD)等多条信号通路,下调趋化因子CXC基序趋化因子配体12等多个因子的基因表达;大黄素30 mg/kg 连续灌胃给药14 d 可抑制HDAC 基因表达缓解血管紧张素Ⅱ诱导的小鼠肥厚型心肌病[51-52]。
5 神经保护作用
神经系统疾病发病机制复杂,研究表明大黄素具有神经保护活性,可以通过抑制神经细胞死亡和保护血脑屏障对多种神经退行性疾病、脑缺血等神经系统疾病起到潜在的治疗作用。
5.1 抑制神经细胞死亡
抑制氧化应激诱导线粒体功能障碍和过多的ROS 积累导致的细胞凋亡,是缓解神经元细胞死亡的重要机制。大黄素20 µmol/L 处理人神经母细胞瘤细胞后,可以通过提高细胞ATP 水平,抑制AMPK 信号通路及内质网应激,降低ERK1/2 磷酸化,减少ROS 和保护线粒体功能来减少细胞凋亡,治疗过量Zn2+诱导的帕金森病等神经系统损伤[53]。大黄素作为脑卒中的神经保护剂,可以通过ERK1/2 信号通路诱导Bcl-2 和谷氨酸转运体-1 的表达,减少ROS 生成,从而抑制神经元细胞凋亡[54]。大黄素具有抗阿尔茨海默病(Alzheimer’s disease,AD)作用,可激活蛋白激酶C(protein kinase C,PKC)途径减轻氧化应激,减少ROS积累,增强Bcl-2/凋亡蛋白并激活核因子E2 相关因子2 途径,发挥抗氧化功能,减少神经元细胞凋亡,改善AD[55-56]。此外,大黄素还可通过抑制小胶质细胞活化,降低IL-6、TNF-α 等炎症因子的水平[57],对AD发挥潜在治疗作用。
5.2 保护血脑屏障
血脑屏障是一种细胞和物理屏障,在大脑细胞外环境的稳态中起着至关重要的作用[58]。血脑屏障通透性增加引起的脑水肿可扩大缺血性脑卒中的梗死面积,研究发现大黄素与人参皂苷Rb1联合使用对降低血脑屏障通透性和梗死面积具有协同作用[59]。此外,大黄素40 mg/kg 连续给药3 d,可以上调大脑中动脉闭塞模型大鼠梗死皮层组织的闭合蛋白和紧密连接蛋白-5 的水平,下调MMP-2/MMP-9 水平,从而保护血脑屏障,减少炎症对脑组织的双重损伤[60]。
6 肾脏保护作用
大黄素可通过调节circ_0000064/miR-30c-5p/大型多功能肽酶7(large multifunctional peptidase 7, Lmp7)轴减轻高葡萄糖诱导的小鼠肾小球系膜细胞中的氧化应激、炎症和细胞外基质积累,达到肾脏保护作用[61]。基于网络药理学和分子对接技术的预测发现,大黄素通过白细胞介素-17、MAPK等信号通路中的关键靶点在糖尿病肾病的治疗中发挥作用[62]。大黄素1, 3, 10 mg/kg 腹腔注射给药1 周可通过抑制钙/钙调蛋白依赖性蛋白激酶Ⅱ活性,缓解缺血再灌注引起的肾损伤[63]。大黄素20, 40 µmol/L 可通过抑制NLRP3 炎症小体的活化来保护肾小管上皮细胞,减少炎症反应,从而缓解脂多糖诱导的急性肾损伤[64]。
7 骨保护作用
骨质疏松症是一种骨骼疾病,其特征是骨强度受损,增加人骨折的风险[65]。研究表明,大黄素30 mg/kg 灌胃给药10 周,可通过抑制TRAF6、原癌基因蛋白等的表达来抑制破骨细胞形成,改善炎症性肠病诱导的大鼠骨质疏松症[66]。大黄素5,25 µmol/L 预处理软骨细胞2 h 可下调大鼠软骨细胞中MMP-3、MMP-13、血小板反应蛋白解整合素金属肽酶4/5 表达,预防和治疗骨关节炎[67]。大黄素10, 20, 30 µg/mL 处理大鼠软骨细胞2 h 可降低IL-1β 诱导的细胞毒性,抑制NO、前列腺素E2、MMP-3 和MMP-13 的表达和ERK 和Wnt/β-catenin通路,最终促进软骨细胞的增殖[68]。
8 抗纤维化作用
肝纤维化的典型特征是细胞外基质合成与降解失衡,大黄素可激活p53 并通过p53/ERK/p38 轴诱导肝星状细胞凋亡,并通过调节MMP-1、MMP-9重塑细胞外基质以改善肝纤维化[69]。
心肌纤维化会导致心室结构改变,是心室功能障碍和心力衰竭的常见征兆[70]。转化生长因子-β1 可刺激成纤维细胞活化,研究发现大黄素可以通过转化生长因子相关信号通路发挥作用,在0 ~20 µmol/L范围内以浓度依赖性方式抑制心肌纤维化[71]。大黄素40 mg/kg 灌胃给药4 周可能通过上调转移相关蛋白3抑制心肌成纤维细胞的活化,改善心肌纤维化[72]。
大黄素可通过调节c-MYC 原癌基因/miR-182-5p/ZEB 蛋白2(zinc finger E-box binding homeobox 2, ZEB2)轴来减轻肺纤维化和上皮间质转化[73]。硅肺病是一种由吸入二氧化硅粉尘引起的致命肺部疾病,其特征是肺部炎症和纤维化,研究表明,胃内给药大黄素(3.5 mL/kg)可以显著减轻硅肺中的肺纤维化程度[74]。此外,用大黄素10 µg/mL 处理显著抑制RLE-1TN 细胞和A6 细胞内中性粒细胞弹性蛋白酶活性,从而减轻肺纤维化[75]。
9 其他作用
大黄素可通过胰岛素受体底物1(insulin receptor substrate, IRS1)/PI3K/Akt/叉头框蛋白O1(recombinant forkhead box protein O1, FoxO1)途径[76],并调节miR-20b/SMAD 家族成员7(SMAD family member 7, SMAD7)轴[77],提高肝葡萄糖利用率、肌肉葡萄糖摄取和脂肪,提高胰岛素敏感性和抵抗力,从而改善糖尿病的胰岛素抵抗。此外,大黄素0.02, 0.04, 0.08 µg/mL 处理LO2 人正常肝细胞24 h 可通过刺激FXR/胆盐输出泵(bile salt export pump, BSEP)途径,增加BSEP和FXR 的mRNA和蛋白表达以缓解肝内胆汁淤积,促进积聚胆汁的排出,对胆汁淤积具有保护作用[78]。
10 总结与展望
目前大黄素已被证明具有抗肿瘤、抗炎和抗氧化、抗菌和抗病毒、心肌保护、神经保护等多种药理活性,具有广阔的应用前景。大黄素的抗肿瘤作用是国内外学者的研究重点之一,体内外研究表明,大黄素对肝癌、结肠癌、非小细胞肺癌、胰腺癌等多种癌症具有较好的治疗作用,主要通过调节 PI3K/Akt、IKKβ/NF- κB、MAPKs、Wnt/β-catenin 等信号通路,重点影响Bcl-2、caspase-3、Ncadherin、E-cadherin、MMP-7等相关因子表达,发挥促进细胞凋亡,抑制上皮-间质转变、细胞迁移和抗血管生成等活性(如图2所示)。此外,大黄素通过多条信号通路发挥抗炎、免疫调节、抗菌抗病毒、心肌保护、神经保护等活性(如图3 所示),其中以AMPK、NF-κB、ERK1/2等途径报道最多。

图2 大黄素抗肿瘤作用机制示意图
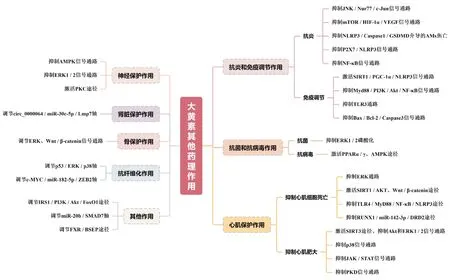
图3 大黄素其他药理作用及调节信号途径总结
然而大黄素的研究过程中仍存在一些需要进一步探讨和阐释的问题。首先,大黄素抗肿瘤活性的基础研究近5年主要集中于细胞水平,在动物模型上的研究较少,缺乏体内实验数据。同时,在现有报道中,大黄素的相关作用机制涉及的关键靶点研究主要集中于抗肿瘤方面,目前识别的大黄素直接作用靶点ACSL4,通过分子对接以及MST测试了大黄素与ACSL4 结合性能,并采用ACSL4 过表实验进行了验证,结论相对较为全面、可靠。而其他有关靶点与大黄素的结合情况目前尚缺乏充足的技术手段验证,不足以证实大黄素直接作用于该靶点发挥抗肿瘤活性。如大黄素与sPLA2-IIA 的分子对接结果表明,大黄素与sPLA2-IIA 的残基GLY29、GLY31 和ASP48 形成氢键,结合能为-(5.84 ± 0.25) kcal/mol(1 kcal = 4.184 kJ),但仅为计算机虚拟结果;大黄素与NCOR2 的对接结果显示,大黄素可以与NCOR2的残基Tyr39、Lys10形成氢键,体外下拉实验进一步提示,二者在体外条件下之间存在相互作用,但并未验证在生理条件下两者的结合能力。今后可进一步考虑以大黄素为分子探针,综合应用系列亲和色谱技术、生物素标记等多种方法识别大黄素的结合蛋白,并应用表面等离子共振技术、MST 等方法测定其结合能力,再应用结合蛋白的干扰或过表达质粒或制备敲除动物进一步加以确证。另据报道,大黄素高剂量和长期使用有肝毒性和肾毒性[79],因此,本文重点关注了文献报道中大黄素的使用剂量,体外研究多选择5 ~ 40 µmol/L 范围的大黄素处理细胞,体内研究给药剂量多为5 ~ 60 mg/kg,大黄素对于不同类型细胞所导致毒性的浓度范围存在一定差异。另外大黄素生物利用度低也是限制其应用的原因之一,目前报道纳米载体递送的方法可提高大黄素的口服利用率,但仍需进一步摸索和优化,未来寻找高效低毒的大黄素衍生物有待进一步研究[80]。

