稀有人参皂苷对特发性肺纤维化的影响
姚 磊,屈琳琳,范代娣*
(1西北大学化工学院,西安 710069;2西北大学生物医药研究院,西安 710069)
特发性肺纤维化(idiopathic pulmonary fibrosis,IPF)是一种慢性进展的纤维化间质性肺炎,其特征是肺功能下降[1],但是因其病因不明,没有较好的治疗方法,导致患者的病死率较高,平均生存期仅有2 ~ 3 年[2]。此外,在过去的几十年里,这种疾病的发病率逐年增加[3],在治疗方法上,临床主要使用的是激素类药物、免疫抑制剂和抗氧化类药物治疗IPF[4],但是效果并不明显,且长期使用药物的不良反应大[5]。而对于终末期的IPF 患者,最有效的方法是肺移植[6],但由于供体不足和价格昂贵,在临床应用方面受到了很大的限制。因此,寻找安全高效缓解IPF药物迫在眉睫。
在中药中,人参(Panaxginseng)是一种性能优良的稀有药材。它具有疗效高、性质温和、不良反应小、安全性高等特点,在医疗保健等方面得到了广泛的青睐[7]。人参在传统中草药体系中有极大的应用价值[8]。多项研究证实,人参可以治疗多种疾病,如糖尿病[9]、神经性疾病[10-11]、肠道溃疡[12]、炎症[13]以及各种肿瘤[14-15]。目前已分离的人参主要活性成分有人参皂苷、多肽、多糖、黄酮类化合物等[16-17],其中人参皂苷含量丰富,活性高,受到广泛关注。研究证实,人参总皂苷能够调控TGF-β1/Smad信号通路和MMP 途径改善博来霉素诱导的IPF 模型,其中,人参总皂苷通过下调金属蛋白酶-1、MMP-2、MMP-9、Smad2、Smad3 以及TGF-β1,上调Smad7 的表达改善IPF[18];此外,人参皂苷Rg1 可以通过抑制TGF-β1/Smad 途径缓解烟雾诱导的气道纤维化[19];人参皂苷Rg3 可以通过抑制HIF-1α 的核定位来缓解IPF导致的肺功能衰退[20]。
因此,本研究分别通过体内外IPF 模型,通过检测羟脯氨酸(hydroxyproline,HYP)含量及纤维化相关基因表达量探究稀有人参皂苷对IPF的影响。
1 材 料
1.1 试 剂
注射用博来霉素(bleomycin,BLM,批号:H20055883,瀚辉制药有限公司);HYP 试剂盒(货号:BC0255,北京索莱宝科技有限公司);转化生长因子(transforming growth factor,TGF- β1,美国Pepro Tech 公司);Trizol、第一链反转录试剂盒(美国Thermo Fisher 公司);氯仿、异丙醇(阿拉丁控股集团有限公司);qPCR 试剂盒(瑞士Roche 公司);稀有人参皂苷Rk1、Rk3、Rh4、Rg5(纯度≥98%,通过HPLC 与标准品进行对比)由西北大学生物医药研究院提供。
1.2 仪 器
TS100 倒置荧光显微镜(日本Nikon 公司);TGL16-WS 台式高速离心机(美国贝克曼公司);PS100 超声波清洗机(宁波恒大设备公司);XS2 酶标仪(美国BioTek 公司);TEC2800 石蜡包埋机(上海精密仪器仪表公司);YD-1508A 组织切片机(北京佳源兴业科技有限公司)。
1.3 细胞与动物
人胚肺成纤维细胞MRC-5(上海富恒生物科技有限公司); SPF 级C57BL/6 小鼠,雄性,周龄为6 ~ 8周,体重(20 ± 2)g,购自江苏集萃药康生物科技股份有限公司。本课题中动物实验严格按照《中华人民共和国动物伦理指南》操作,获西北大学动物伦理委员会批准(批准号:NWU-AWC-20220903M)。
2 方 法
2.1 细胞培养与IPF模型建立
MRC-5 细胞在MEM 培养基中培养,二氧化碳培养箱设置为37 ℃、5% CO2和95%湿度,每2天传代1次,传代比例为1∶2。
使用转化生长因子β1(TGF-β1,10 ng/mL)处理MRC-5细胞24 h,诱导建立特发性肺纤维化模型。
2.2 MTT法检测细胞毒性
将细胞收集后使用血细胞计数板进行计数,调整细胞浓度至每毫升1 × 105个细胞,将调整好浓度的细胞悬液均匀铺在96孔板中,布板结束后,放入37 ℃培养箱培养24 h 后,将稀有人参皂苷单体粉末进行溶解、稀释,加入96 孔板中继续培养24 h。去除培养液,随后向每孔加入MTT 溶液150µL,放入培养箱孵育2 ~ 4 h,孵育结束后,去除MTT 溶液,随后向每孔加入二甲基亚砜(DMSO)溶液150 µL,使用酶标仪测量490 nm 的波长下的吸收度。
2.3 IPF小鼠模型的建立及分组处理
100 只SPF 级雄性C57BL/6 小鼠随机分组,每组10只。分别为对照组、BLM 组(35 IU/g)、低剂量Rk1(60 mg/kg)+BLM 组、高剂量Rk1(120 mg/kg)+BLM 组、低剂量Rk3(60 mg/kg)+BLM 组、高剂量Rk3(120 mg/kg)+BLM 组、低剂量Rh4(60 mg/kg)+BLM 组、高剂量Rh4(120 mg/kg)+BLM 组、低剂量Rg5(60 mg/kg)+BLM 组、高剂量Rg5(120 mg/kg)+BLM 组。除对照组外其余小鼠均腹腔注射BLM(35 IU/g)28 d 以构建IPF 模型[21]。对照组采用同等剂量生理盐水腹腔注射。造模开始第2 天治疗组通过灌胃的方式给予稀有人参皂苷,对照组和模型组分别灌胃生理盐水。连续灌胃给药28 d 后处死小鼠,取小鼠肺脏组织,经液氮快速冷冻后移至-80 ℃超低温冰箱保存备用。
2.4 小鼠肺组织病理学检查
将动物实验小鼠的肺脏组织解剖后放入多聚甲醛中进行固定,48 h 后使用不同浓度的乙醇处理,去除肺脏中的水分。将组织中的水分去除干净后,利用二甲苯溶液处理组织,使其浸透过夜。将已经泡到透明的组织浸于提前预热融化的石蜡中,进行浸蜡处理,随后放入包埋石蜡中,进行包埋处理,包埋完成后即进行切片。
对切片组织使用二甲苯溶液进行脱蜡处理,脱蜡结束后用清水冲洗,随后利用苏木精染色试剂进行染色处理,染色时长为10 min。结束染色后,再次利用清水进行冲洗,冲洗后进行脱水处理。脱水处理后,使用伊红染色液对切片进行染色,染色时长为5 min。再次脱水,透明,封片。放入通风橱进行风干,待风干完全后即可于光学显微镜下进行观察。
2.5 HYP含量测定
对于动物组织样本,称取样本0.2 g 于玻璃管,将组织尽量剪碎以便消化,加入提取液2 mL;对于细胞样本,计数后收集细胞5 × 106个,加入提取液1 mL。随后将其放入沸水中,消化至没有可见大的团块,冷却后用NaOH(10 mol/L)调节pH 至6 ~ 8,使用蒸馏水定容至4 mL。最后放入离心机(4 ℃、12 000 r/min),离心20 min,取上清液待测。依照说明书分别稀释标准品与样品,利用酶标仪测量490 nm下的吸收度。
2.6 实时荧光定量PCR(RT-qPCR)
对于细胞样本,向处理后的MRC-5 细胞每孔加入Trizol 溶液1 mL,在冰上裂解5 ~ 10 min,随后转移至无酶EP 管;对于组织样本,取小鼠肺部组织50 mg 于研磨管中,加入研磨珠3 ~ 5 颗,向管中加入Trizol 溶液1 mL 放入研磨机中。随后放入25 ℃水浴锅中进行水浴5 ~ 10 min,向管中加入氯仿200 µL,混匀后再次25 ℃水浴10 min,水浴后放入离心机(4 ℃、12 000 r/min)离心15 min,收集上层液相350 µL 至新的EP 管中,加入异丙醇500 µL,混匀后25 ℃水浴10 min,随后放入离心机(4 ℃、12 000 r/min)离心15 min,弃去上清液,加入提前用无菌无酶水配置的75%乙醇,混匀后25 ℃水浴5 min,放入离心机(4 ℃、7 000 r/min)离心5 min,弃去上清液,风干后加无菌无酶水溶解。随后使用逆转录试剂盒将提出来的RNA 反转录为cDNA。使用cDNA 进行RT-qPCR 实验,所得到的Cq 用2-ΔΔCT法计算,选用GAPDH 作为内参,目标基因引物和内参基因引物序列如表1所述。

Table 1 RT-qPCR primer sequences
2.7 统计学分析
使用GraphPad Prism 9.0 和IBM SPSS Statistics 21.0 进行数据处理。所有实验独立重复3 次,实验结果以±s的形式表示。P< 0.05 即认为结果具有显著性,有统计学意义。
3 结果与分析
3.1 稀有人参皂苷细胞模型浓度筛选
通过二苯基四氮唑溴盐比色法分析4 种稀有人参皂苷对MRC-5的细胞毒性,结果见图1。由图1可知,当人参皂苷Rk1、Rk3、Rh4和Rg5浓度小于0.5 µmol/L 时,MRC-5 细胞的活力大于90%,因此后续细胞实验人参皂苷使用浓度为0.5 µmol/L。
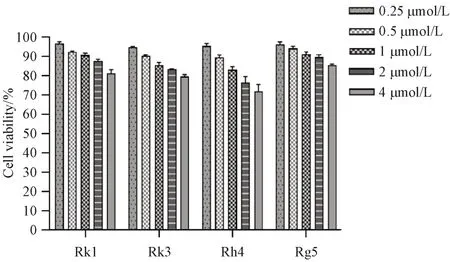
Figure 1 Effects of concentrations of rare ginsenosides (Rk1, Rk3,Rh4, Rg5) on the viability of MRC-5 cells (±s, n = 3)
3.2 对BLM 诱导的IPF 小鼠肺组织病理变化的影响
小鼠肺组织切片染色结果如图2所示,对照组小鼠的肺脏组织支气管结构无明显异常,肺泡壁由单层上皮细胞组成,结构清晰,肺泡壁没有出现增厚,肺泡腔内无明显渗出物,也没有明显的炎症细胞浸润;肺间质包括肺内结缔组织及血管等均无明显异常;与对照组相比,BLM 组小鼠肺间质较多结缔组织增生,肺泡壁出现明显增厚现象,肺泡结构不清,伴有粒细胞浸润;可见血管周围淋巴细胞灶性浸润;支气管上皮细胞变性。通过灌胃给予稀有人参皂苷后,可以发现IPF 小鼠的肺泡壁破坏有所改善,淋巴细胞浸润减少,巨噬细胞与粒细胞数量显著减少。其中Rh4的效果最为显著。

Figure 2 Lung sections of mice at day 28 after bleomycin (BLM) induction (HE staining)
3.3 对肺纤维化模型中HYP含量的影响
小鼠肺组织HYP 含量结果如图3 所示,BLM组与对照组相比,BLM 诱导的小鼠肺组织中的HYP 含量显著提高,给予人参皂苷后,HYP 含量显著降低。其中,Rh4 降低IPF 模型中的HYP 含量的效果最明显。

Figure 3 Effects of different concentrations of rare ginsenosides(Rk1, Rk3, Rh4, Rg5) on HYP content in lung tissue of IPF mice after BLM modeling (±s, n = 3)
3.4 对IPF纤维化相关基因表达的影响
使用TGF-β1 诱导MRC-5 构建细胞IPF 模型。MRC-5 细胞中IPF 相关基因表达量如图4。由图4可知,TGF-β1 组与对照组相比,TGF-β1 诱导的MRC-5细胞中COL1A1、纤维连接蛋白与α-SMA 的mRNA 表达量明显增加;Rk1, Rk3, Rh4, Rg5 组与TGF-β1 组相比,4 种人参皂苷均可以降低MRC-5细胞中COL1A1、纤维连接蛋白与α-SMA 的mRNA表达量;其中Rh4组的效果最为显著。

Figure 4 Effect of rare ginsenosides (Rk1, Rk3, Rh4, Rg5) on the expression level of fibrosis-related genes in IPF of MRC-5 after TGF-β 1 modeling (±s, n = 3)
使用腹腔注射BLM 构建小鼠IPF 模型,小鼠肺组织中IPF 相关基因表达量如图5。由图5 可知,BLM组与对照组相比,BLM诱导的IPF小鼠肺部组织中COL1A1、纤维连接蛋白与α-SMA 的mRNA 表达量增加;Rk1, Rk3, Rh4, Rg5 组与BLM 组相比,加入人参皂苷后显著降低了COL1A1、纤维连接蛋白与α-SMA 的mRNA 表达量。其中Rh4 组的效果最为显著。

Figure 5 Effect of rare ginsenosides (Rk1, Rk3, Rh4, Rg5) on IPFrelated mRNA expression in lung tissue of mice after BLM modeling(±s, n = 3)
3.5 对IPF炎症相关基因表达的影响
使用TGF-β1 诱导MRC-5 构建细胞IPF 模型。MRC-5 细胞中IPF 的炎症相关基因表达量如图6。由图6可知,TGF-β1组与对照组相比,TGF-β1诱导的MRC-5 细胞中IL-6 和TNF-α 的mRNA 表达量明显增加;Rk1, Rk3, Rh4, Rg5 组与TGF-β1 组相比,4 种人参皂苷均可以降低MRC-5 细胞中IL-6 和TNF-α 的mRNA 表达量;其中Rh4 组的效果最为显著。

Figure 6 Effect of rare ginsenosides (Rk1, Rk3, Rh4, Rg5) on expression levels of inflammatory genes in IPF in MRC-5 modeled by TGF-β1(±s, n = 3)
使用腹腔注射BLM 构建小鼠IPF 模型,小鼠肺组织中IPF 的炎症相关基因表达量如图7。由图7可知,BLM 组与对照组相比,BLM 诱导的IPF 小鼠肺部组织中IL-6 和TNF-α 的mRNA 表达量增加;Rk1, Rk3, Rh4, Rg5 组与BLM 组相比,加入人参皂苷后显著降低了IL-6和TNF-α的mRNA表达量。

Figure 7 Effect of rare ginsenosides (Rk1, Rk3, Rh4, Rg5) on expression levels of inflammatory genes in IPF in MRC-5 modeled by BLM(±s, n = 3)
3.6 对IPF凝血级联相关基因表达的影响
使用TGF-β1 诱导MRC-5 构建细胞IPF 模型。MRC-5 细胞中IPF 的凝血级联相关基因表达量如图8。由图8 可知,TGF-β1 组与对照组相比,TGFβ1 诱导的MRC-5 细胞中Factor X 和plasminogen 的mRNA 表达量明显增加;Rk1, Rk3, Rh4, Rg5 组与TGF-β1 组相比,4 种人参皂苷均可以降低MRC-5细胞中Factor X 和plasminogen的mRNA表达量;其中Rh4组的效果最为显著。

Figure 8 Effect of rare ginsenosides (Rk1, Rk3, Rh4, Rg5) on coagulation cascade mRNA expression in lung tissue of mice after TGF-β1 modeling (±s, n = 3)
使用腹腔注射BLM 构建小鼠IPF 模型,小鼠肺组织中IPF的凝血级联相关基因表达量如图9。由图9 可知,BLM 组与对照组相比,BLM 诱导的IPF小鼠肺部组织中Factor X 和plasminogen 的mRNA表达量增加;Rk1, Rk3, Rh4, Rg5 组与BLM 组相比,加入人参皂苷后显著降低了Factor X 和plasminogen的mRNA表达量。

Figure 9 Effect of rare ginsenosides (Rk1, Rk3, Rh4, Rg5) on coagulation cascade mRNA expression in lung tissue of mice after BLM modeling (±s, n = 3)
4 讨论与结论
本研究的IPF 模型采用腹腔注射BLM(35 IU/g)28 d[21],建模完成后,通过HE 染色可知,BLM 诱导的IPF 小鼠肺部组织的肺泡壁增厚,伴有粒细胞浸润,以及淋巴细胞灶性浸润等,这与IPF 的病理进程基本一致,表明IPF 模型建立成功,然而加入稀有人参皂苷后,IPF 引起的肺泡结构破坏等病理进程得到了缓解。
HYP 作为胶原纤维的标志性水解产物,HYP的含量可以直接反应胶原的沉积情况,胶原蛋白的过度沉积是纤维化疾病的主要特征。因为HYP是胶原所特有的氨基酸,约占胶原氨基酸总量的13%,利用生物化学法(如比色法和高效液相色谱法)测定组织中HYP 的总含量已经成为纤维化严重程度评价最常用的方法,该方法在2017 年被美国胸科协会确立为肺纤维化临床前评价的重要标准[22]。本研究通过测定发现,TGF-β1 组的MRC-5细胞与BLM组的小鼠肺部组织中HYP含量显著增加,加入稀有人参皂苷后,HYP含量显著降低。
研究发现,凝血级联(coagulation cascade)指的是在受损的血管处产生纤维蛋白进而防止失血过度[23]。在伤口愈合的初期,内皮与上皮损伤均可以激活凝血级联反应,从而产生凝血酶,紧接着凝血酶使血清中的纤维蛋白原转变为纤维蛋白[24]。研究证明,凝血级联与IPF 患者肺部组织中的纤维蛋白沉积关系密切,在IPF 患者肺部组织中发现外源性凝血级联和纤溶酶的几种酶原(Factor X、plasminogen)被激活[25]。研究表明,IPF 患者的肺泡灌洗液中促凝血因子增加,导致ECM 沉降减少[26];同时蛋白酶激活受体诱导成纤维细胞分化为肌成纤维细胞,从而加剧了IPF。本研究发现TGF-β1 诱导的MRC-5细胞与BLM 诱导的小鼠肺部组织中纤维化相关蛋白基因(如:COL1A1、α-SMA 和纤维连接蛋白)、炎症相关基因(如:IL-6和TNF-α)和凝血级联相关基因(如:Factor X 和plasminogen)的表达量均有明显增加,加入稀有人参皂苷后,纤维连接蛋白、COL1A1、α-SMA、IL-6、TNF-α、Factor X 和plasminogen的基因表达量均有明显下降。
综上所述,稀有人参皂苷(Rk1、Rk3、Rh4、Rg5)均可以通过降低HYP 含量,下调纤维连接蛋白、COL1A1、α-SMA、IL-6、TNF-α、Factor X 和plasminogen 的基因表达缓解IPF。其中,稀有人参皂苷Rh4 的效果最为显著。本研究为稀有人参皂苷缓解IPF 进程提供了理论依据,并为今后的临床应用提供了需要改进的方向和数据支持。

