肝素寡糖抑制CoCl2诱导的HUVEC细胞糖酵解及其机制
秦誉宁,姚宇豪,RUBAYIZA Joshua,何书英
(中国药科大学生命科学与技术学院,南京 211198)
肝素主要用于临床上抗血栓治疗。相关证据表明,使用肝素及低分子肝素可以为肿瘤患者带来更大的生存优势,其通过抑制细胞增殖、迁移、血管生成等非凝血途径发挥治疗作用[1]。Afratis等[2]发现肝素衍生物在体外和体内模型中可以调节细胞外基质(extracellular matrix,ECM)的表达来显著降低乳腺癌细胞增殖和转移。但由于肝素结构的多样性和相对分子质量的多分散性,临床使用上会发生出血、血小板减少症等不良反应,限制了其在肿瘤治疗方面的应用[3]。而超低分子肝素和低分子肝素(low molecular weight heparin,LMWHs)是在未分级肝素的基础上对其进行降解分离纯化所得到的一类低聚糖混合物,与肝素相比,具有更低的抗凝活性和更小的不良反应。故近年来LMWHs 因其多样化的抗肿瘤活性从而在肿瘤治疗中引起了人们的广泛关注[4]。
肝素寡糖(heparin-derived oligosaccharide,HDO)是指由未分级肝素降解并分离纯化得到的一种低和窄相对分子质量分布的寡糖片段。前期研究发现实验室自制的HDO[5]可以抑制小鼠黑色素瘤模型中血清血管内皮生长因子(vascular endothelial growth factor,VEGF)的分泌及肿瘤的成管活性,并且对黑色素瘤肺转移具有抑制作用。除了VEGF介导的血管生成途径,HDO是否还通过其他潜在靶点发挥抗肿瘤活性还有待进一步研究。缺氧及缺氧诱导因子1(hypoxia-inducible factors-1,HIF-1)是促使VEGF 表达增加的主要驱动因素,介导肿瘤内皮细胞的活化及血管生成[6]。此外,缺氧促使细胞启动代谢重编程,显著上调细胞糖酵解能力,介导肿瘤细胞转移侵袭确保肿瘤进展[7]。血管内皮细胞是肿瘤微环境中一类重要的细胞类型,为肿瘤提供生长所需的氧气和营养,也为肿瘤转移提供了途径。人脐静脉血管内皮细胞(human umbilical vein endothelial cells,HUVEC)常用于研究低氧、炎症、感染反应以及肿瘤相关血管生成等。该细胞主要供能方式是有氧糖酵解,因此本研究使用化学缺氧模拟剂CoCl2刺激HUVEC 细胞,拟探究在缺氧环境下,HDO 是否通过参与HIF-1 介导的糖酵解途径来发挥抗肿瘤活性。本研究首先检测了细胞葡萄糖摄取、乳酸积累、GLUT-1及LDHA 的表达来探究HDO 对HUVEC 细胞缺氧糖酵解的影响,之后通过对PI3K/Akt/HIF-1α 信号轴的检测来初步探讨HDO 缓解HUVEC 细胞缺氧糖酵解的潜在分子机制,为进一步推进肝素寡糖成为抗肿瘤药物提供新的理论依据。
1 材 料
1.1 试 剂
HDO(实验室自制,3.2 kD);CoCl2·6H2O(国药集团化学试剂有限公司);高糖DMEM 培养基、FBS、胰蛋白酶(美国Gibco 公司);胰蛋白酶(安徽Biosharp 生物公司);葡萄糖测试盒、乳酸测试盒、乳酸脱氢酶测试盒(南京建成生物工程研究所);β-actin 抗体、抗GLUT-1 抗体、抗LDHA 抗体、抗PI3K 抗体、抗Akt抗体、抗p-Akt抗体、抗HIF-1α 抗体、HRP 标记山羊抗兔二抗(美国Immunoway 公司);0.45 µm 聚偏氟乙烯(polyvinylidene fluoride,PVDF)膜、青霉素-链霉素双抗溶液、ECL 化学发光液、BCA 蛋白定量试剂盒、预染蛋白质分子量标准(Marker)、RIPA 裂解液强(上海碧云天生物公司);TriQuick 总RNA 提取试剂(北京索莱宝公司);180 kD 预染蛋白质Marker、蛋白胶预混液(10%)、HiScript Ⅲ 1st Strand cDNA 合成试剂盒、ChamQ Universal SYBR qPCR Master Mix(南京诺唯赞生物公司),其他试剂均为市售分析纯。
1.2 仪 器
Biofuge Stratos 高速冷冻离心机、QuantStudio 3实时荧光定量PCR 仪、Nanodrop 2000 超微量分光光度计、Multiskan FC 酶标仪(美国Thermo 公司);T100 梯度PCR 仪(美国Bio-Rad 公司);Tanon 5200全自动化学发光分析系统(上海Tanon 公司)。
2 方 法
2.1 细胞培养分组及缺氧模型建立
HUVEC 细胞在含10% FBS 的高糖DMEM 培养基中培养,培养箱参数设置为37 ℃、5% CO2、饱和湿度。传代周期:2 ~ 3 d。
实验分为对照(control)组(无血清DMEM 培养基)、模型(model)组(无血清DMEM 培养基+50µmol/L CoCl2)及HDO 给药组(模型组基础上分别添加0.01、0.1、1 µmol/L HDO)。将处于对数生长期且状态良好的HUVEC 细胞常规消化处理,并调整细胞密度铺6 孔板,待细胞贴壁生长至70% ~80%融合时,弃去旧培养基并分别加入各分组培养基。继续培养24 h,进行后续实验。
2.2 葡萄糖摄取和乳酸含量的检测
细胞培养和分组情况同“2.1”项。细胞处理24 h 后,收集各组细胞培养上清液,1 000 r/min,离心5 min,吸取上清液,分别使用葡萄糖测试盒和乳酸测试盒测定计算葡萄糖摄取量和乳酸含量。
2.3 乳酸脱氢酶活力的检测
细胞培养和分组情况同“2.1”项。细胞处理24 h 后,胰酶消化收集各组细胞并用PBS 清洗2次,随后每组细胞加入PBS 溶液0.2 mL,冰浴,超声破碎裂解细胞,功率300 W,每次4 s,重复3 次,间隔30 s。随后取细胞匀浆液按照BCA 法测定蛋白浓度,并使用乳酸脱氢酶测试盒测定计算乳酸脱氢酶酶活力。
2.4 蛋白质免疫印迹实验
细胞培养及分组情况同“2.1”项。细胞处理24 h 后,胰酶消化收集各组细胞,用预冷PBS 洗涤细胞2 次,3 000 r/min,4 ℃离心10 min,弃去上清液;加入含蛋白酶抑制剂和磷酸酶抑制剂的RIPA细胞裂解液,提取细胞总蛋白;采用BCA 法测定蛋白含量;之后按照蛋白胶预混液试剂盒说明书进行 SDS-PAGE 电泳;电泳结束后立即转移蛋白至PVDF 膜; 5%脱脂奶粉室温封闭2 h;4 ℃ 孵育HIF-1α、GLUT-1、LDHA、PI3K、Akt、p-Akt 一抗(稀释比1∶500)过夜;TBST 洗膜4 次,每次5 min;室温孵育二抗(稀释比1∶5 000)1 h;TBST 洗膜4 次,每次5 min;加ECL 曝光液用化学发光分析系统采集图像。
2.5 RNA分离提取及qRT-PCR
细胞培养及分组情况同“2.1”项。细胞处理24 h 后,按照TriQuick 总RNA 提取试剂说明书提取细胞总RNA,采用Nanodrop 测定浓度及纯度,使用逆转录试剂按照说明书将RNA逆转录为cDNA,在NCBI 上查找各目的基因mRNA 序列,设计引物序列如表1,由生工生物公司合成序列。按照ChamQ Universal SYBR qPCR Master Mix 说明书进行qPCR反应,设 3个复孔。
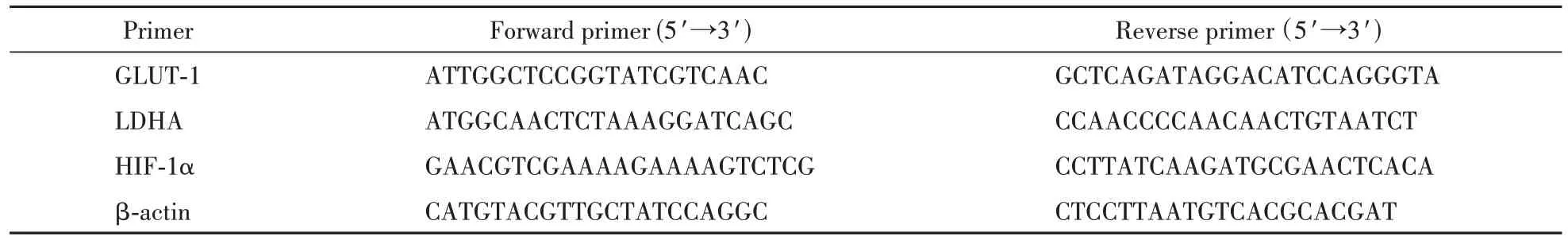
Table 1 Primer sequences
2.6 数据统计与分析
以上所有实验数据均使用GraphPad Prism 5.0进行统计分析和作图,每组数据以均值±标准误差表示,两组独立样本之间使用t检验进行显著性差异分析,P< 0.05认为有统计学意义。
3 结 果
3.1 肝素寡糖抑制缺氧HUVEC 细胞的葡萄糖摄取
在肿瘤细胞、快速增殖的组织细胞及缺氧环境下的正常细胞中,细胞需要从外部摄取更多葡萄糖用于支持自身对能量的过度需求[8]。葡萄糖摄取在临床上被利用来诊断癌症,或通过利用放射性标记的葡萄糖类似物评估肿瘤反应[9]。使用CoCl2缺氧刺激HUVEC细胞,观察到细胞对葡萄糖的摄取量明显升高(P< 0.05),而在缺氧条件下加入不同浓度HDO 药物处理后,可以呈剂量依赖性地抑制葡萄糖的摄取能力。0.1、1 µmol/L HDO 的抑制率分别为47.7%与47.0%(图1)。

Figure 1 Heparin-derived oligosaccharide (HDO) inhibited glucose uptake in hypoxic HUVEC cells (xˉ± s, n = 3)
3.2 肝素寡糖抑制缺氧HUVEC细胞的乳酸积累
乳酸是糖酵解的代谢产物,能以多种方式促进肿瘤进展,包括促肿瘤生长转移、血管生成、肿瘤浸润与肿瘤免疫等[10-11]。与常氧相比,缺氧刺激会显著上调HUVEC 细胞的乳酸含量(P< 0.01),而不同浓度HDO 药物作用后可以不同程度地抑制乳酸积累(P< 0.05)从而抑制HUVEC 细胞的糖酵解水平达到缓解肿瘤侵袭的作用,0.01、0.1、1 µmol/L HDO 对乳酸积累的抑制率分别为18.8%,18.2%和15.9%(图2)。

Figure 2 HDO inhibited lactic acid accumulationin in hypoxic HUVEC cells (xˉ± s, n = 3)
3.3 肝素寡糖抑制缺氧HUVEC 细胞中GLUT-1的表达
GLUT-1的高水平表达与肿瘤细胞的恶性生长和不良预后密切相关[12],如图显示,与对照组相比,模型组诱导HUVEC 细胞缺氧后,GLUT-1的mRNA相对表达量被显著上调,在不同浓度HDO 药物作用后,由于缺氧上调的GLUT-1 的基因转录水平均得到了不同程度的逆转(图3-A)。而在蛋白表达水平上,同模型组相比,低浓度及中浓度HDO作用后可以下调GLUT-1的蛋白表达,高浓度的HDO治疗组并没有显著抑制GLUT-1 蛋白表达的效果(图3-B,3-C)。以上结果说明,HDO 可以通过下调HUVEC 细胞中GLUT-1 的基因转录和蛋白表达水平来抑制HUVEC 细胞对葡萄糖的摄取能力从而影响细胞自身的能量供应。
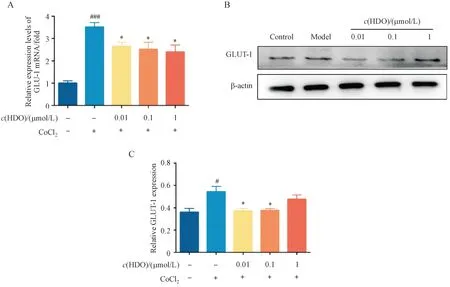
Figure 3 HDO inhibited the expression of GLUT-1 in hypoxic HUVEC cells (xˉ± s, n = 3)
3.4 肝素寡糖对HUVEC细胞LDHA表达的影响
LDH 催化糖酵解途径的最后一步,可以将丙酮酸转化为乳酸。研究证明,LDHA 在许多类型的癌症中过度表达,靶向LDHA 会抑制肿瘤进展[13]。HUVEC 细胞被CoCl2缺氧刺激后与对照组相比,LDHA 的mRNA 水平显著升高,在缺氧条件下经过HDO 药物作用24 h 后,仅低浓度HDO 处理组可以显著下调LDHA的mRNA水平,中浓度与高浓度给药组对LDHA 基因转录水平没有显著影响(图4-A)。在蛋白表达水平上,仅中浓度HDO 处理组可以显著逆转由于缺氧刺激导致的HUVEC 细胞LDHA 蛋白相对表达量的上调(图4-B,4-C)。CoCl2处理HUVEC 细胞后可以显著上调LDH 酶活力,经过不同浓度HDO药物治疗后可以不同程度地抑制LDH 酶活力(图4-D)。该结果说明HDO 可以通过调控LDHA 的mRNA 和蛋白的相对表达量及影响LDH 的酶活力来下调HUVEC 细胞乳酸的生成量,从而缓解肿瘤局部浸润与侵袭进展。
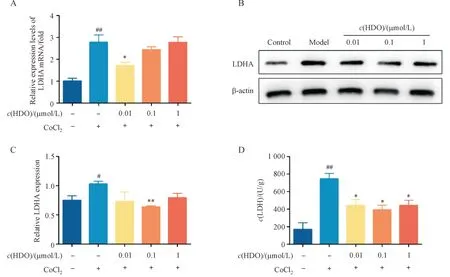
Figure 4 HDO inhibited the expression of LDHA in hypoxic HUVEC cells xˉ± s, n = 3)
3.5 肝素寡糖抑制缺氧HUVEC细胞中HIF-1α的表达
HIF-1 是细胞适应氧稳态的主要调节因子,HIF-1α 在常氧中几乎不表达,而缺氧会诱导HIF-1α 的发生从而与稳定表达的HIF-1β 形成复合物,该复合物进一步通过与下游靶基因启动子上的缺氧反应元件结合调控细胞内诸多基因的转录表达从而使细胞适应缺氧环境。缺氧刺激HUVEC 细胞24 h可以显著升高HIF-1α的mRNA 相对表达水平,而HDO 治疗后可以抑制缺氧导致的HIF-1α mRNA 相对表达水平的上调并且这种抑制作用具有剂量依赖性(图5-A)。在蛋白表达水平上,对照组常氧环境下,HUVEC 细胞中HIF-1α 的蛋白表达水平极低,在细胞经过CoCl2缺氧诱导后HIF-1α 的蛋白表达水平被显著上调,但在不同浓度HDO 药物治疗作用后,由缺氧刺激导致的HIF-1α 蛋白表达水平升高被不同程度地逆转(图5-B,5-C)。
Figure 5 HDO inhibited the expression of HIF-1α in hypoxic HUVEC cells (xˉ± s, n = 3)
3.6 肝素寡糖抑制缺氧HUVEC 细胞中PI3K/Akt信号通路的激活
PI3K/Akt 在许多细胞中介导细胞增殖、代谢及炎症等多种病理生理过程。许多靶向PI3K/Akt通路的抑制剂已经显示出下调HIF-1表达的作用。PI3K-Akt 通路与血管生成及细胞糖酵解之间的联系已在许多研究中得到证实。因此本研究接下来通过Western blot 实验,检测HDO 对缺氧HUVEC细胞中PI3K/Akt通路的影响。CoCl2缺氧刺激可以显著诱导HUVEC 细胞中PI3K 的表达及Akt 的磷酸化,在加入HDO 药物治疗后可以显著抑制PI3K/Akt通路的激活,其中高浓度HDO的抑制效果最好(图6)。由此可见PI3K/Akt 通路确实参与并促使了CoCl2诱导的HUVEC 细胞的异常损伤,而HDO可以通过影响PI3K/Akt 通路的激活来减轻HUVEC细胞的损伤程度。
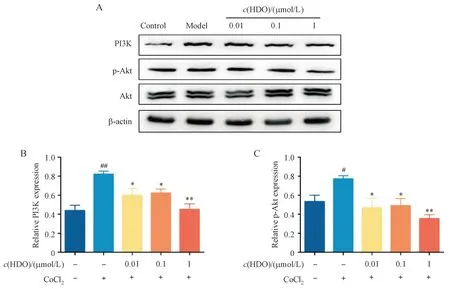
Figure 6 HDO inhibited the activation of PI3K/Akt signaling pathway in hypoxic HUVEC cells (xˉ± s, n = 3)
4 讨 论
在肿瘤细胞、快速增殖的组织细胞及处于缺氧环境下的正常细胞会利用糖酵解作为主要的供能方式。该方式可以将细胞摄入的大量葡萄糖转化为乳酸从而满足细胞的能量需求及合成代谢需求,此外,细胞糖酵解过程中产生的大量乳酸可以分解破坏细胞外基质促使细胞侵袭转移[14]。缺氧和HIF会影响肿瘤细胞代谢途径,参与葡萄糖摄取和糖酵解过程的许多酶都是HIF的靶基因,通过上调相关酶的表达以进一步增加肿瘤细胞糖酵解能力,从而促使肿瘤细胞增殖存活,并更具侵袭性,显示出更差的预后[15]。
大量数据表明肝素及低相对分子质量肝素具有抗凝活性以外的抗肿瘤活性。前期实验室通过亚硝酸降解未分级肝素并分离纯化后得到一种相对分子质量约为3 200 的十二糖片段——肝素寡糖(HDO),并表明此HDO具有抑制内皮细胞增殖、迁移及血管生成的作用[16-17],而本研究则探讨了此HDO 对HUVEC 细胞缺氧糖酵解的影响,进一步为其成为抗肿瘤药物提供一部分理论依据。
GLUT-1 是一种限速葡萄糖转运蛋白,可以将胞外葡萄糖运输至胞内,在肿瘤细胞及增殖迅速的正常细胞中GLUT1的过表达与细胞的侵袭与转移密切相关[18]。此外,在缺氧的情况下,葡萄糖分解生成的丙酮酸会在乳酸脱氢酶(LDH)的作用下被还原为无氧糖酵解的最终产物——乳酸。研究表明,LDHA 在肿瘤细胞中通常被显著上调,而靶向抑制LDHA 会减弱肿瘤的生长和转移[19-21]。而HDO 可以抑制缺氧HUVEC 细胞中GLUT-1 及LDHA 的表达进一步下调细胞对胞外葡萄糖的摄取及乳酸的生成能力,从而影响HUVEC 细胞缺氧糖酵解途径。
PI3K/Akt 调节广泛的细胞活动,包括细胞存活、增殖、代谢、运动和肿瘤进展。Xiao等[22]发现加入外源性的PDGF 可以激活PI3K/Akt/mTOR/HIF-1α 信号通路从而促进肺动脉平滑肌细胞增殖及Warburg 效应。相关研究发现缺氧诱导的损伤可以通过某些作用于PI3K / Akt 信号通路的药物来治疗[23]。本研究表明此HDO 可以抑制PI3K/Akt/HIF-1α通路的激活。
综上,本研究发现HDO通过影响HUVEC细胞糖酵解途径从而发挥抗肿瘤活性,具体来说,HDO可以抑制PI3K/Akt/HIF-1α通路的激活进一步调控下游靶基因GLUT-1 及LDHA 的表达,从而抑制HUVEC 细胞的葡萄糖摄取及乳酸生成能力。该研究为推进HDO在抗肿瘤及治疗缺氧损伤相关疾病中的应用提供实验依据,但还应对以下几点继续深入探究:(1)HDO 调控HIF-1α 表达的具体机制;(2)HDO 在缺氧损伤引起的细胞凋亡、肿瘤细胞免疫逃逸中的作用;(3)HDO 在体内缺氧模型中的作用。

