外源性乳酸对高脂饲料诱导肥胖小鼠的代谢调节作用
张 楠,黄孝学,张子良,罗 玉,林君谦,王 涛*
(1中国药科大学药物科学研究院新药筛选中心,南京 210009;2六安市人民医院,六安 237000)
《中国居民营养与慢性病状况报告(2020 年)》显示,我国成年人中超重和肥胖比率分别为34.3%和16.4%,超重和肥胖已成为我国突出的营养问题之一,而肥胖伴有的糖脂代谢紊乱是糖尿病、脂肪肝、心脑血管等疾病的重要诱因。因此,改善肥胖状态下的糖脂代谢紊乱,比减轻肥胖体重更为迫切[1]。当前,尽管减重手术和部分药物(如利拉鲁肽和苯丁胺等)对于严重肥胖者具有减重作用,但存在较多的安全性风险,长期疗效具有不确定性,寻找安全有效的肥胖及其糖脂代谢紊乱治疗方法刻不容缓[2]。
多种小分子代谢产物对肥胖、糖尿病、心力衰竭、抑郁症、肺缺血、肿瘤等复杂疾病表现出独特的改善作用,包括脂质、短链脂肪酸、氨基酸等;同时由于这些代谢产物在体内可以完全转化和利用,相比外源性化学药物降低了对机体的代谢负担,它们已日益成为候选药物的源头和促进代谢健康的新策略[3-6]。1808 年 Berzelius 首次发现了肌肉中游离乳酸的存在。较长时间内乳酸被认为是机体糖酵解的无用产物,后来被证明是体内糖异生的主要前体和重要的能量底物。近年研究揭示,乳酸也是一种信号分子,通过血液运输在各种细胞、组织和器官间穿梭,以信使的形式在机体代谢灵活性和代谢网络调节中发挥全面作用[7-9],通过单羧酸转运蛋白(monocarboxylate transporters,MCTs)家族和乳酸受体(GPR81),在糖脂代谢和炎症调控中发挥重要作用,包括:抑制脂肪分解和脂肪酸β-氧化,增加组织胰岛素敏感性和代谢灵活性,减轻巨噬细胞活化和炎症因子释放等[10-13]。
当前,尽管已有多种可以增加胰岛素敏感性及促进葡萄糖代谢的药物,但它们仅能通过糖代谢某个特定环节靶点进行调节,单纯性促进葡萄糖的代谢和利用,尚缺乏可以系统性促进糖代谢、抑制脂代谢,从生化机制上全面平衡糖脂代谢的药物[14-16]。越来越多的证据表明,乳酸作为一种主要的可循环碳水能量物质,通过平衡细胞内NADH/NAD+的比例促进线粒体功能,双向调节细胞内糖、脂代谢,在维持和调节各个组织器官的糖脂代谢和能量供应平衡方面发挥重要作用[17-18]。鉴于糖脂代谢失衡和胰岛素抵抗是肥胖相关代谢紊乱的主要特征,本研究采用高脂饲料诱发肥胖小鼠,考察不同给药方案、途径的外源性乳酸对该模型糖脂代谢和胰岛素抵抗改善作用,探讨肥胖性代谢失衡干预的新策略和新方法。
1 材 料
1.1 药品与试剂
L-乳酸钠(CAS: 867-56-1,纯度98%,美国阿拉丁公司);葡萄糖(西陇科学股份有限公司);葡萄检测试剂盒(氧化酶法,上海荣盛有限公司);甘油三酯(TG)检测试剂盒、乳酸(LA)检测试剂盒(南京建成生物工程研究所);精蛋白生物合成人胰岛素注射液,诺和灵30R;小鼠胰岛素ELISA 试剂盒(瑞典Mercodia 公司);BCA 蛋白浓度测定试剂盒(上海碧云天生物科技研究所);RNA 纯化试剂盒、荧光定量 PCR 试剂盒(SYBR Green)(南京诺唯赞生物科技股份有限公司);标准颗粒饲料(江苏省协同医药生物工程有限责任公司,4.0 kJ/g,脂肪含量7%);TP24200 型高脂饲料(南通特洛菲饲料科技有限公司,23.0 kJ/g,脂肪含量60%)。
1.2 仪 器
CIMO DHG-9104A低温高速组织研磨仪(武汉赛维尔生物科技有限公司);21R 微量台式高速离心机、VARIOSKAN LUX 多功能微孔板读数仪(美国赛默飞世尔科技公司);BSA124S-CW 电子分析天平(北京赛多利斯科学仪器有限公司);BX53 正置显微镜(日本奥林巴斯公司)。
1.3 动 物
8 周龄雄性C57BL/6J 小鼠,SPF 级,体重(17±1)g,由上海市计划生育科学研究所实验动物经营部提供,生产许可证号:SCXK(沪)2018-0006。所有动物实验均符合动物伦理委员会标准。
2 方 法
2.1 乳酸给药剂量及依据
文献报道,人体或者小鼠运动后血清乳酸可以达到15 ~ 20 mmol/L[13,19]。为确定本实验乳酸给药剂量,小鼠禁食12 h 后,分别灌胃(ig)和腹腔注射(ip)不同剂量的乳酸(500 ~ 1 000 mg/kg),监测给药4 h 内的血清乳酸变化。结果显示,小鼠灌胃和腹腔注射500 mg/kg 乳酸,分别在10、30 min 时血清乳酸大于15 mmol/L,小鼠血乳酸水平高于基础乳酸值的维持时间分别约为1 h 和2 h。灌胃和腹腔注射1 000 mg/kg 乳酸,血乳酸达峰时间与500 mg/kg 剂量接近,但最大值仅小幅高于500 mg/kg 剂量。为此后续实验选择500 mg/kg 作为乳酸受试剂量,相当于中高强度运动后的血乳酸水平。
2.2 动物分组、模型建立及药物干预
适应饲养期的小鼠全部给予标准颗粒饲料;试验期间普通饲料饲养小鼠给予标准颗粒饲料,其他组小鼠给予高脂饲料。小鼠购入适应饲养1 周后,进行以下实验。
(1)外源性乳酸对肥胖性代谢紊乱进程的阻断作用(4 周实验) 鉴于肥胖人群中具有从代谢健康向代谢紊乱转变的进程,为此,考察外源性乳酸对这一代谢失衡进程的预防和阻断作用。
小鼠随机分为4 组:对照组(control, CON)、对照+乳酸给药组(control-lactate, CON-LAC)、高脂饮食模型组(high-fat diet, HFD)、高脂饮食+乳酸给药组(high-fat diet -lactate, HFD-LAC),每组8 只。CON 与CON-LAC 组小鼠给予普通饲料喂养4 周,HFD 组与HFD-LAC 组小鼠给予高脂饲料喂养4 周。CON-LAC 与HFD-LAC 组小鼠连续4 周腹腔注射500 mg/(kg·d) L-乳酸钠干预。
(2)不同给药途径外源性乳酸对肥胖性代谢紊乱模型的治疗作用(8 周实验) 采用高脂饲料喂养8 周建立肥胖性代谢紊乱模型,造模4 周时给药,考察不同给药途径外源性乳酸的治疗和改善作用。
造模4 周后,肥胖小鼠随机分为3 组,分别为高脂饮食模型组(HFD)、乳酸500 mg/kg 腹腔注射组(LAC-IP)和乳酸500 mg/kg 灌胃组(LAC-IG),每组8 只小鼠。另设8 只普通饲料对照组(CON)。各组小鼠每天给药1 次,连续给药4 周,CON 组和HFD组给予同容积蒸馏水。
2.3 体重和摄食量测量
每日固定时间补充饲料,称量剩余饲料及补充饲料,记录小鼠的摄食量,计算各组小鼠平均日摄食量。每周测量小鼠体重,监测小鼠体重增长情况。
2.4 口服糖耐量试验
给药结束时,小鼠禁食不禁水12 h 后,灌胃2 g/kg 葡萄糖溶液,分别在灌胃葡萄糖0、15、30、60、120 min 进行眼眶取血,全血于200 µL 离心管中常温静置30 min后,4 ℃,3 500 r/min离心15 min,吸取上层血清至200 µL EP 管中,按试剂盒说明测定血糖和血清乳酸,计算血糖-时间曲线下面积及血清乳酸-时间曲线下面积。
2.5 空腹胰岛素水平及胰岛素耐量检测
8周实验给药结束时,取口服糖耐量实验0 min血清测定空腹胰岛素水平,根据空腹血糖、胰岛素水平计算胰岛素抵抗指数(HOMA-IR)。HOMAIR = 空腹血糖浓度 × 空腹胰岛素浓度/22.5。
8 周实验给药结束(与糖耐量实验间隔2 d),小鼠禁食不禁水6 h 后,腹腔注射 0.75 U/kg 的胰岛素,分别测定给予胰岛素0,15、30、60、120 min后小鼠的血糖,计算血糖-时间曲线下面积及胰岛素给药后15 min内的曲线斜率。
2.6 血生化及肝糖原测定
小鼠禁食过夜后,摘眼球取血,根据试剂盒说明书测定乳酸、葡萄糖和甘油三酯水平。
小鼠肝脏用生理盐水漂洗干净,滤纸吸干,称取肝脏组织30 mg,按照试剂盒说明书进行肝糖原检测。
2.7 脂肪组织质量及组织形态学
取小鼠腹股沟脂肪(inguinal adipose tissue,ING)、附睾脂肪(epididymis adipose tissue, EAT),称重,计算脂肪指数,即脂肪占体重的质量分数。剪取小鼠ING、EAT 中间部分,在4%甲醛中固定48 h,常规石蜡包埋、切片,苏木精-伊红(HE)染色,光学显微镜下观察和拍照,比较各组脂肪细胞形态的变化。
2.8 脂肪组织中脂肪酸代谢相关基因的表达水平
称取ING 组织50 mg,按照试剂盒说明书提取总RNA,使用超微量核酸蛋白测定仪检测RNA 浓度,在逆转录仪上将RNA 逆转录成cDNA,运用实时荧光定量PCR 法测定cDNA 样品中的乙酰辅酶A 羧化酶 1(acetyl-CoA carboxylase 1, Acc1)、脂肪酸合酶(fatty acid synthase, Fas)、脂肪甘油三酯脂肪酶(adipose triglyceride lipase, Atgl)、激素敏感性脂肪酶(hormone sensitive lipase, Hsl)代谢相关基因mRNA 的表达水平。反应条件: 95℃,5 min;95 ℃,10 s,60 ℃,30 s,95 ℃,15 s,40 个循环。以β-actin 作为内参,计算相对量,采用2-ΔΔCT方法分析。引物设计见表1。

Table 1 Oligo nucleotide primers used for Real time-PCR
2.9 数据处理与统计学分析
所得结果均以xˉ ±s的形式表示,用GraphPad Prism 6 作图,组间比较采用One-Way ANOVA 分析方法。组间数据统计分析采用LSD-t检验,以P <0.05认为差异具有统计学意义。
3 结 果
3.1 对小鼠体重和摄食量的影响(4周预防实验)
如图1-A 所示,与CON 组相比,HFD 组小鼠体重增加,且从第1 周起呈稳步上升趋势,证明有效诱导代谢失衡,CON-LAC 组小鼠体重无明显变化,表明乳酸不会影响正常饮食小鼠的体重;HFD 与HFD-LAC 组小鼠体重无明显差异。如图1-B 所示,HFD 组小鼠的摄食量明显高于CON 组(P<0.001);HFD-LAC 组小鼠的摄食量低于HFD 组(P< 0.05)。结果表明乳酸在不改变代谢失衡小鼠体重的情况下,改善了小鼠多食症状。
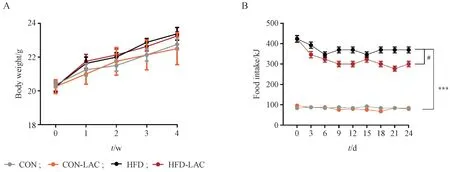
Figure 1 Effect of lactate (500 mg/kg, ip) on body weight, food intake in mice (±s, n = 8)A: Body weight curve; B: Food intake curve
3.2 对小鼠口服葡萄糖耐量的影响(4周预防实验)
如图2-A,B 所示,CON 组小鼠灌胃葡萄糖后,血糖在15 min时达峰,之后逐渐下降,120 min时恢复到基础水平。与CON 组相比,HFD 组口服糖耐量(oral glucose tolerance test, OGTT)曲线显著抬高、AUC 显著增加(P< 0.001),提示高脂饮食诱发小鼠糖耐量受损,CON-LAC 组小鼠的曲线和AUC未发生明显变化;与HFD 组相比,HFD-LAC 组小鼠在15, 60 min 处的血糖和AUC 的降低有统计学差异(P< 0.01,P< 0.05,P< 0.05),提示乳酸仅对代谢失衡小鼠的糖耐量具有一定改善作用。
此外,如图2-C,D 所示,与CON 组相比,HFD组血清乳酸浓度-时间曲线显著降低(P< 0.01),提示高脂饮食诱导小鼠葡萄糖转化(糖酵解)受损。与HFD 组相比,HFD-LAC 组血清乳酸浓度-时间曲线抬高,AUC 显著增加(P< 0.01),提示乳酸能够抑制代谢失衡小鼠葡萄糖转化(糖酵解)受损。

Figure 2 Effect of lactate (500 mg/kg, ip) on glucose tolerance in mice (±s, n = 8)
3.3 对小鼠血生化及肝糖原水平的影响(4 周预防实验)
如图3-A、B、C 所示,与CON 组相比,HFD 组小鼠空腹血糖显著升高(P< 0.001),血乳酸水平显著降低(P< 0.01),肝糖原水平升高(P< 0.05),这些变化均表明高脂饮食显著抑制了小鼠的葡萄糖代谢利用;与HFD 组相比,HFD-LAC 组小鼠空腹血糖和肝糖原水平降低(P< 0.05),同时乳酸水平显著降低(P< 0.01),提示乳酸对高脂饮食小鼠糖代谢具有显著恢复作用。如图3-D、E 所示,与CON 组相比,HFD 组小鼠空腹血清TG 水平仅轻度升高,提示高脂饲养4周尚处于代谢灵活性的代偿期,摄入的过多脂肪在禁食状态下被优先代谢利用,尚未引起显著的血清TG 升高。CON-LAC 组小鼠空腹血清TG 水平高于CON 组(P< 0.05);HFDLAC 组小鼠空腹血清TG 水平高于HFD 组(P<0.05),显示乳酸对脂肪酸代谢利用具有一定抑制作用。

Figure 3 Effect of lactate (500 mg/kg, ip) on serum glucose, lactate, triglycerides, and liver glycogen levels in mice (±s, n = 8)A: Fasting glucose; B: Serum TC; C: Serum TG; D: Serum lactate; E: Liver glycogen
3.4 对小鼠脂肪组织质量及组织病理学的影响(4周预防实验)
如图4-A,B 所示,与CON 组相比,HFD 组EAT质量增加(P< 0.05),EAT/ING 升高(P< 0.05),CON-LAC 组小鼠ING 和EAT 质量变化不显著,EAT/ING 轻度降低;与HFD组相比,HFD-LAC组小鼠的ING 质量极显著增加(P< 0.001),EAT 质量变化不明显,因EAT/ING 极显著降低(P< 0.001)。EAT 属于内脏脂肪组织,而ING 属于皮下脂肪组织,由此提示,在肥胖发生过程中,乳酸给药可使得体内脂肪分布发生变化,使得ING 质量增加且增大ING分布的比率。
图4-C 显示ING 和EAT 组织病理学结果,与CON 组相比,HFD 组ING 和EAT 脂肪细胞面积显著肥大,形状呈不规则圆形,排列较杂乱;CONLAC 组小鼠脂肪细胞略增大,但形状规则、排列紧密;而HFD-LAC 组小鼠过度肥大的脂肪细胞面积缩小,排列整齐紧密,显示出一定的改善作用。

Figure 4 Effect of lactate (500 mg/kg, ip) on fat weight and histopathology in mice (±s, n = 8)
3.5 对小鼠ING 脂肪酸代谢相关基因表达的影响(4周预防实验)
ING 在全身脂肪分解输出和合成储存中具有重要地位。ING 中富含Atgl 和Hsl,它们受某些激素(如肾上腺素、胰高血糖素、前列腺素等)和信号的调节催化TG 水解释放甘油和游离脂肪酸(free fatty acid, FFA);而Acc1 和Fas 作为合成脂肪酸关键酶,影响着FFA 的产生。如图5 所示,与CON 组相比,HFD 组Atgl、Hsl、Fas的mRNA 表达水平上调(P< 0.01,P< 0.001,P< 0.05),表明造模4 周阶段,HFD 小鼠ING 中脂肪的分解/合成代谢均处于旺盛状态。与CON 组相比,CON-LAC 组Atgl表达下调(P< 0.01),Hsl表达上调(P< 0.05);与HFD组相比,HFD-LAC 组Atgl、Hsl、Acc1和Fas表达水平下调(P< 0.05,P< 0.01,P< 0.05,P< 0.01)。表明乳酸能够下调代谢失衡小鼠ING 中脂质分解及合成相关基因,表现为一定的脂质代谢抑制特征。

Figure 5 Effect of lactate (500 mg/kg, ip) on the expression of fatty acid metabolism related genes in ING (±s, n = 8)
3.6 对肥胖小鼠体重和摄食量的影响(8 周治疗实验)
如图6-A 所示,与CON 组相比,HFD 组小鼠体重增加(P< 0.05),提示小鼠肥胖;与HFD组相比,LAC-IP 组和LAC-IG 组小鼠自第4 周给药开始,出现体重减轻,但是未达统计学显著差异(P>0.05)。如图6-B 所示,HFD 组小鼠摄食量明显高于CON组(P< 0.001); LAC-IP 组和LAC-IG 组小鼠的摄食量低于HFD 组(差异无统计学意义)。结果表明乳酸能够改善小鼠肥胖。

Figure 6 Effect of lactate (500 mg/kg, ip and ig) on body weight and food intake in HFD mice (±s, n = 8)
3.7 对肥胖小鼠葡萄糖耐量的影响(8周治疗实验)
如图7-A,B 所示,与CON 组相比,HFD 组血糖-时间曲线极显著抬高(P< 0.001),表现为明显的糖耐量受损。与HFD 组相比,LAC-IG 组的血糖在15,60,120 min 有一定程度的降低(P< 0.05,P< 0.01,P< 0.01),AUC 显著降低(P< 0.01),LAC-IP 组各时间点的血糖和AUC 下降显著,表明乳酸能够改善肥胖小鼠的糖耐量受损,尤其是腹腔注射途径。
如图7-C 所示,与CON 组相比,HFD 组葡萄糖注射15 min 内的乳酸变化低平,提示葡萄糖转化(糖酵解)受损,未能将摄入的葡萄糖急性转化为乳酸。与HFD 组相比,LAC-IP 和LAC-IG 组15 min内的乳酸变化均抬高,表现出对葡萄糖转化(糖酵解)的改善作用。但是,CON,LAC-IP 与LAC-IG 组在30 min 时间点的乳酸水平均出现大幅度下降,导致AUC 各组间基本接近(图7-D)。30 min 时间点的乳酸下降不符合生理现象,可能是实验中某些因素引起,具体原因尚不明确。

Figure 7 Effect of lactate (500 mg/kg, ip and ig) on glucose tolerance in HFD mice (±s, n = 8)
3.8 对肥胖小鼠胰岛素耐量和胰岛素抵抗指数的影响(8周治疗实验)
如图8 所示,与CON 组相比,HFD 组各时间点的血糖明显高于CON 组(P< 0.001),且胰岛素注射后15 min 内降糖速率减弱(P< 0.05),提示胰岛素耐量受损,此外,HFD 组空腹胰岛素水平及胰岛素抵抗指数均显著升高,总体表现为胰岛素抵抗状态。与HFD 组相比,LAC-IP和LAC-IG 组小鼠的胰岛素耐量显著降低,同时空腹胰岛素水平及胰岛素抵抗指数也有改善趋势。

Figure 8 Effect of lactate (500 mg/kg, ip and ig) on insulin tolerance and HOMA-IR in HFD mice (±s, n = 8)
3.9 对肥胖小鼠血生化及肝糖原水平的影响(8周治疗实验)
如图9 所示,与CON 组相比,HFD 组小鼠空腹血糖极显著升高(P< 0.001),血乳酸、肝糖原、TC和TG 水平均未见显著变化;LAC-IP 和LAC-IG 组能降低肥胖小鼠空腹血糖(P< 0.05,P< 0.01),对血乳酸、肝糖原、TC和TG水平未见显著变化。
3.10 对肥胖小鼠脂肪组织质量及组织病理学的影响(8周治疗实验)
如图10-A、B 所示,与CON 相比,HFD 组ING和EAT 质量均显著增加(P< 0.001),EAT/ING 降低(P< 0.05)。与HFD 组相比,LAC-IP 和LAC-IG组小鼠的ING 和EAT 质量变化不显著,LAC-IP 组的EAT/ING 有升高趋势(P>0.05)。由此提示,乳酸具有促进肥胖小鼠白色脂肪蓄积的趋势。
如图10-C 的ING 和EAT 组织病理学结果显示,与CON 组比较,HFD 组ING 和EAT脂肪细胞面积增大(ING 脂肪细胞部分增大,而EAT 脂肪细胞则显著肥大),形状呈不规则圆形,排列较杂乱;乳酸两种给药途径均可进一步增大ING 脂肪细胞,同时排列规则整密;而使得过度肥大的EAT 脂肪细胞面积缩小,排列整齐紧密,这表征了较大的储脂潜力。由此可见,随着造模时间延长,肥胖小鼠ING 和EAT 的脂肪细胞形态出现的病变程度有所不同,而乳酸对不同病变程度的改善作用也具有差异化。

Figure 10 Effect of lactate (500 mg/kg, ip and ig) on fat weight and histopathology in HFD mice (±s, n = 8)
3.11 对肥胖小鼠ING 脂肪酸代谢相关基因表达的影响(8周治疗实验)
如图11 所示,与CON 组相比,HFD 组Atgl、Hsl的mRNA 表达水平明显上调(P< 0.01),而Acc1、Fas的mRNA 表达水平未见明显变化,表明造模8周阶段,HFD 组小鼠ING 中脂肪分解活跃,而脂肪酸合成未见显著改变。乳酸两种途径给药均可下调肥胖小鼠Atgl、Hsl的mRNA 表达水平(P< 0.05,P< 0.01),对Acc1、Fas的mRNA 表达水平未见明显影响,提示乳酸能够减弱肥胖小鼠ING 的脂肪分解能力。

Figure 11 Effect of lactate (500 mg/kg, ip and ig) on the expression of fatty acid metabolism related genes in ING of HFD mice (±s, n = 8)
4 讨 论
生理状态下,脂肪组织通过脂解作用可以释放FFA 和甘油入血,为组织代谢提供能量物质;而当脂肪组织的脂肪储存量超过阈值时,则会引起脂肪组织代谢障碍,进而诱发肥胖及糖脂代谢失衡。GPR81 是在脂肪组织高表达的孤儿 G 蛋白偶联受体[20]。2008 年,研究发现乳酸是 GPR81 激动剂,通过 GPR81 抑制细胞内cAMP 合成,增强胰岛素抗脂解作用,发挥改善代谢异常的作用[12,21-22]。尽管乳酸通过GPR81 抑制脂解的生理作用已有多项研究证据,但外源性乳酸是否可以改善肥胖性糖脂代谢失衡,尚未见明确报道。
在预防性试验中,乳酸干预4周能够改善高脂诱发的代谢紊乱。8 周的治疗性试验结果也同样确证了外源乳酸可显著改善肥胖小鼠的糖脂代谢紊乱。在两部分试验中,外源性乳酸虽然不能减轻肥胖小鼠的体重,且给药后部分脂肪组织的质量甚至有所增加,但在机体脂肪分布方面却均可以对抗模型小鼠的改变。此外,脂肪组织病理学表明,乳酸给药可明显改善脂肪细胞形态与分布;不同给药途径的乳酸均能显著下调脂肪组织中脂解基因的表达。由此可见,外源性乳酸对于肥胖小鼠脂肪组织的干预作用,主要表现为抑制脂解,同时促进体内脂肪细胞的储脂功能,维持机体脂肪组织健康,减少体内异位脂质沉积。
高脂饮食带来体内脂代谢亢进,一方面直接抑制了大多数器官组织的糖代谢,另一方面诱发胰岛素抵抗而进一步恶化糖代谢功能,最终导致严重的糖脂代谢失衡[23]。着眼于提升及恢复已经被压低的糖代谢理论上是肥胖性代谢紊乱的有效干预策略。本实验中,高脂饲料造模的肥胖小鼠出现明显的糖代谢障碍,包括空腹血糖升高、糖耐量受损和胰岛素抵抗等,不同给药方案和给药途径的乳酸均能显著改善这些糖代谢障碍,纠正糖脂代谢失衡。简而言之,乳酸可以促进肥胖小鼠的糖脂代谢紊乱向糖脂代谢平衡状态转归,维持机体健康。
综上,本研究证实了外源性乳酸对于高脂饲料诱导小鼠肥胖性代谢失衡的改善作用,主要作用特征为增强糖代谢而抑制脂代谢,同时维持脂肪细胞的健康形态和重塑脂肪组织分布,改善模型小鼠系统性胰岛素抵抗。尽管肥胖引起的代谢异常是治疗的病理核心,而减重也是肥胖干预的重要目标,本实验中乳酸给药在改善代谢障碍的同时未能减轻肥胖小鼠体重及脂肪组织质量,因此尚需进一步研究来更加精准和系统地探究乳酸改善肥胖性代谢失衡的作用机制及评价长期疗效。或许,基于乳酸代谢调节机制而开发其结构类似物有望成为代谢失衡性肥胖人群的有效治疗药物。

