ACE2对乳腺癌预后的影响及其潜在机制
徐灵亚,刘 雪,曹潇洋,张馨怡,姚 静,王传功,*
(1潍坊医学院基础医学院,潍坊 261053;2济宁医学院基础医学院,济宁 272067)
乳腺癌是女性最常见的恶性肿瘤之一,病死率居高不下,严重威胁全世界女性健康[1]。美国癌症协会最新癌症统计资料表明,2023 年美国乳腺癌患者发病率将仍高居女性恶性肿瘤首位,占所有新发肿瘤的31%,且发病率每年仍持续增长[2]。乳腺癌具有高度异质性,根据基因表达不同,将乳腺癌分为正常乳腺样型、Luminal A 型、Luminal B 型、HER-2 阳性型和Basal-like 型5 种亚型。根据免疫表型分为Luminal A 型、Luminal B型、HER-2 阳性型和三阴性乳腺癌(triple-negative breast cancer,TNBC)4 种临床亚型。其中,Basallike 型与TNBC 型在组织形态、免疫表型及临床表现等方面大致相似,但不等同。此外,TNBC 在基因表达层面上是一组混合型乳腺癌,又可将其分为6 种分子亚型:基底样-1 型(basal-like-1,BL-1)、基底样-2 型(basal-like-2,BL-2)、免疫调节型(immunomodulatory,IM)、间质型(mesenchymal,M)、间质干细胞型(mesenchymal stem like,MSL)及雄激素受体型(luminal androgen receptor,LAR)[3]。鉴于TNBC 的高侵袭性及对传统疗法的相对抵抗[4-5],使得深入探究TNBC 发生发展机制及诊治方案十分必要。
血管紧张素转换酶2(angiotensin converting enzyme 2,ACE2)是一种Ⅰ型膜锚定锌羧肽酶,主要位于细胞膜上,其可通过去除C端苯丙氨酸残基将Ang II转化为Ang(1-7),同时也可作用于Ang I产生Ang(1-9)[6-7],是肾素-血管紧张素系统(reninangiotensin system,RAS)中Ang(1-7)/MasR 轴的主要组成部分[8-9]。ACE2 除参与协调RAS 系统中ACE/Ang II/AT1R 和ACE2/Ang(1-7)/MasR 两轴之间的平衡外[6,10],还可参与调节结肠炎中色氨酸代谢,抗菌肽的表达以及肠道微生物组的功能[11-12],并能有效改善人体内SARS-CoV-2 感染后的葡萄糖和脂质代谢[13]。另有研究发现,ACE2 在多种肿瘤中扮演着重要的抑癌角色[14-15]。在肝细胞癌[15]及肾母细胞瘤[16]中,ACE2高表达者提示更好的预后。此外,ACE2 还可以消除肿瘤对VEGFR 抑制剂的耐药性,为肾透明细胞癌的治疗提供了新的思路[16]。在乳腺癌中,虽有文献报道了ACE2 对乳腺癌血管生成的影响[17],但其调控乳腺癌(尤其是侵袭能力较强的TNBC)侵袭转移等生物学行为能力及调控机制研究鲜有报道。为此,本研究首先通过The Cancer Genome Atlas (TCGA)等多个数据库对ACE2 在乳腺癌中的表达进行了综合生物信息学分析,并使用Kaplan Meier 数据库评估ACE2 的预后价值。为了进一步了解ACE2 在乳腺癌中的功能及致病机制,本研究进行了体外功能实验及调控机制验证,以期揭示ACE2 对乳腺癌预后的影响及其潜在机制,为更好地精准治疗乳腺癌提供理论依据。
1 材 料
1.1 试 剂
RPMI 1640 培养基、DMEM 培养基和胎牛血清(美国Gibco 公司);CCK-8 试剂(日本同仁公司);Lipo8000™转染试剂(上海碧云天公司);TRIzol 试剂、逆转录试剂和实时荧光定量PCR(real-time fluorescence quantitative PCR,RT-qPCR)试剂(上海飞捷生物公司);ECL 曝光液(美国Thermo 公司);GAPDH 抗体(美国Proteintech 公司);ACE2、基质金属蛋白酶2(MMP2)、Cyclin A2、Cyclin B1、Cyclin D1 和Cyclin E2 抗体(美国CST 公司);其他试剂均为市售分析纯。
1.2 仪 器
荧光定量PCR 仪(美国Millipore 公司);Multiskan FC 酶标仪(美国Thermo 公司);电泳仪、转膜仪(美国Bio-Rad 公司)。
1.3 细 胞
人乳腺癌细胞均由陆军军医大学附属西南医院病理科惠赠。所有细胞均已通过短串联重复序列(STR)分析鉴定。
2 方 法
2.1 基因表达与临床病理特征分析
使用UALCAN 数据库评估ACE2 在乳腺癌和正常乳腺样本中的表达(http://timer. cistrome.org),以及TCGA-BRCA 数据库中的公共资料分析ACE2 与乳腺癌患者临床病理学特征之间的关联性。Kaplan-Meier Plotter 数据库分析ACE2 表达与乳腺癌生存率之间的关系(https://kmplot.com/analysis/)。
2.2 基因富集分析
使用UALCAN数据库选取了乳腺癌中44个与ACE2皮尔逊相关系数大于0.3的共表达基因。上传至DAVID(https://david.ncifcrf.gov)进行KEGG通路富集和GO 功能分析,并根据富集分数(enrichment score)和数量(count),使用微生信(http://www.Bioinformatics.com.cn/)进行可视化处理。
2.3 免疫浸润分析
基于TCGA-BRCA 队列,本研究使用TISIDB数据库(http://cis. hku. hk/TISIDB/)评估乳腺癌中ACE2 与组织亚型和免疫亚型的关系,分析ACE2表达与TIICs、趋化因子、趋化因子受体和免疫抑制分子的相关性。
2.4 细胞培养、慢病毒感染和siRNA转染
MDA-MB-231 培养于含10%FBS 的DMEM 完全培养基中,置于37 ℃、5% CO2恒温恒湿培养箱中培养。取生长状态良好的细胞计数后,按每孔约4 × 104个接种至12 孔细胞培养板中,待细胞生长融合至50% ~ 70%时,加入含LV-ACE2 或空载体LV-Vector 的慢病毒颗粒转染液,按感染指数(multiplicity of infection,MOI)为50 将慢病毒颗粒和5 µg/mL 聚凝胺与细胞缓慢充分混匀,置于37 ℃、5% CO2恒温恒湿培养箱中进行培养,16 h后更换为新鲜培养液,感染72 h 后,荧光显微镜观察,采用含10%FBS和2 mg/L嘌呤霉素的DMEM 培养液进行筛选以建立稳定感染LV-ACE2 或LVVector 的细胞系,并通过Western blot 和RT-qPCR验证感染效率,收集细胞进行后续实验。
采用Lipo8000™将小干扰RNA(siRNA)和阴性对照转染入MDA-MB-231 细胞,转染24 h 后采用RT-qPCR 法检测细胞转染效率,收集细胞进行后续实验。siRNA的序列见表1。

Table 1 siRNA sequences used for transfection
2.5 蛋白质印迹(Western blot,WB)检测各细胞中蛋白表达水平
采用RIPA 裂解液提取细胞总蛋白,BCA 法测定蛋白浓度,每个样本上样量为20 µg,通过SDSPAGE 凝胶电泳分离蛋白质并转移到聚偏氟乙烯薄膜,室温封闭2 h,分别加ACE2 抗体(l∶500),Cyclin 抗体(A2、B1、D1 和E2)、MMP2 抗体和GAPDH 抗体(l∶5 000)4 ℃过夜孵育,加二抗(鼠或兔源性)室温孵育1 h,洗膜后化学发光显色、拍照。
2.6 RT-qPCR法检测各细胞中RNA表达水平
采用TRIzol 试剂盒说明书提取细胞总RNA后,逆转录为cDNA,实验重复3 次。引物序列见表2。
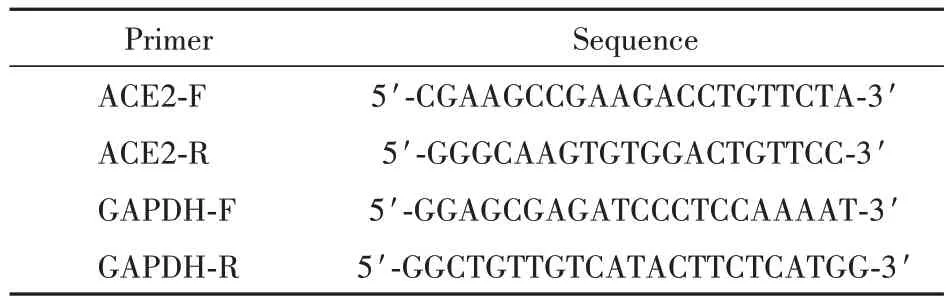
Table 2 Primer sequences used for RT-qPCR
2.7 CCK-8检测细胞增殖活力
收集对数生长期的各组细胞进行实验,将细胞接种于96 孔细胞培养板,每孔100 µL。设置3个复孔,另设空白组(不含细胞,仅含培养液),置于37 ℃、5%CO2培养箱中培养,细胞贴壁后分别在第0 ~ 4天,分别使用含10%FBS和10%CCK-8的培养液培养2 h,检测450 nm处吸收度。
2.8 Transwell 细胞侵袭实验
Matrigel 胶与无FBS 培养基按照4∶1 的比例稀释后,均匀铺于24 孔Transwell 小室中。每孔按4 × 104个细胞(100 µL)加入上室,下室各加无FBS培养基600 µL。培养结束后,PBS 清洗,4%多聚甲醛固定细胞30 min,1%结晶紫染液浸泡60 min。取膜显微镜下观察,拍照。
2.9 划痕愈合实验
按每孔5 × 105个细胞均匀铺于6孔板中,细胞密度达到70% ~ 80%时,每孔的中央划井字,PBS清洗,倒置显微镜下观察0、24 和48 h 各组划痕的愈合情况并拍照记录。
2.10 流式细胞术
细胞周期检测:收集各组细胞,PBS 缓冲液洗涤后75%乙醇重悬细胞,-20 ℃过夜固定。次日,细胞经冷PBS 缓冲液冲洗后,采用碘化丙啶染色液重悬细胞,37 ℃避光温浴30 min。采用流式细胞术分析不同细胞周期各组细胞百分率。
细胞凋亡检测:取各组细胞,用预冷的PBS 洗涤3 次,每组分为4 份(空白组、单染组和双染组),加入Annexin V-APC 和7-AAD 染色液,冰上避光,立即进行细胞凋亡检测。
2.11 统计学分析
采用SPSS 27 和GraphPad Prism 7.0 软件进行统计学分析。各组组织和细胞中mRNA 表达水平符合正态分布,以±s和P表示,多组间样本均数比较采用单因素方差分析,组间两两比较采用LSD-t检验,非正态分布采用秩和检验。P< 0.05被认为具有统计学意义。
3 结 果
3.1 乳腺癌组织中ACE2的表达水平
通过UALCAN 数据库分析表明,ACE2 在乳腺癌组织中的表达水平显著低于正常对照组织(P<0.05,图1-A),且在TNBC 各亚型中的表达量存在显著差异性(P< 0.05,图1-B)。为了进一步阐明结果,本研究收集了TCGA 数据库中乳腺癌转录组和临床组数据,包含正常乳腺组织108例,乳腺肿瘤组织1 017例,其中,99例为匹配样本。评估TCGABRCA 队列中未配对瘤旁乳腺正常组织(44.13 ±2.28)与乳腺癌肿瘤组织(10.81 ± 0.929 5)(P<0.05,图1-C)和配对的肿瘤组织与瘤旁组织(P<0.001,图1-D)之间ACE2 的mRNA 表达。结果显示,与正常样本相比,ACE2 在乳腺癌肿瘤样本中的表达明显更低。
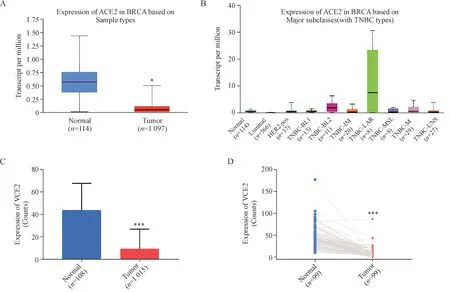
Figure 1 Angiotensin converting enzyme 2 (ACE2) expression levels in breast cancer tissues (±s)
3.2 ACE2表达与临床特征之间的相关性
本研究评估了ACE2 表达与乳腺癌患者临床病理特征之间的相关性。结果表明ACE2 的表达与患者年龄(P< 0.05,图2-C)及肿瘤转移状态(P< 0.05,图2-F ~ G)显著相关,而与种族、临床分期和分级等参数之间的相关性并不显著(图2-A、B、D、E)。ACE2 在不同年龄段的乳腺癌患者中呈现差异表达趋势,其在乳腺癌高发的61 ~ 75 岁年龄阶段患者中的表达水平显著低于0 ~ 35 岁和36 ~ 60岁年龄段患者,结果提示ACE2低表达或许是乳腺癌发生发展的重要驱动因素。此外,ACE2在肿瘤M1 期和N1mi 期也呈低表达状态,结果提示,ACE2 可能在乳腺癌转移的早期阶段发挥重要作用,其有望成为乳腺癌早期诊断的生物标记物。
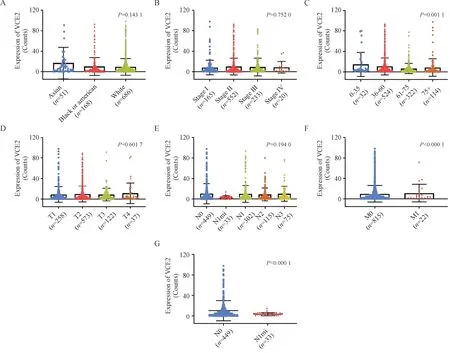
Figure 2 Correlation between the relative expression of ACE2 and clinicopathological parameters
3.3 ACE2表达与乳腺癌的预后相关
本研究采用Kaplan-Meier Plotter 数据库评估ACE2在乳腺癌4种主要亚型中的预后价值。结果表明,在不同分子亚型乳腺癌中,ACE2 扮演着不同的预后角色:在Luminal A 型乳腺癌中,ACE2 高表达者预后更差(P< 0.05,图3-A);在TNBC 中,ACE2 高表达者则提示更好的预后(P< 0.05,图3-C)。而在Luminal B 型(图3-B)和HER2 阳性型乳腺癌(图3-D)中并未发现显著预后意义。这些结果表明,ACE2 在乳腺癌预后中有重要的意义,是TNBC良好预后的重要分子。
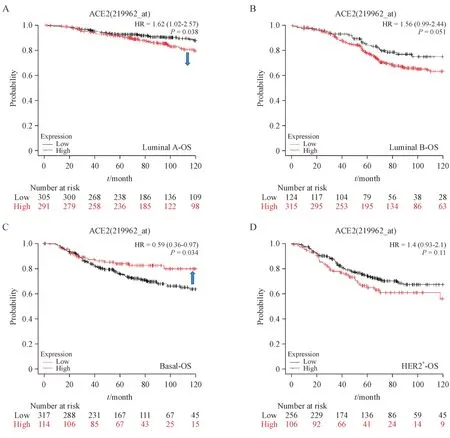
Figure 3 Correlation between ACE2 expression and prognosis
3.4 基因富集分析
一般而言,共表达基因具有相似的功能和作用。本研究利用UALCAN 数据库筛选TCGABRCA 队列中的ACE2 共表达基因,进行KEGG 通路富集分析和GO 功能分析。KEGG 通路富集主要是色氨酸代谢和花生四烯酸代谢相关通路等(图4-A)。GO 功能分析中关键生物学过程(BP)包含脂多糖代谢、细胞周期、电子传递和免疫调节等。关键细胞组分(CC)为线粒体和细胞外泌体的组成部分。分子功能(MF)包括谷胱甘肽水解酶活性、肽基转移酶活性、长链脂肪酸-CoA 连接酶活性、氧化还原酶活性和脂质合成等(图4-B)。以上结果表明ACE2 主要与乳腺癌中代谢酶活性、免疫调节、细胞周期,以及色氨酸和花生四烯酸代谢过程有关,这些过程对乳腺癌的发生发展至关重要。
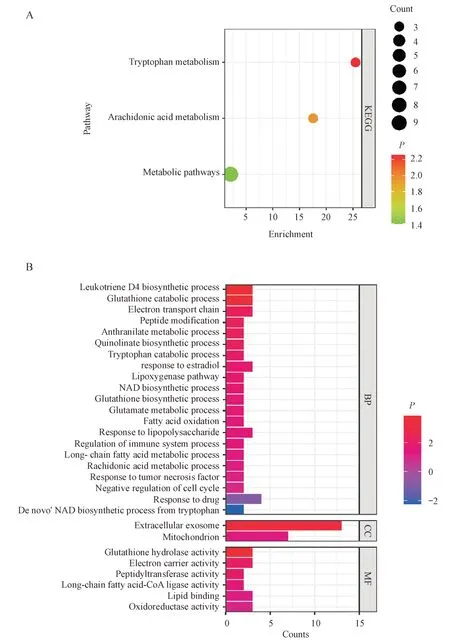
Figure 4 Gene enrichment analysis
3.5 乳腺癌中ACE2的表达与免疫微环境的关系
肿瘤微环境(tumor microenvironment,TME)是由肿瘤细胞、基质和内皮细胞组成的异质性复杂组织,其中免疫浸润细胞、趋化因子、趋化因子受体和免疫因子等构成免疫微环境。肿瘤免疫集群分为6 种免疫亚型,分别为C1:伤口愈合型,C2:IFN-γ 主导型,C3:炎症型,C4:淋巴细胞消减型,C5:免疫静默型和C6:TGF-β 主导型。在TISIDB数据库中,ACE2 与乳腺癌患者组织学亚型和免疫学亚型显著相关(图5-A)。
免疫微环境中的免疫细胞在抑制或促进肿瘤生长方面发挥着重要作用,趋化因子和趋化因子受体在免疫调节过程中起着非常关键的作用,它们可以将免疫细胞招募到TME 中,并影响肿瘤进展。随后使用TISIDB 数据库评估ACE2 与乳腺癌TIICs以及趋化因子的关系。结果表明,ACE2表达与乳腺癌中ACT-B、Th1、NKT、Tfh、Th17、Th2 和Tem-CD8 等细胞呈正相关(图5-B)。ACE2与乳腺癌趋化因子CX3CL1、CXCL1和CXCL6等表达呈正相关,与CXCL14表达呈负相关。ACE2与乳腺癌趋化因子受体分子CXCR6、CXCR4、CXCR5和CXCR3等表达呈正相关,与CXCR1 和CX3CR1 表达呈负相关。目前,肿瘤免疫检查点抑制剂(immune checkpoint inhibitors,ICIs)的使用改变了肿瘤治疗的格局。ICIs 是通过阻断免疫检查点来诱导抗肿瘤免疫反应。本研究使用TISIDB 数据库分析乳腺癌中,ACE2 与免疫抑制因子之间的相关性。结果显示,ACE2 与免疫抑制因子IDO1(rho = 0.367,P< 0.05)、PDCD1(PD-1)(rho = 0.271,P< 0.05)和CTLA4(rho = 0.323,P< 0.05)等表达水平呈正相关(图5-C)。
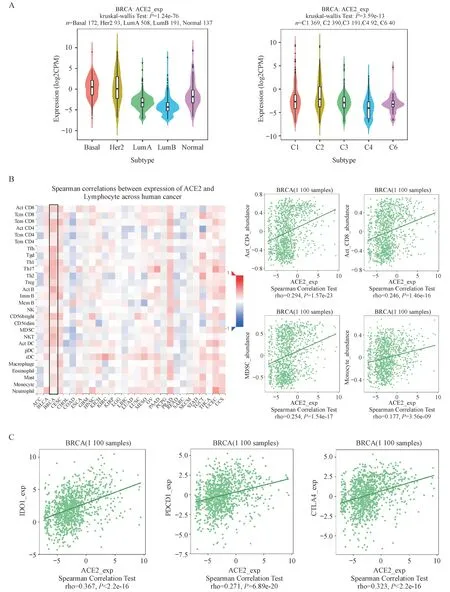
Figure 5 Relationship between ACE2 and the immune microenvironment
3.6 过表达和敲低ACE2 细胞系的构建和效果验证
为了阐明ACE2 在乳腺癌进展中的作用,本研究首先检测了ACE2 在不同乳腺癌细胞系中蛋白表达水平(图6-A)。结果显示,在TNBC 细胞系MDA-MB-231中,ACE2的表达水平呈低表达状态。而前文结果表明,ACE2 高表达的TNBC 患者预后更好,这将为TNBC 这一难治性亚型乳腺癌的探索带来新思路。为了进一步验证ACE2在TNBC细胞系中的功能作用,本研究建立了ACE2 稳定过表达和敲低细胞系。过表达ACE2 后,ACE2 的蛋白水平(P< 0.05,图6-B)和RNA 水平(P< 0.05,图6-D)均有显著的增加;反之,敲低ACE2 后,ACE2 的蛋白水平(P< 0.05,图6-C)和RNA 水平(P<0.05,图6-E)均呈现显著的下调。
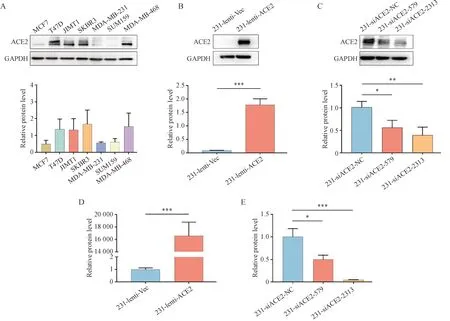
Figure 6 Identification of ACE2 expression level (± s, n = 3)
3.7 ACE2抑制TNBC细胞的增殖、侵袭和迁移
前期数据库结果表明,ACE2 与TNBC 患者预后显著相关,其高表达者患者预后更好。而TNBC作为侵袭能力较强的乳腺癌亚型,关注ACE2 在这种亚型中的角色和作用十分必要。为此,本研究选择TNBC 细胞系MDA-MB-231 进行相关功能实验。结果表明,与对照组相比,ACE2 过表达组细胞的增殖、迁移和侵袭能力显著减弱(图7)。反之,敲低ACE2 后,MDA-MB-231 细胞增殖活力反而提升(P< 0.05,图7-B)。结果表明ACE2能够抑制MDA-MB-231细胞的增殖、侵袭和迁移。
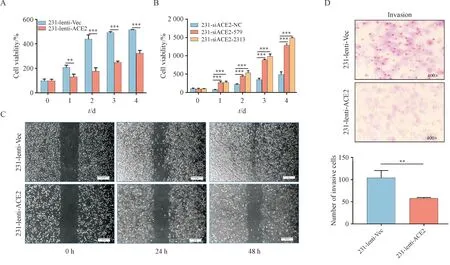
Figure 7 ACE2 inhibits the proliferation, invasion and migration of TNBC cells (±s, n = 3)
为进一步研究ACE2 抑制MDA-MB-231 细胞增殖、侵袭和迁移的机制,本研究通过流式细胞术和WB 实验,检测细胞周期停滞情况(图8-A)和凋亡数量(图8-B)及相关周期蛋白Cyclin A2、Cyclin B1、Cyclin D1 和Cyclin E2 的表达(图8-C)。结果表明,ACE2 并非通过细胞凋亡和周期停滞途径抑制TNBC 细胞增殖。前文结果表明,ACE2 与乳腺癌的早期转移有关。而基质金属蛋白酶(MMP)是锌依赖性蛋白水解金属酶,在肿瘤侵袭和转移中发挥重要作用。文献报道,抑癌基因miR-526b-3p的表达可通过下调MMP 家族中重要成员MMP2的表达,进而抑制HeLa 细胞侵袭和转移[18]。本研究也发现,ACE2 过表达后的MDA-MB-231 细胞中MMP2 的表达水平显著降低(图8-C)。结果提示,ACE2 可能通过影响MMP2 而抑制TNBC 细胞的转移。
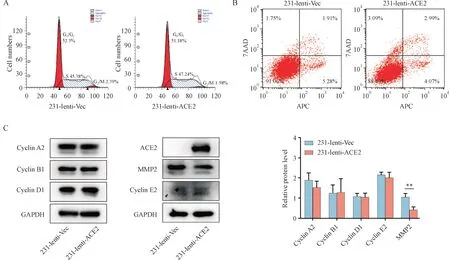
Figure 8 Effect of ACE2 on cell cycle, apoptosis and matrix metalloproteinase 2 (MMP2) (±s, n = 3)
3.8 ACE2通过MMP2途径抑制TNBC细胞的侵袭
为进一步验证ACE2 是否通过MMP2 途径抑制TNBC 细胞的侵袭。本研究将siACE2 转染到231-lenti-ACE2 细胞中观察MMP2 的表达情况,并通过Invasion 实验进行检验。结果发现,转染了siACE2 的231-lenti-ACE2 细胞的侵袭能力较231-lenti-ACE2 组显著增强(图9)。以上结果说明ACE2可以通过MMP2途径抑制MDA-MB-231细胞的侵袭能力。
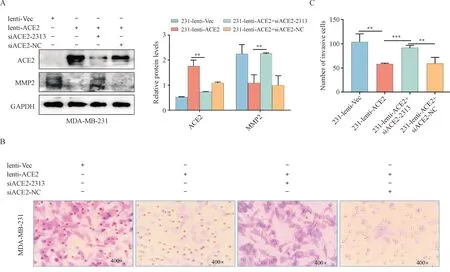
Figure 9 ACE2 affects cell invasion through MMP2 (±s, n = 3)
4 讨 论
在本研究中,首先进行了综合生物信息学分析,以研究ACE2 在乳腺癌中的表达量、预后价值、生物学功能和潜在的调控途径。这些生物信息学分析和基础研究将为进一步了解乳腺癌患者的预后和治疗奠定基础。基于生物信息学分析,发现ACE2 在乳腺癌中表达低于正常组织,并与患者年龄、M 分期和N1mi 期相关。同时发现,ACE2 与乳腺癌的分子亚型密切相关,ACE2 高表达预示着Luminal 型乳腺癌的生存时间更短,而TNBC 的生存时间更长。近期研究发现,ACE2 通过与新冠病毒表面S 蛋白结合诱导人体细胞发生病毒感染[19],ACE2 靶向药物的研制成为治疗新冠的关键。其中,靶向ACE2 的雾化吸入剂临床试验显示了良好的安全性和耐受性。另有文献报道[20],转移性TNBC 患者感染新冠的可能性更高,其主要原因是该类患者的癌细胞更易发生病毒感染,以上结果提示新冠相关分子ACE2 在乳腺癌进展中扮演重要角色。为此提出大胆的设想,是否ACE2 靶向药物也能使部分乳腺癌患者从中获益?尤其是ACE2表达高而预后差的Luminal 型乳腺癌患者以及ACE2表达低预后差的TNBC 患者这类亚群能否从中获益值得深入思考和探索。以上结果及推论将为乳腺癌的精准治疗提供新的思路。
代谢重编程是肿瘤的关键标志。2022 年,Xiao 等[21]通过构建TNBC 新型代谢组学,将TNBC分为3 个不同的代谢组学亚组:C1,其特征在于神经酰胺和脂肪酸的富集;C2,特征在于与氧化反应和糖基转移相关的代谢物的上调;C3,具有最低水平的代谢失调。而在TNBC 转录组亚型中,LAR 亚型与代谢组学C1 亚型几乎重叠;BLIS、IM 和MES亚型主要分为代谢组学C2 亚型和C3 亚型。本研究发现,与其他TNBC亚型相比,ACE2在LAR亚型中高表达,这提示ACE2 可能与C1 亚型的神经酰胺和脂肪酸代谢有关。而且通过基因富集分析,也发现ACE2参与脂肪酸代谢途径。并且ACE2高表达的TNBC 患者的预后较好。由此推测,在不同代谢组学的TNBC 亚型中,针对ACE2 的治疗可能会有不同的疗效。
为进一步明确ACE2 在TNBC 中的功能作用,本研究首先进行了细胞增殖实验。结果发现,ACE2 可以有效抑制MDA-MB-231 细胞的增殖能力,但并未发现其对细胞凋亡能力的影响。数据库资料分析发现ACE2 与乳腺癌的远处转移和早期淋巴结转移有关,而又有文献证明了ACE2 可以抑制肿瘤转移,这些结果均提示ACE2 在乳腺癌转移中起着关键作用,但具体机制尚不清楚。肿瘤的侵袭和转移在很大程度上取决于多种MMPs 的蛋白水解活性,这些酶通过降解细胞外基质(ECM)成分和释放基质因子、细胞表面结合的细胞因子、生长因子或其受体,参与基质破坏、新生血管形成和转移[22]。MMPs 家族含有许多成员,其中MMP2 是一种Zn2+-依赖性金属蛋白酶[23]。众所周知,MMP2 在肿瘤侵袭和转移中发挥着重要作用。而本研究也发现,在MDA-MB-231 细胞中过表达ACE2 后,MMP2 的表达显著下调。结果提示ACE2 可能通过下调MMP2 的表达,进而抑制乳腺癌的增殖和转移,ACE2 是如何调控MMP2 的具体机制有待进一步深入探索。以上发现,为深入研究ACE2 调控乳腺癌侵袭转移作用机制提供了重要依据。
综上所述,ACE2 可能是TNBC 的潜在预后生物标志物,并可能参与了氨基酸和脂肪酸代谢,以及肿瘤免疫微环境的调控。同时,ACE2 可能通过下调MMP2 的表达而非依赖细胞凋亡和细胞周期停滞途径抑制TNBC 细胞的增殖和转移。以上结果表明,ACE2在调节TNBC细胞的恶性行为中发挥着重要作用,这将为TNBC的诊治提供新的思路。

