磷化铁掺杂硫化聚丙烯腈储锂动力学行为
刘文武, 徐志强, 雷怡潇, 郑雅文, 达世纪, 吴有智
(1. 兰州理工大学 材料科学与工程学院, 甘肃 兰州 730050; 2. 兰州理工大学 省部共建有色金属先进加工与再利用国家重点实验室, 甘肃 兰州 730050)
面对锂硫电池商业化生产应用需要解决的电子、离子电导率低,硫的利用率低,氧化还原动力学缓慢和最主要的“穿梭效应”等问题,正极的合理设计对解决以上问题具有深远的影响.此前,科研工作者已经验证了通过掺杂等方式来改变碳基底的极性,借助极性的相互作用能够将多硫化物LiPSs锚定在碳正极材料的表面[1].因此,一些极性金属化合物(金属氧化物、金属硫化物、金属氮化物和Mxene)被引入到硫正极材料中,从而有效解决了LiPSs的穿梭问题,提升了电池的循环稳定性[2-3].
由于过渡金属存在未占据的d轨道,过渡金属化合物可以缓慢地催化电化学氧化还原过程,因此引起科研人员的广泛关注.过渡金属化合物在吸附LiPSs的同时存在催化作用,能够避免材料表面的催化活性位点饱和,高效解决了锂硫电池“穿梭效应”问题[4-6].过渡金属磷化物(TMP)具有高的电导率,在增强催化材料和含硫活性物质的电子交换能力的同时,可以有效促进锂硫电池的氧化还原动力学,成为很有前景的锂硫电池的正极催化材料.
为了解决容量衰减和库伦效率低的问题,西安交通大学宋江选课题组提出了硫基聚合物与磷杂化的思路.通过简单的共热法制备的硫化聚丙烯腈能够与磷之间形成S—P键,从而形成坚固的正极,能够适应循环过程中的体积变化,在大电流密度下具有高的循环寿命及库伦效率[7].2019年苏州大学杨鹏课题组通过原位生长的方式在SPAN表面锚定CoS2,在提高了SPAN活性物质负载量的同时,有效地提升了正极材料的导电性,有助于提高硫转化的氧化还原动力学[8].这些策略都证明了通过化学键和、负载过渡金属及磷化物能够有效提升电池的电化学性能,坚固正极,提高导电性.
因此,本文通过高温磷化法合成了FeP,然后经过高温聚合制备了FeP@SPAN,探讨了单原子Fe、P对SPAN还原储锂过程中亲核试剂S2-的HOMO 能级与亲电试剂Li+的 LUMO能级匹配度,及FeP@SPAN正极材料的氧化还原动力学和电化学性能调控的内在机理.构建了Li-FeP@SPAN 金属锂-有机硫二次充电电池,研究了单原子Fe/P掺杂对SPAN放电过程中阴离子S2-的原子轨道能级,及其对储锂反应动力学及电池容量和循环寿命的影响机制.通过调控FeP的比例,探究不同含量的FeP对SPAN正极材料的物相结构、化学键合方式、导电性和储锂动力学,以及电池的电化学性能的影响机制.
1 实验
1.1 试剂与仪器
试验试剂有:N-甲基吡咯烷酮(NMP,分析纯,);三氧化二铁(Fe2O3,分析纯); 聚丙烯腈(PAN,分析纯);聚偏二氟乙烯(PVDF,分析纯),以上药品均购买自上海阿拉丁生化科技股份有限公司.升华硫(S,分析纯);导电炭黑(Super P,分析纯);1M LiPF6+DMC/EC/FEC(电池级);DOL/DME=1∶1(电池级);铝箔(电池级),以上药品均购买自广东烛光新能源科技有限公司.
实验设备有:FITR-670型傅里叶变换红外光谱仪(FITR,美国Nicolet公司);D8ADVANCEX型X射线衍射仪(XRD,日本Rigaku公司);Thermo Scientific K-Alpha型X-射线光电子能谱仪(XPS,美国ThermoFisher公司);JEM-F200型透射电子显微镜(TEM,日本电子株式会社);拉曼光谱仪(Raman,HORIBA公司);紫外光谱仪(UV-Vis,日本岛津);蓝电测试系统(武汉市蓝电电子股份有限公司);电化学工作站(上海辰华仪器有限公司).
1.2 材料制备
1.2.1制备FeP颗粒
按照1∶20的比例称取Fe3O4粉末和NaH2PO2,分别放置在瓷舟的两端,并且药品之间保持5 cm左右的距离.然后将瓷舟放置在充满氩气氛围的管式炉中,瓷舟的放置顺序为NaH2PO2靠近进气口,Fe3O4粉末靠近出气口.管式炉设置为2 ℃/ min的速率升温至450 ℃,然后保温3 h使Fe3O4粉末能够充分磷化,N2的流速为50 mL/ min,收集制备的FeP粉末.
1.2.2复合正极材料的制备
按照3∶1的比例称取硫和PAN,再称取制备好的FeP,FeP与硫的比例为1∶20、1∶10、3∶20,控制材料的总质量为0.5 g.将三种材料在研钵中研磨30 min,然后转移到瓷舟中.放置在管式炉中以5 ℃/min的升温速率加热到350 ℃保持6 h,收集合成好的复合材料备用,分别命名为FeP@SPAN-1、FeP@SPAN-2、FeP@SPAN-3.
1.3 电池的组装
电池的组装均在水、氧值含量 ≤ 0.01的氩气氛围手套箱进行.使用PP作为隔膜,直径为16 mm.使用的电解液将1 M六氟磷酸锂(LiPF6)溶解在碳酸二甲酯/碳酸乙烯酯混合溶液中(DMC与EC体积比为7∶3),并添加5%碳酸氟乙烯酯(FEC).正极由8∶1∶1的复合材料、科琴黑和PVDF组成,烘干后裁剪至直径为14 mm使用,其中活性物质的负载量为44.6%.负极为商用锂金属片.电池制备完毕后须在室温环境中静止6 h后进行电化学性能测试.
2 结果与讨论
2.1 放电与机理示意
图1a为FeP@SPAN的放电反应式.如图所示,在放电过程中,P—S键提供额外的锂存储,并提供活性位点加速氧化还原过程.同时,C—S、P—S键可分别与Li+成键,转化为Li2S.其中,由于SPAN骨架的吡啶环N上存在孤对电子,表现出电负性,形成对Li+的吸引,所以偏向吡啶N侧的SPAN骨架也存在一定量的锂存储.

图1 放电与反应机理示意图
硫化聚丙烯腈主链以S—S共价键的形式连接.当S—S键断裂时,如图1b所示,共用电子对平均分开,形成两组各带一个电子的亲核基团.SP3杂化发生在硫链上S原子所配属的一个2s和三个2p轨道之间,金属锂的2s空轨道与硫的3p轨道重叠,导致键合的成键轨道和反键轨道分别具有强配体和金属特性.在图2c中,与S—S相比,P—S键中S的电负性强于P,P的外层电子会被S原子吸引,导致与P相连的S原子电子云密度大于S—S键上的S.成键与反键之间具有能量差,也称为电荷转移项Δ,取决于Li+和S—S/P—S键之间的电负性差值Δχ,电荷转移项反映了Li—S—S/Li—S—P键的离子共价特性,说明S—P键比S—S键更利于与Li+结合形成Li—S键[9-10].

图2 SPAN与FeP@SPAN材料的SEM和TEM,以及FeP@SPAN材料的EDS
图1d~e为2种材料用于锂硫电池正极反应的示意图.从图中可以看到,掺杂FeP的正极在放电过程中具有更快的氧化还原动力学,促进了Li+的传输.并且和纯的SPAN正极相比,溶解于电解液中的Li2Sn(4≤n≤8)更少,有效缓解了“穿梭效应”,后续的电化学测试同样能够验证这一观点.
2.2 微观形貌与物相结构表征
图2a、c为制备的SPAN和FeP@SPAN的扫描电镜图.从图2a和图2c可以看到,掺杂FeP对SPAN的形貌影响不大,两者均呈现出纳米微球状,并且粒径分布相对均匀.每个纳米微球的尺寸在150 nm左右,微球的表面相对平滑,不存在尺寸较大的孔径和裂纹.掺杂FeP后合成的SPAN微球更少出现破裂及交联的情况,可能的原因是掺杂FeP之后小球的结构更加稳定,形貌更加规则,从而导致更致密的材料,有助于提升体积能量密度[11].
为了进一步证明掺杂的FeP和SPAN进行了有效聚合,对FeP@SPAN进行了TEM和EDS测试分析.如图2b、d所示,FeP@SPAN的结构更加致密,直径为200 nm左右,相较于SPAN没有明显的变化,这和SEM测试得到的结果保持一致.如图2e~i所示,EDS元素映射图像也证实了N、S、P、Fe各元素均匀分布在FeP@SPAN材料上,并且具有44.6%的S含量,P、Fe的含量也与实验中掺杂比例吻合.
为了确定FeP,SPAN与FeP@SPAN复合材料的物相组成,对其进行XRD分析,结果如图3a所示.FeP的衍射图谱与XRD的标准卡片(JCPDSno.78-1443)对比发现,特征峰基本吻合[12-13].对于SPAN及FeP@SPAN复合材料,在25°位置存在一个明显的宽衍射峰,对应(002)晶面.由此可知硫与环化脱氢后的聚丙烯腈共价键合形成无定形石墨/π堆叠共轭结构.此外,与SPAN衍射图谱相比,FeP@SPAN图谱上存在4个明显的特征峰,并且随着FeP添加量的增加,特征峰更明显.这4个衍射峰属于FeP的特征峰,分别位于32.7°、37.1°、48.3°和56.1°,分别对应FeP的(011)、(111)、(211)和(212)晶面.
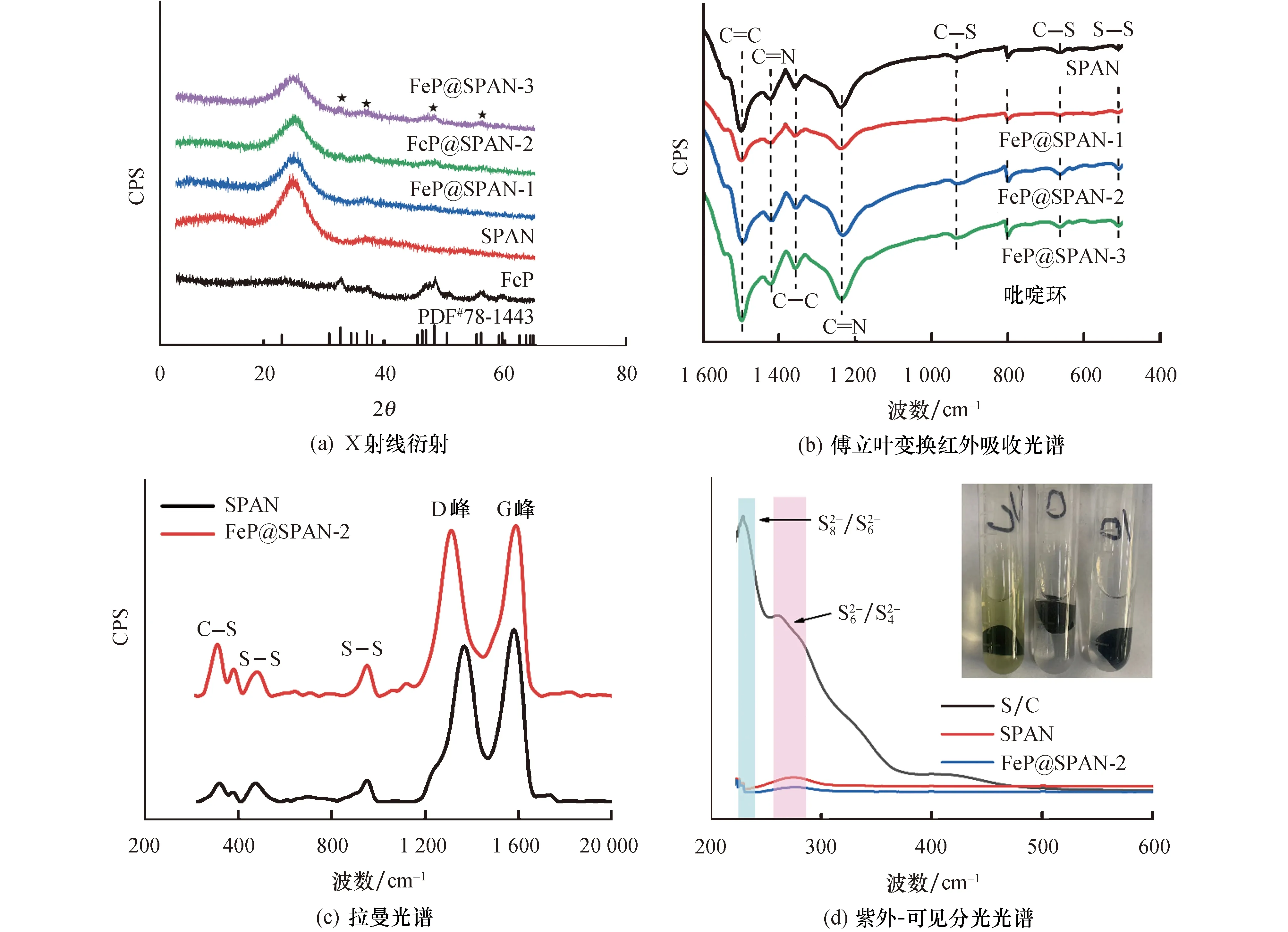
图3 SPAN以及不同比例FeP@SPAN的物相表征及紫外吸附测试
解释SPAN及FeP@SPAN结构是解释其电化学反应现象的基础,因此对合成的FeP@SPAN结构进行分析.图3b为SPAN与FeP@SPAN复合材料的红外光谱图,从图中可以得知,513cm-1处为S—S键的伸缩振动峰,由于S—S键的极性较弱,对应的峰也较弱.665、937 cm-1处的峰分别归因于C—S键的伸缩振动和其与芳族环的相连[14-15].在802 cm-1较为明显的特征峰是芳环的特征振动峰.1 239、1 498 cm-1处所对应的峰是由C==N、C==C对称拉伸产生的,而1 357 cm-1处归属于C—C键伸缩振动峰[16].从图中可以看到在1 422 cm-1处的C==N双键峰随着FeP掺杂比例的提升,峰的大小没有任何改变,说明FeP没有与SPAN上的吡啶环连接,具体的结构还需要参考其他表征测试.
为进一步明确掺杂FeP对SPAN结构产生的影响,对这两种材料进行了拉曼光谱分析.如图3c所示,在313、481、951 cm-1处产生的特征峰分别是C—S、S—S键的峰,这也再次证明S与PAN通过C—S键共价结合.拉曼图谱中1 360 cm-1处是D峰,D峰代表的是C原子的晶格缺陷,D峰的相对强度是结晶结构紊乱程度的反映.1 580 cm-1处是G峰,G峰代表的是C原子sp2杂化的面内伸缩振动.ID/IG数值是用来反应材料结构缺陷的一个重要参数[17-18],ID/IG数值越大,代表着有更多的杂原子取代C原子,材料的缺陷程度加深[19-20].从图中可以得出,相比于未掺杂的SPAN,FeP@SPAN的ID/IG数值由0.907增加到0.984.这个结果说明引入FeP后,材料具有更大的缺陷,即具有更多的吡啶环.这表示SPAN的环化反应进行得更深入,产生了更多的吡啶环,才导致了更大的缺陷.同时SPAN环化反应越完全,SPAN的结构就越规整,更有利于电子的传导[21].

通过X射线光电子能谱(XPS)进一步研究了FeP@SPAN中的P与SPAN之间的相互作用.图4a是两种材料的N 1s精细谱的对比,可以看到,两种材料吡啶环上N的结合能并没有随着FeP的引入而产生变化,说明吡啶环不是FeP的结合位点.图4b为两种材料的S 2p精细谱,从图中可以观察到,161.8、163.6、164.9、167.2 eV处分别为C—S、S—S和S—O键的结合能,这也证明了SPAN正极材料中S与PAN是通过C—S键的形式结合,并且在SPAN上存在S—S键短链.在FeP@SPAN的精细谱中S 2p3/2的结合能向更高的位置移动,这个结果与S—S键的断裂和P—S键的形成有关.图4c的P 2p精细谱同样证明了这一点,131.6 eV处为P 2p3/2,133.4 eV处为P 2p1/2,135.6 eV处的峰为P—S键.图4d为Fe 2p的精细谱,由于FeP掺杂的比例较低,两种元素的含量不高,导致在测试的过程中产生了较大的噪音峰[24-26].但是从谱图中仍不难看出存在两组Fe 2p1/2和Fe 2p3/2峰,这两组峰代表着Fe—O和Fe—P键,同样在一定程度上能够反应FeP与SPAN的结合方式[12,27].
2.3 电化学性能测试
采用恒电流充放电对SPAN及FeP@SPAN正极材料组装的电池进行电化学性能测试,结果如图5a、b所示.由图可知,SPAN的0.1 mV/s的CV曲线相比于FeP@SPAN-2的曲线存在明显的波动,造成这一结果的原因可能是SPAN材料的低电子/离子传输速率的原因.并且从图中也可以看到,FeP@SPAN-2的CV曲线具有更高的氧化峰和还原峰峰值电流,说明掺杂FeP后对提升电荷的传输速率,降低反应能垒具有促进作用.图5c为四种对比样的单圈充CV曲线,为了验证掺FeP在该体系中具有增强反应动力学的性能,从还原峰位置取点计算Tafel斜率.其中SPAN的斜率最大,FeP@SPAN-2材料的斜率最小,根据图5d的结果可以得知,掺杂FeP比未掺杂的材料具有更高的反应动力学,并且10%的掺杂比例具有更好的效果.
同时,测试了不同扫描速率下的CV曲线,比较了FeP掺杂前后的动力学,结果如图5e~f.由图可知,在0.1~0.4 mV·s-1,峰值电流随着扫描速度的增加而增加,掺杂FeP的峰值电流更大,CV曲线形状也保持不变,这验证了其具有良好的电化学稳定性[28-29].这个结果可以归因于以下方面:以SPAN为主链的正极材料具有柔性分子链,可以缓冲活性物质的体积膨胀问题;引入FeP有助于锚定长链可溶LiPSs,有助于消除“穿梭效应”引起的歧化问题[30-31].此外,Li+的扩散系数是影响电池性能的重要因素.根据公式i=avb,这里i为峰值电流密度,v为CV试验的扫描速率,b与锂离子扩散系数呈正相关关系,可以依据b值评价正极的氧化还原动力学问题.图5g~h中氧化峰的b值从38.31增加到84.95,还原峰的b值从67.07增加到116.71,这表明了FeP的掺杂有助于Li+的传输,也再次证明了FeP的掺杂对储锂电化学具有催化作用.
通过EIS测试以评估系统的电化学性能,结果如图5i所示.图中的插图为等效电路的模拟图,代表正极电阻.EIS曲线由高频区(HF)半圆和倾斜曲线组成.HF区域的阻抗归因于集流体和电极上电子传导导致的电阻和电解质的离子阻抗.HF区域半圆反映了电极/电解质界面的电荷转移过程,在模拟图中表示为电荷转移阻抗(Rct).与SPAN相比,FeP@SPAN的R0与Rct明显降低,说明FeP的掺杂可以大大提高活性物质的电导率并降低电荷转移阻抗,从而加速锂化和脱锂过程的电极反应动力学.
最后通过倍率及循环测试评估FeP@SPAN材料的电化学性能.图6a~c所示为0.1~5 A/g的电流密度下的倍率性能测试、恒电流充/放电曲线及FeP@SPAN-2和SPAN库伦效率的柱状图.其中,FeP@SPAN的初始容量均比SPAN的高,并且在不同电流密度下的容量也远大于SPAN.值得注意的是,在2~5 A/g的大电流密度下,FeP@SPAN仍能保持高的比容量,然后在电流密度降回0.2 A/g的时,容量能够很容易地恢复到高比容量的状态.这个结果意味着掺杂FeP后的SPAN不仅能够在大电流密度下实现快速充放电,而且具有高度可逆的容量.在电池组装过程中使用碳酸脂类电解液更有利于抑制LiPSs的溶解,缓解“穿梭效应”,提高电池的循环稳定性.从放电曲线也可以看出,FeP@SPAN仅有一个放电平台,说明实现了“固-固”转化的反应过程,避免了长链LiPSs的产生.
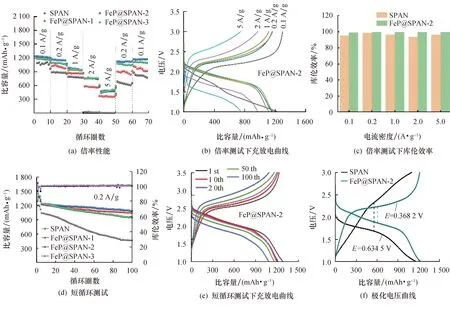
图6 SPAN不同掺杂比例的FeP@SPAN正极的倍率、循环测试和极化电压
图6d~e为掺杂不同比例的FeP@SPAN在0.2 A/g电流密度下短循环测试和充放电曲线,从图中可以看到,掺杂FeP的SPAN具有更高的初始容量.其中电化学性能最好的是FeP@SPAN-2,拥有1 285.8 mAh/g的初始容量,并且在循环100圈后,仍具有1 084.8 mAh/g的高容量,容量保持率为84.28%.图6f为FeP@SPAN-2与SPAN的单圈充放电曲线,其中氧化平台与还原平台之间的电压差值代表极化电位,简称DE.极化电压越小越有利于电化学反应的进行.同样说明掺杂FeP后的正极反应动力学加快,储锂反应动力学得到有效提升[32-33].接着选用短循环性能最好的FeP@SPAN-2与SPAN在1 A/g电流密度下进行长循环测试,结果如图7所示.在500圈的循环中,FeP@SPAN-2始终保持着明显的容量优势.在整个循环过程中,FeP@SPAN-2的每圈容量衰减仅为0.079%.以上两个循环结果表明掺杂FeP能够提升SPAN的初始容量,并且在长循环过程中能够有效抑制容量的衰减.

图7 FeP@SPAN-2与SPAN的长循环测试
3 结论
1) 使用高温磷化法成功合成了FeP,并调控FeP的比例,成功合成了不同FeP含量的FeP@SPAN.FeP@SPAN在小电流和大电流密度下均表现更优秀的容量性能.在0.1 A/g电流密度下具有1 285.8 mAh/g的初始容量,经过100圈循环后,容量保持率为84.28%.在1 A/g电流密度下经过500圈循环后,平均每圈的容量衰减率仅为0.079%.
2) 通过单原子Fe/P负载SPAN高聚物,构建的Fe—P—S·化学配位增强了放电过程中亲核试剂S2-的HOMO能级与亲电试剂Li+的LUMO能级匹配度,降低了还原产物Li2S的成键轨道σ能级,加快了正极储锂反应动力学行为,进而提高了电池的可逆容量和循环寿命稳定性.同时Fe的掺杂有效地解决了硫基聚合物的导电性问题,单原子磷的负载还能够坚固正极,缓解放电过程中产生的体积膨胀.
3) 由于S原子的电负性强于P原子电负性,使得FeP—S·化学配位中的S原子的态密度提高,从而提高了作为亲核试剂S2-的HOMO轨道能级,有效促进了正极的储锂亲电反应,提高了电池的“固-固”转换反应动力学,降低了正极的阻抗,有效缓解了多硫化物的溶解和穿梭效应的发生.

