聚苯乙烯基磁性纳米塑料磁共振成像效果分析
张 龙, 刘浩男, 高 博, 辛 琦, 唐 洁, 艾纯金
(1.兰州理工大学 材料科学与工程学院, 甘肃 兰州 730050; 2. 兰州理工大学 省部共建有色金属先进加工与再利用国家重点实验室, 甘肃 兰州 730050)
纳米塑料(NPs)是环境中塑料碎片的分解产物[1].由于NPs的元素构成与生物相似,很难使用传统的方法识别它们[2-3].因此,通常使用纳米塑料模型来代替环境中的纳米塑料以追踪生物体对纳米塑料的摄入[4-6].近年来,磁共振成像(MRI)技术已经成为生物成像的重要工具[7],为了提高图像的对比度,需要引入MRI造影剂(CAs)[8-9].目前,常用于磁共振成像的T1类造影剂主要以Gd-DTPA和Mn-DPDP及其衍生物为主[10-11].虽然T1类造影剂可以达到造影效果,但是仍存在如对比度低、渗透压高、无靶向性等不足[12].T2类造影剂在MRI T2加权图像中表现为信号强度降低,并呈现出暗对比度[13].常见的T2造影剂主要以超顺磁性铁氧体纳米颗粒(SPIO)为主,如Fe3O4、γ-Fe2O3,、α-Fe2O3等[14].其中,超顺磁性Fe3O4作为T2造影剂获得美国FDA和欧洲药品管理局(EMA)的批准,具有可靠的生物安全性[15].
聚苯乙烯(PS)是应用最广泛的塑料之一[16].相比于其他塑料聚苯乙烯易于合成及修饰,可以采用不同制备方法来调控尺寸大小.因此,PS作为一种纳米塑料模型越来越受到关注[17-19].目前的示踪技术中,MRI具有优异空间分辨率和深层组织穿透能力,超顺Fe3O4纳米粒子作为造影剂具有很好的成像效果.然而,很少有研究使用MRI对PS纳米塑料进行成像.因此,通过合适的方法合成的PS基磁性纳米塑料通过MRI进行成像可能是有益的.
目前的工作提出了一种新的想法,使用MRI对小鼠巨噬细胞标记的纳米塑料进行成像.采集了小鼠巨噬细胞的T2加权MRI图像,以此来验证纳米塑料模型浓度与MRI对比度的增强规律.结果表明,制备的纳米塑料模型具有良好的细胞磁共振成像效果,随着纳米塑料浓度的增加,标记的小鼠巨噬细胞的伪彩图像显示出明显的负对比度增强,灰度图像暗度加深,MRI信号强度逐渐降低.通过这些结果表明合成的纳米塑料模型具有作为细胞MRI成像的应用潜力.
1 实验
1.1 试剂与仪器
实验试剂有:六水合三氯化铁(FeCl3·6H2O,分析纯);七水合硫酸亚铁(FeSO4·7H2O,分析纯);聚乙烯吡咯烷酮(PVP,分析纯);乙二醇(C6H14O4,分析纯);油酸(OA,分析纯);氨水(NH3·H2O,25%),购自国药化学试剂有限公司;乙酰丙酮铁(Fe(acac)3,98%,阿拉丁试剂有限公司);2,2-偶氮二(2-甲基丙基咪)二盐酸盐(V50,97%,美国Sigma-Aldrich公司);苯乙烯(St,分析纯,上海中泰化学试剂有限公司);过硫酸钾(KPS,分析纯);十二烷基硫酸钠(SDS,分析纯);正辛烷(C8H18,分析纯),购自天津白石化工有限公司;十六烷(HD,分析纯,天津大茂化学试剂厂);二甲基亚砜(DMSO,D8418,北京自索莱博科技有限公司);牛血清白蛋白(FBS,35076CV,以色列BI生物科技有限公司);小鼠巨噬细胞系(RAW264.7,中国医学科学院基础医学研究所).
实验仪器有:FITR-670型傅里叶变换红外光谱仪(FITR,美国Nicolet公司);D8ADVANCEX型X射线衍射仪(XRD,日本Rigaku公司);Thermo Scientific K-Alpha型X-射线光电子能谱仪(XPS,美国ThermoFisher公司);TGA 5500型同步热分析仪热分析系统(TG,德国NETZSCH公司);7404型振动样品磁强计(VSM,美国Lake Shore公司);JEM-F200型透射电子显微镜(TEM,日本电子株式会社);Zetasizer-ZS90型激光粒度仪(DLS,英国Malvern公司);NMI20-040V-I型永磁台式磁共振成像仪(MRI,苏州纽迈分析仪器股份有限公司).
1.2 双细乳液聚合法制备Fe3O4@PS
在文献[20]的基础上,采用共沉淀法制备油酸(OA)修饰的Fe3O4磁流体.将24.00 g FeCl3·6H2O和12.40 g FeSO4·7H2O在氮气环境下溶解在100 mL去离子水中,80 ℃下快速加入55 mL氨水,溶液的颜色立即变成黑色.0.5 h后,加入5.00 g OA,悬浮液在80 ℃下继续反应1.5 h后,用去离子水和无水乙醇反复洗涤3次,将油酸修饰后的Fe3O4原位转移到正辛烷中,配置得到固含量为65%的辛烷磁流体.采用双细乳液聚合法制备纳米塑料模型.在超声处理下,将固含量为65%的磁流体(2.00 g)加入0.083% SDS(50 mL)水溶液中,2.50 g St和0.06 g HD加入另一份0.125% SDS(40 mL)水溶液中.将上述两种乳液混合并搅拌均匀,达到均匀分散后,双细乳液体系在80 ℃下反应17 h,形成磁性聚苯乙烯纳米塑料模型,命名为Fe3O4@PS.在此过程中,KPS用作聚合反应的引发剂.
1.3 分散聚合法制备Fe3O4/PS
根据文献[21],制备了水溶性Fe3O4磁流体.在氮气气氛下,将0.52 g Fe(acac)3和2.00 g PVP溶解在50 mL三乙二醇中,272 ℃下在三口烧瓶中回流反应0.5 h后,停止该反应.加入无水乙醇和乙醚反复洗涤3次,最后,在50 ℃下真空干燥12 h.采用分散聚合法制备纳米塑料模型.将1.80 g PVP,0.54 g V50,10.80 g St,24 mL去离子水和200 mL无水乙醇加入到500 mL四口烧瓶中,将反应体系置于30 ℃水浴锅中,通入氮气除氧0.5 h,然后水浴升至恒温70 ℃,5.5 h后,将200 mg质量浓度为8.8 mg/mL磁性纳米粒子的乙醇溶液分成3份,每隔1 h加入一份,之后再继续反应6 h.最后,经8 000 r/min离心后,得到处理后的磁性聚苯乙烯纳米塑料模型(Fe3O4/PS).
1.4 体外磁共振成像
MRI成像在0.5T低场永磁台式磁共振成像仪上进行,使用CPMG脉冲序列和多层自旋回波序列.具体扫描参数如下:扫描平面为冠状面,重复时间(TR)为2 000 ms,回波时间(TE)为70 ms,矩阵大小为256~256,视野(FOV)为100 mm×100 mm.将2种纳米塑料模型配置成不同浓度(1、5、10、20、30、50 μg/mL,2 mL)的DMSO分散液.DMSO组作为对照,进行MRI体外溶液成像.将小鼠巨噬细胞(1×105)与不同浓度的纳米塑料模型(10、25、50、75、100 μg/mL,2 mL)在细胞培养基中于37 ℃孵育24 h,以DMSO组作为对照.细胞在PBS中洗涤3次并以1 000 r/min离心3 min.然后,将细胞溶解在含2.5%戊二醛的PBS中1 h.小心地弃去上清液,并将细胞固定在1.5 mL的1%琼脂糖凝胶中.在Eppendorf管中充分混合后,轻轻摇动以确保适当悬浮,并在混合物固化后进行体外细胞MRI成像.
1.5 小鼠巨噬细胞ICP分析
通过电感耦合等离子体发射光谱(ICP)仪器分析,以确定小鼠巨噬细胞摄取的纳米塑料模型浓度.将MRI成像后的样品取出,放入干净干燥的锥形瓶中,加入5 mL浓硝酸(转移时少量用于冲洗管内壁)后,加入1 mL 30% H2O2,盖上锥形瓶,80 ℃保温3 h,然后加热到160 ℃.样品完全消解后,将温度控制在120 ℃,去除剩余的硝酸,直至溶液无色澄清.冷却至室温后,加入2%硝酸溶液将溶液体积定容至10 mL.
2 结果与讨论
2.1 纳米塑料模型微观结构及尺寸分布
OA和PVP改性的Fe3O4颗粒以及所得的Fe3O4@PS和Fe3O4/PS的TEM图像如图1所示.与平均直径为10 nm的OA改性Fe3O4颗粒相比(如图1a所示),经PVP改性的Fe3O4颗粒(如图1c所示)具有相同的形貌和良好的分散性,说明经OA和PVP改性后的Fe3O4颗粒不会因热力学不稳定而发生团聚.图1b、d是通过高分辨率透射电子显微镜测量单个纳米晶体的晶格间距,分别为0.1305、0.1978nm,可以对应到立方尖晶石结构的Fe3O4中的(620)和(311)晶面,这证明经OA和PVP改性后的Fe3O4仍然具有较高的结晶度.

图1 OA和PVP修饰的Fe3O4颗粒的TEM和HRTEM图像
双细乳液聚合制备的磁性纳米塑料模型尺寸比较均一,如图2a所示,Fe3O4@PS直径为120 nm左右,Fe3O4颗粒随机地嵌入PS基体中,几乎没有未包覆微球的存在(如图2b所示).分散聚合法制备的Fe3O4/PS尺寸为700 nm左右(如图2c所示),粒径分布均匀,并且填充有均匀分散的PVP改性Fe3O4纳米颗粒(如图2d所示),说明在分散聚合制备磁性PS微球反应过程中分批加入Fe3O4-PVP纳米粒子,可以成功制备出球型规整、尺寸较为均一的磁性PS复合微球.

图2 Fe3O4@PS和Fe3O4/PS纳米塑料模型以及局部放大的TEM图像
通过激光粒度仪(DLS)表征了两种纳米塑料模型的大小.两种纳米塑料模型的流体力学直径分别为150、730 nm(如图3a所示),尺寸大于通过TEM测定的粒径大小.这可能是因为TEM是在材料干燥时分析的,而DLS是在样品处于溶液阶段时评估的.DLS分析结果证实了这两种纳米塑料模型具有优异的单分散性和稳定性,它们的单分散性指数分别为0.070、0.052.
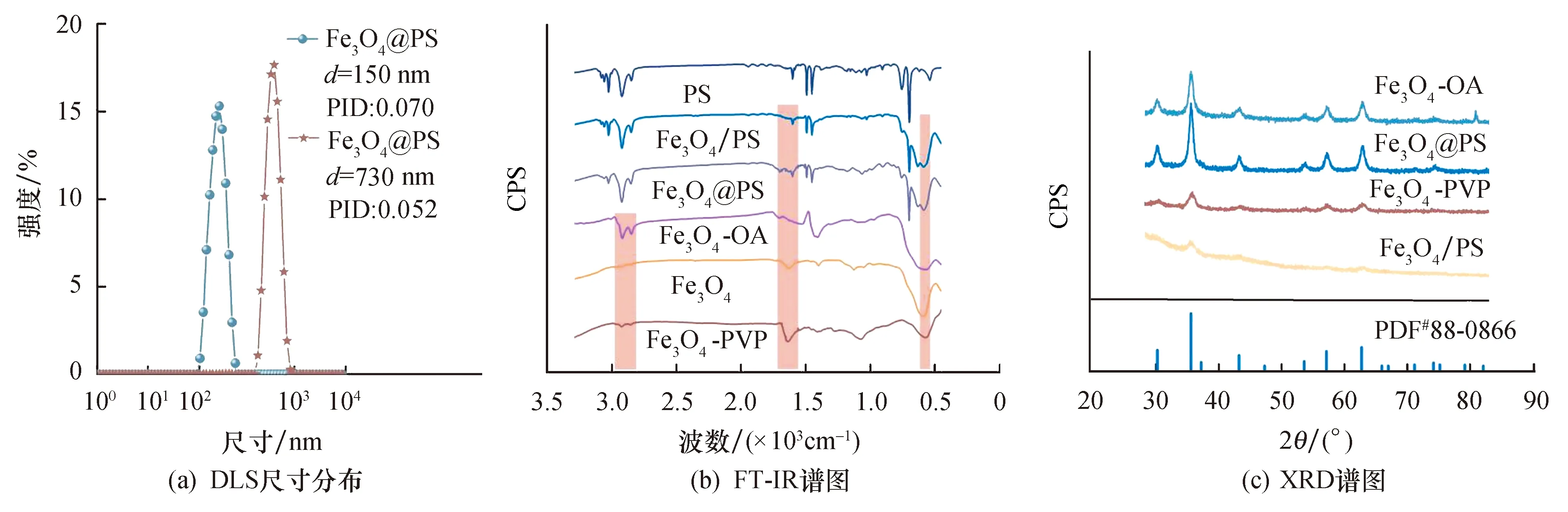
图3 分散在水溶液中纳米塑料模型的粒径分布,FT-IR谱图和物相
图3b为FT-IR光谱图,可以看出,与未修饰的Fe3O4红外光谱相比,OA修饰的Fe3O4光谱在2 922、2 852 cm-1处显示出明显的振动峰,分别对应于—CH3的反对称伸缩振动和对称伸缩振动[22].PVP修饰的Fe3O4在1 640 cm-1处为C==O的特征吸收峰,与纯PVP聚合物在1680cm-1处的C==O的特征吸收峰相比发生红移[23].所有材料(Fe3O4、OA和PVP改性Fe3O4、Fe3O4@PS、Fe3O4/PS)均在580 cm-1处显示特征振动峰[24],表明它们均含有磁性成分.图3c为X射线衍射图,由图可以看出,样品的衍射峰与JCPDS卡(88-0866)中Fe3O4的衍射峰位置一致,表明Fe3O4晶体结构在聚合后没有发生变化.但是,与OA修饰的Fe3O4相比,PVP修饰的Fe3O4和分散聚合制备的Fe3O4/PS的衍射峰强度降低了很多.这可能是由于高温热分解法制备的Fe3O4颗粒尺寸过小,导致晶型发生变化[25],因此衍射峰强度降低.
通过XPS表征纳米塑料模型表面的元素组成,图4a显示Fe3O4@PS颗粒表面主要由C,O和Fe元素组成.Fe3O4@PS表面存在的Fe元素可能是因为聚合反应初期,苯乙烯单体与辛烷磁流体的相容性比较差,随着聚合的进行,纳米Fe3O4颗粒就随着辛烷的挥发而逐步聚集在复合颗粒的一侧,由于XPS可以表征材料表面10 nm左右物质的价态,因此可以表征出Fe3O4@PS表面Fe元素.由图2b放大的Fe3O4@PS TEM图像也可以证明Fe3O4颗粒聚集在复合颗粒的一侧.结合图4b XPS全谱可以看出,Fe3O4/PS表面含有C、O两种元素,说明Fe3O4/PS表面并不含Fe元素,证明PVP修饰的Fe3O4磁性粒子被分散至PS微球的内部.
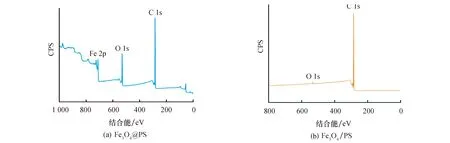
图4 纳米塑料模型XPS谱图
2.2 纳米塑料模型热失重以及磁性能分析
图5显示了样品的TGA结果.由图5a可以看出,OA修饰的Fe3O4共有三个热失重峰,在70~100 ℃时,水分子蒸发,重量损失0.9 wt.%.而在300~400 ℃,重量损失了11.3 wt.%,这部分重量损失可能是由于物理吸附在Fe3O4表面的油酸分子.600~700 ℃,7.2 wt.%的重量损失可能归属于化学键合在Fe3O4表面的油酸分子.最后剩下的残渣是Fe3O4,约占80.5 wt.%.图5b为PVP修饰的Fe3O4纳米粒子TGA热失重曲线,曲线上出现两个明显的热失重峰,出现在200~480 ℃的热失重峰可归属于Fe3O4表面上未配位的PVP,失重量占15.3 wt.%.550~740 ℃出现的失重峰则归属于通过C==O配位作用结合在Fe3O4表面的PVP成分,失重量占15.6 wt.%.最后剩下的残留物Fe3O4约占66.4wt.%.由图5c可知,Fe3O4@PS最明显的热失重峰在400~470 ℃,这是由于PS热分解形成的,重量损失占47.7 wt.%.最终剩余的残渣由Fe3O4和聚合物不完全热分解产生的碳残组成,约占50 wt.%.由图5d可知,Fe3O4/PS在300~500 ℃出现了热失重峰,这是由于Fe3O4/PS中外层PS的热分解与四氧化三铁表面PVP热分解形成的,说明PS是包覆在Fe3O4表面,而并非化学键键合,失重量为97.7 wt.%,最终剩余的残渣由Fe3O4和聚合物不完全热分解产生的碳残组成,约占2.3 wt.%.

图5 OA和PVP修饰的Fe3O4颗粒以及所得纳米塑料模型的TGA和DTG结果
图6为样品的磁滞回线.由图6a、b可以看出,OA和PVP改性Fe3O4颗粒在室温下的饱和磁化强度(Ms)分别为62.58、53.9 Am2/kg.由图6c、d可知,Fe3O4@PS和Fe3O4/PS纳米塑料模型在室温下的饱和磁化强度(Ms)分别为34.73、1.44 Am2/kg.基于它们的零矫顽力和可逆磁滞行为,OA和PVP改性的Fe3O4颗粒和得到的纳米塑料模型具有超顺磁性[26].此外,所得纳米塑料模型中磁性成分的含量可以由饱和磁化强度比值分别计算,为55%和2.6%,这与TGA的结果相近.图6插图显示了OA和PVP改性的Fe3O4颗粒和所得纳米塑料模型在外部磁场下的磁响应,从数码图片来看,纳米塑料模型具有良好磁响应性.
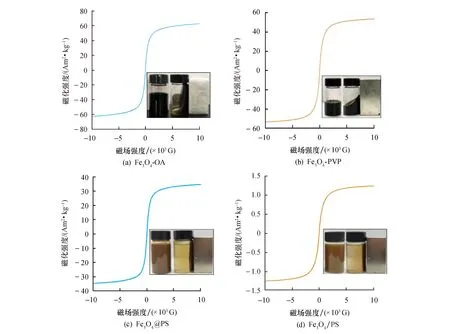
图6 室温下,OA和PVP修饰的Fe3O4颗粒以及所得纳米塑料模型的磁化曲线
2.3 纳米塑料模型体外磁共振成像
在0.5 T低场永磁台式磁共振成像仪上,采集不同浓度Fe3O4@PS和Fe3O4/PS DMSO分散液的T2加权MRI图像和相应的MRI信号,以此来验证纳米塑料模型浓度与MRI对比度的增强规律.由图7a、b T2加权图像可以看出,随着样品浓度的增加,灰度图像变暗.下面对应的伪彩图像进一步证明了得到的纳米塑料模型能够随着浓度的增加提供足够的T2负对比度.此外,由图7c可以看出,Fe3O4@PS和Fe3O4/PS的MRI信号强度衰减明显,当Fe3O4@PS和Fe3O4/PS的浓度由0增加到50 μg/mL时,MRI信号强度分别衰减了约62.75%和52.31%.通过这些结果表明,合成的纳米塑料模型具有作为MRI示踪剂的巨大潜力.
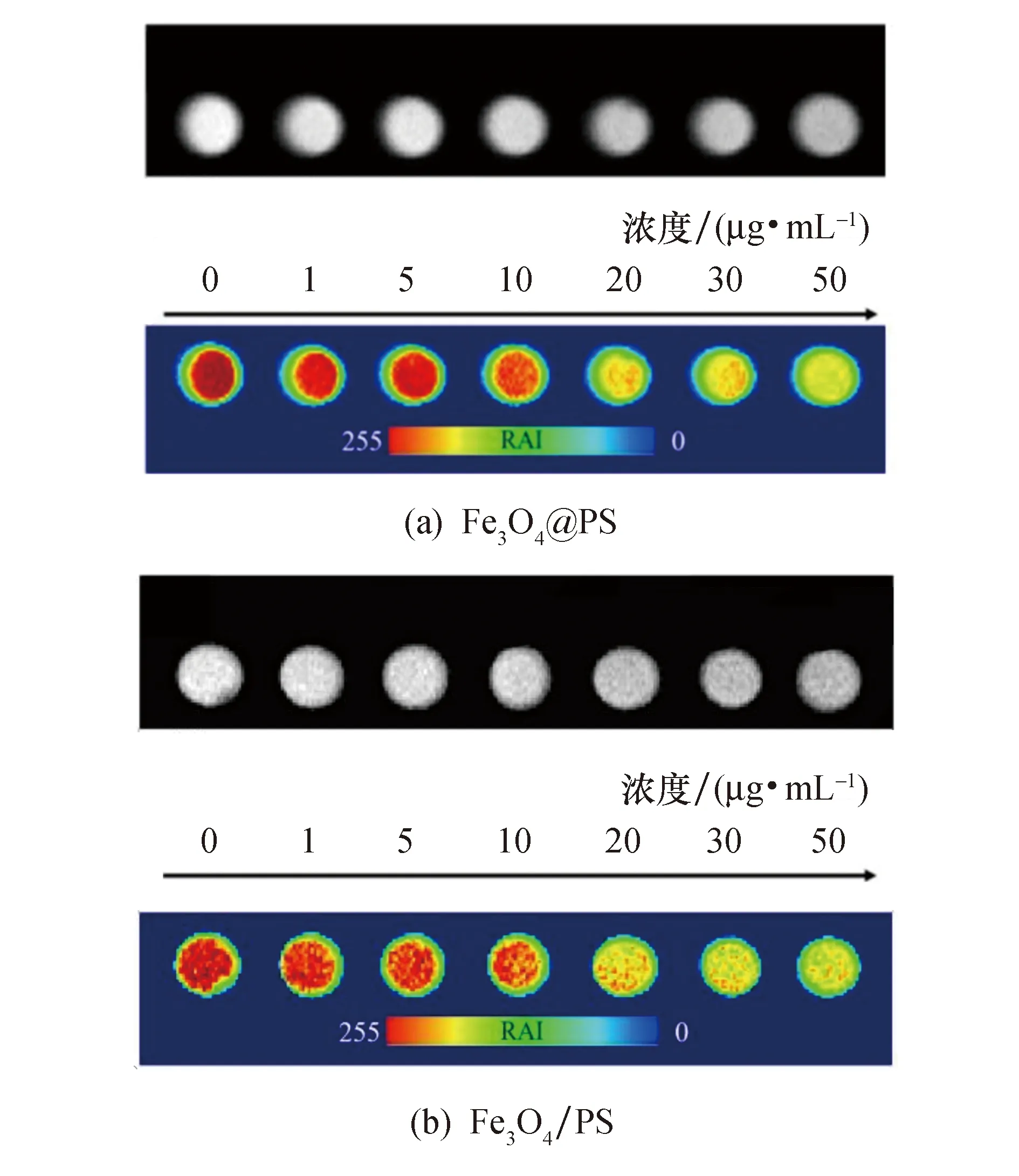
图7 不同浓度纳米塑料模型的MRI T2加权MRI图像
为了确定合成的纳米塑料模型是否具有良好的细胞磁共振成像效果.在相同磁场强度下,使用MRI成像仪收集了Fe3O4@PS和Fe3O4/PS标记的小鼠巨噬细胞的T2加权MRI图像.通过图8a、b小鼠巨噬细胞的T2加权图像可以看出,随着Fe3O4@PS和Fe3O4/PS浓度的增加,标记的小鼠巨噬细胞的伪彩图像显示出负对比度增强,灰度图像依次变暗.在之前的工作中,具有不同浓度梯度功能化氧化石墨烯/Fe3O4杂化物标记的BxPC-3细胞也表现出相同的成像规律[13].
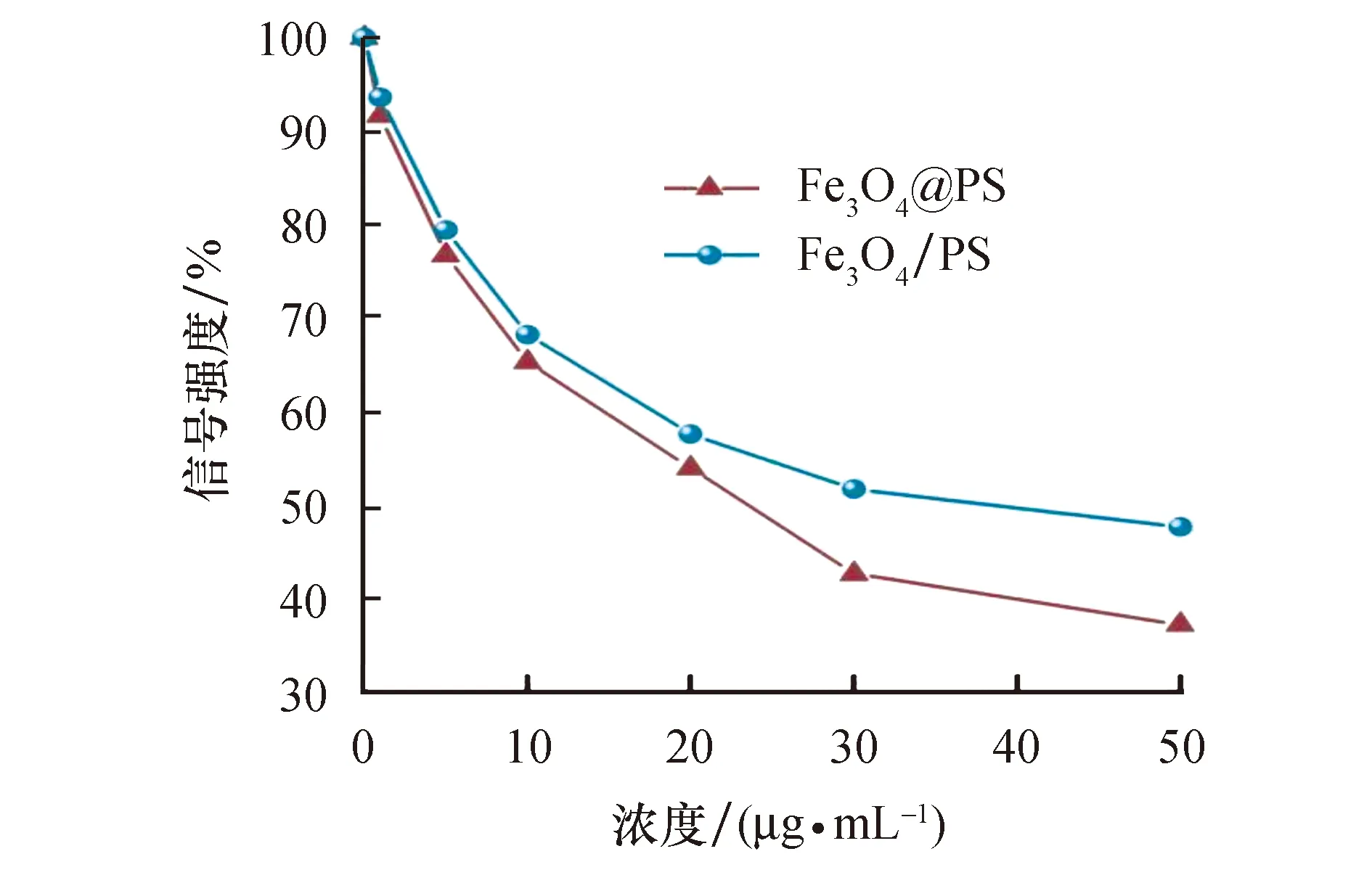
图8 MRI信号强度和浓度关系图
由图9a、b可以看出,随着纳米塑料暴露浓度的增加,小鼠巨噬细胞MRI信号强度逐渐降低.当纳米塑料暴露浓度由0增加到100 μg/mL时,两组样品的细胞MRI信号分别衰减了65.8%和49.3%.暴露Fe3O4@PS的细胞MRI信号衰减更明显,这可能是由于Fe3O4@PS 在室温下的饱和磁化强度更高,在同一外加磁场下,磁共振成像过程中,横向弛豫时间T2更小,横向磁化矢量减少得更快[27],因此,MRI信号更低.通过图9a、b插图中ICP定量结果证明了小鼠巨噬细胞摄取Fe3O4@PS和Fe3O4/PS的量随着样品浓度的增加而增加.所有结果证明了合成的纳米塑料模型可以用于细胞内MRI成像.

图9 暴露于不同浓度纳米塑料模型24 h后小鼠巨噬细胞的T2加权MRI图像

图10 不同暴露浓度小鼠巨噬细胞MRI信号强度与浓度的关系图(插图为暴露不同浓度的纳米塑料模型后,细胞中纳米塑料模型的摄取浓度)
3 结论
1) 通过双细乳液聚合法以及分散聚合法成功制备了两种不同尺寸PS基磁性纳米塑料,两种纳米塑料模型均表现出较窄的尺寸分布以及较强的磁响应性.
2) 随着纳米塑料模型暴露浓度的增加,小鼠巨噬细胞的T2加权图像灰度逐渐变暗,对应的伪彩图像也更加清晰地表明了信号强度的衰减.
3) 当纳米塑料暴露浓度由0增加到100 μg/mL时,两组样品细胞MRI信号强度分别衰减了65.8%和49.3%.Fe3O4@PS纳米塑料模型由于具有更高的饱和磁化强度,因此MRI信号衰减更明显.

