葛根素对非酒精性脂肪肝小鼠糖脂代谢的影响及机制
施凯舜 徐峥 岳跃兵 黄洁
非酒精性脂肪肝(non-alcoholic fatty liver,NAFL)与胰岛素抵抗(insulin resistance,IR)密切相关,属于代谢应激性肝病。研究发现葛根素可有效控制NAFL 的发生、发展,使用葛根素治疗后多数NAFL 患者肝区不适、便溏、乏力等临床症状明显改善,ALT、AST 及γ-谷氨酰转肽酶(γ-glutamyl transpeptidase,GGT)活性均不同程度降低,B 超检查显示肝内回声增强减弱,肝内动静脉显示清晰,肝脏后方回声衰减较前减少,疗效较好[1-3]。本团队前期预实验发现葛根素对NAFL 小鼠模型的血脂血糖代谢、肝组织形态学均有一定程度的影响。本研究拟观察葛根素对NAFL 小鼠模型糖脂代谢及IR 的影响,进一步揭示其治疗NAFL 的药理机制,为葛根素的开发应用提供实验依据。
1 材料和方法
1.1 材料
1.1.1 动物 C57BL/6 雄性小鼠50 只,16~20 g,SPF级,购于中国科学院上海实验动物中心。动物生产许可证号:SCXK2021(沪)-0062,动物使用许可证号:SYXK(沪)2021-0167。
1.1.2 主要试剂 葛根素购于西安瑞林生物科技有限公司,20 mg/瓶,粉剂,批号:202101342,加0.9%氯化钠溶液配成5 g/L 的母液,待用。脂肪酸合酶(fatty acid synthase,FAS)、过氧化物酶增殖物激活受体(peroxidase proliferator-activated receptors,PPAR)、肉毒碱棕榈酰基转移酶-1(carnitine palmityl transferase-1,CPT-1)、磷酸烯醇式丙酮酸羧化酶(phosphoenolpyruvate carboxykinase,PEPCK)抗体、甘油醛-3-磷酸脱氢酶(glyceraldehyde-3-phosphate dehydrogenase,GAPDH)抗体均购于美国Proteintech 生物公司,批号分别为13098-1-AP、15540-1-AP、15184-1-AP、14892-1-AP、60004-1-Ig;硬脂酰辅酶A 去饱和酶1(stearyl coenzyme a dehydrogenase-1,SCD-1)、磷酸化胰岛素受体底物1(insulin receptor substrate 1 phosphorylation,p-IRS1)、磷酸化蛋白激酶B(phosphorylated protein kinase B,p-Akt)、磷酸化糖原合成激酶3β(phosphorylated glycogen synthase kinase-3β,p-GSK3β)抗体均购于英国Abcam 抗体公司,批号分别为ab236868、ab4776、ab38449、ab93926;葡萄糖-6-磷酸酶(glucose-6-phosphatase,G-6-Pase)抗体购于北京博奥森生物技术有限公司(批号:bs-13253R);SDS-聚丙烯酰胺凝胶电泳(sodium dodecyl sulfate polyacrylamide gel electropheresis,SDS-PAGE)蛋白上样缓冲液、电化学发光(electro-chemi-luminescence,ECL)试剂盒购于碧云天生物技术有限公司,批号分别为P0015L、P0018S;二喹啉甲酸(bicinchoninic acid,BCA)蛋白浓度测定试剂盒购于宝生物工程(大连)有限公司,批号:AIG1851A。
1.2 方法
1.2.1 造模、分组及处理 采用随数字表法机取10只小鼠作为对照组,另40 只小鼠造模,造模方法参照文献[4]。造模组小鼠予以高反式脂肪酸高果糖饲料(购于美国Research Diets 公司)和复合高糖饮水(购于南通特洛菲饲料科技有限公司)喂饲10 周,自由进食与饮水。高脂饲料热量为5.56 kcal/g,其中58%的能量来源于脂肪;高糖饮水浓度为42 g/L,糖配方为55%果糖∶45%蔗糖。对照组小鼠饲以对照低脂饲料(购于美国Research Diets 公司)16 周,自由进食与饮水。对照饲料热量为4.07 kcal/g,其中11%的能量来源于脂肪。10 周后从造模组随机取4 只小鼠作为造模检测标准,颈椎脱臼法处死小鼠,打开腹腔,取其下腔静脉血液及新鲜肝脏。血清检测提示ALT、AST、TG 水平明显升高,病理检查提示肝脏组织有不同程度的脂肪变性、炎细胞浸润和肝细胞的气球样变,肝细胞因脂肪变性肿胀呈椭圆形或圆形,大量的脂肪空泡充斥于胞质内,肝小叶可见混合的中性粒细胞及单核细胞浸润,提示造模成功。10 周后,36 只造模小鼠随机分为模型组、葛根素高剂量组、葛根素中剂量组、葛根素低剂量组,每组9 只。参照周银吉等[5]方法,葛根素低、中、高剂量组按照0.4、0.6 和0.8 g/(kg·d)剂量分别抽取葛根素母液,使用0.9%氯化钠注射液稀释后,按5 mL/只灌胃;模型组小鼠以0.9%氯化钠溶液灌胃,5 mL/只,共给药6 周,给药期间各组继续给予相应饲料及饮水。
1.2.2 样本获取和处理 16 周末,各组随机取4 只小鼠,禁食12 h 后,用2%戊巴比妥钠按3 mL/kg 剂量腹腔注射麻醉,颈椎脱臼法处死小鼠,打开腹腔,在同一肝叶和位置切取肝脏组织,分装于离心管中,-70°C冰箱保存备用。
1.3 相关蛋白质表达的检测 采用Western blot 法。取各组小鼠肝脏组织,根据BCA 蛋白浓度测定试剂盒方法加入裂解液冰上裂解30 min,4 ℃12 000 r/min 离心5 min,留取上清液,即为提取的总蛋白;检测蛋白浓度并将凝胶中的蛋白质转移至膜上,加入5%脱脂牛奶封闭1~2 h 后洗膜3 次;依次加入稀释后的FAS、SCD-1、PPAR-α、CPT-1、p-IRS1、p-Akt、p-GSK3β、G-6-Pase 和PEPCK 一抗,4 ℃,摇床过夜;加入二抗,37 ℃,2 h,摇床;洗膜5 次;将蛋白化学发光显影,记录、拍照、扫描和保存。以GAPDH 为参照,计算各组小鼠各蛋白灰度值。
1.4 统计学处理 采用SPSS 19.0 统计软件。计量资料组间比较采用单因素方差分析,两两比较采用LSDt检验或Dunnett-t检验。P<0.05 为差异有统计学意义。
2 结果
2.1 小鼠脂肪代谢情况
2.1.1 5 组小鼠FAS、SCD1 蛋白灰度值比较 相比模型组,葛根素低、中和高剂量组FAS、SCD1 蛋白灰度值均极显著降低,差异均有统计学意义(均P<0.01);除葛根素低剂量组和中剂量组FAS 蛋白灰度值比较,组间差异无统计学意义(P>0.05)外,其余各组间比较,差异均有统计学意义(P<0.01),呈一定的剂量依赖性,见图1。

图1 5 组小鼠FAS 和SCD1 蛋白灰度值比较
2.1.2 5 组小鼠PPAR、CPT-1 蛋白灰度值比较 相比模型组,葛根素各剂量组PPAR、CPT-1 蛋白灰度值均极显著升高,差异均有统计学意义(均P<0.01);随葛根素处理浓度升高,葛根素低、中、高剂量组间PPAR、CPT-1 蛋白灰度值均显著升高,差异均有统计学差异(均P<0.01),见图2。

图2 5 组小鼠PPAR 和CPT-1 蛋白灰度值比较
2.2 小鼠IR 情况
2.2.1 5 组小鼠p-IRS1、p-Akt 及p-GSK3β 蛋白灰度值比较 相比模型组,葛根素低、中、高剂量组p-IRS1、p-Akt 及p-GSK3β 蛋白灰度值均极显著升高,差异均有统计学意义(均P<0.01);除低、中剂量组间p-IRS1、p-GSK3β 蛋白灰度值比较,差异均无统计学意义(均P>0.05)外,其余各组间比较,差异均有统计学意义(均P<0.01),呈一定的剂量依赖性,见图3。
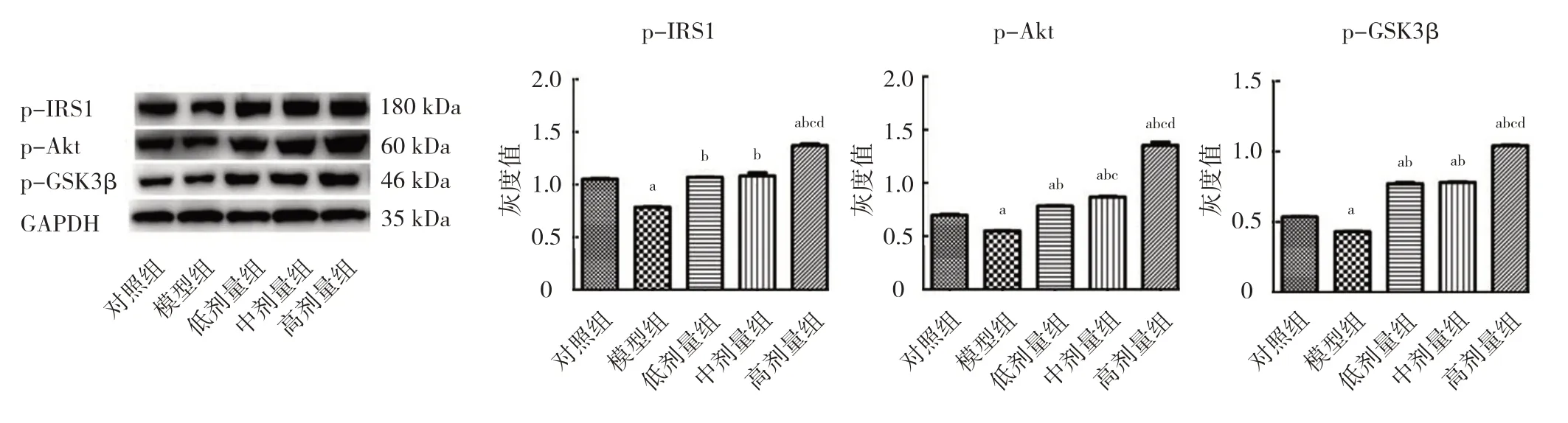
图3 5 组小鼠p-IRS1、p-Akt 和p-GSK3β 蛋白灰度值比较
2.2.2 5 组小鼠PEPCK、G-6-Pase 蛋白灰度值比较相比模型组,葛根素中、高剂量组PEPCK 和G-6-Pase蛋白灰度值均显著降低,差异均有统计学意义(均P<0.01)。随葛根素处理浓度升高,葛根素低、中、高剂量组间PEPCK 和G-6-Pase 蛋白灰度值均显著降低,差异均有统计学差异(均P<0.01),见图4。

图4 5 组小鼠PEPCK、G-6-Pase 蛋白灰度值比较
3 讨论
研究认为,IR 是NAFL 的重要发病机制。胰岛素可直接抑制脂类分解,当机体处于IR 状态时,胰岛素水解TG 的能力下降,TG 积累,极低密度脂蛋白(very low density lipoprotein,VLDL)合成增加;同时脂蛋白脂肪酶(liportein lipase,LPL)的活性被削弱,导致VLDL降解减少,肝细胞内VLDL 大量蓄积,形成脂肪肝[6]。葛根素是从中药葛根中提取的有效成分,属异黄酮类化合物,具有改善IR、清除氧自由基和抗脂质过氧化的作用,可有效保护肝细胞、抑制肝纤维化[7-9]。研究发现,葛根素具有保肝护肝、降糖降脂、抗炎等药理功能,对治疗和缓解NAFL 有利[10]。
FAS 和SCD-1 是调控脂肪生成的2 个主要限速酶,FAS 能催化乙酰CoA 和丙二酸单酰CoA 合成软脂酸。研究发现肥胖和代谢综合征患者SCD-1 水平上升,抑制SCD-1 的表达则导致线粒体中的脂肪消耗速度加快[11]。本研究中,葛根素各剂量组FAS 蛋白、SCD-1 蛋白灰度值显著降低,提示葛根素抑制了NAFL 小鼠肝细胞内FAS 和SCD-1 的蛋白表达,从而影响脂肪代谢途径。CPT-l 是脂肪酸β 氧化过程中的主要限速酶,CPT-1 被激活后以载体为核心功能参与脂肪酸线粒体β 氧化,可将长链脂肪酸高效通过线粒体内膜,到达线粒体基质,加速脂质代谢,从而降低血清TC 水平[12]。CPT-1 与PPAR-α 组成PPAR-α/CPT-1信号通路[13]。PPAR-α 是游离脂肪酸受体,在脂肪酸β 氧化、能量代谢等过程中发挥关键作用。据报道PPAR-α 通过节肝脏中脂肪酸的摄取和代谢,降低VLDL 与TG 产生,并调节血管内TG 的水解和HDL 的产生,从而实现降血脂的作用[14]。本研究发现低、中、高剂量葛根素可不同程度地激活PPAR-α/CPT-1 表达,促进脂肪酸β 氧化,且以高剂量组增强PPAR-α/CPT-1 表达效果最为显著。提示葛根素可能通过PPAR-α/CPT-1 信号途径促进脂肪氧化分解,调控脂质代谢从而改善肝脏脂代谢。
有研究显示,葛根素能下调NAFL 患者血清瘦素水平,改善患者IR,从而加强胰岛素的作用[15]。p-IRS1、p-Akt 及p-GSK3β 是胰岛素信号通路中的关键蛋白。本研究中,随着葛根素浓度增加,这些蛋白灰度值上升,即蛋白质表达增多。可见葛根素是通过改善小鼠IR 状态对NAFL 小鼠发挥治疗作用的。糖脂代谢主要在人体肝脏内完成,NAFL 患者存在肝脏糖异生增加的现象,体内存在大量内源性葡萄糖。G-6-Pase 和PEPCK 是影响糖异生的限速酶,其含量高低决定了糖异生的速度[16]。干预肝糖异生、减少肝葡萄糖生成,将为改善肝IR 提供广阔前景。本研究发现,葛根素中、高剂量组G-6-Pase 和PEPCK 蛋白灰度值显著低于模型组,说明葛根素可以有效抑制G-6-Pase和PEPCK 的表达。即葛根素通过抑制糖异生达到治疗NAFL 的目的,但具体机制还需进一步验证。
综上所述,葛根素可通过影响糖脂代谢治疗NAFL。

