ICU 脓毒症患者肠内喂养不耐受风险预测模型构建
祝利红 蔡国龙 林娟 陈芳 沈延飞 邵菊琴
脓毒症是一种宿主对感染反应失调引起的危及生命的器官功能障碍,主要表现为免疫反应增强。在ICU 患者中,脓毒症是发病率和致死率均较高的主要疾病[1]。肠内营养尤其是早期肠内营养可以调节机体炎症反应,改善免疫功能障碍,减轻肠道屏障损伤,被证实可提高脓毒症患者的生存率,是其预后的独立影响因素[2]。美国肠外与肠内营养学会(American Society for Parenteral and Enteral Nutrition,ASPEN)指南建议危重症患者尽早启动肠内营养支持治疗[3]。ICU 患者由于病情严重,极易出现胃肠道功能障碍,从而导致肠内喂养不耐受(enteral feeding intolerance,EFI),这可能和机械通气、镇静剂、血管活性药物等的应用有关[4]。一项系统综述显示ICU 患者EFI 发生率为2%~75%,主要表现有胃潴留、腹胀、腹泻、恶心、呕吐、反流等症状[5]。研究显示脓毒症患者出现EFI 的风险较高[6-7]。患者一旦出现EFI,临床医护人员便会减慢喂养速度或停止喂养,从而加大了营养不良的发生风险[8]。对脓毒症患者而言营养不良将直接与发病率增加、医院感染、住院时间延长和死亡率相关[9-10]。因此早期识别脓毒症患者EFI 的风险相当重要。目前关于脓毒症患者EFI的研究主要集中在易感因素的分析上[11-12]。本研究基于浙江医院自主研发的科研数据库,建立脓毒症患者EFI 风险预测模型,以期早期识别风险,优化临床决策和营养治疗方案,为防治EFI提供参考。
1 对象和方法
1.1 对象 回顾性选取本院科研数据库内2019 年6月至2022 年6 月诊断为脓毒症的140 例患者。纳入标准:(1)年龄≥18 岁;(2)基于Sepsis-3 标准诊断为脓毒症[13];(3)住院时间≥3 d;(4)行持续性泵入肠内营养治疗。排除标准:(1)胃肠道出血或肿瘤;(2)慢性腹泻或肠炎;(3)接受肠内营养治疗≤24 h;(4)明确诊断为肠道感染引起的腹泻;(5)因各种原因数据库失访病例。本研究经本院医学伦理委员会审查通过[批准文号:2020 临审第(114K)号],免除知情同意。
1.2 资料 收集患者资料。(1)人口学及疾病资料:年龄、基础疾病、性别、BMI、平均动脉压(mean arterial pressure,MAP)、体温、入住ICU 日期;(2)各类危重疾病评分:急性生理学和慢性健康状况评价(acute physiology and chronic health evaluation,APACHE)Ⅱ评分、格拉斯哥昏迷量表(Glasgow coma scale,GCS)评分、序贯器官衰竭评估(sequential organ failure assessment,SOFA)评分、改良版危重症营养风险评估(modified nutrition risk in the critically ill,mNutric)评分、营养风险筛查(nutritional risk screening,NRS)2002 评分、里士满躁动镇静量表(Richmond agitation sedation scale,RASS)评分;(3)实验室资料:收集患者血白蛋白、血钾、平均血糖(mean blood glucose,MBG)、血糖变异值、乳酸、血钠、各类炎症指标等;(4)治疗资料:机械通气、持续性肾脏替代治疗(continuous renal replacement therapy,CRRT)、镇静和镇痛药物、抗生素等;(5)营养方案:启动时间、途径、配方、能量、EFI 表现及处理等。
1.3 EFI 判定标准及分组 EFI 目前普遍接受的定义是,在没有机械性梗阻的情况下,由于胃肠道功能障碍的临床表现而导致肠内喂养的减少或暂停,进而无法为患者提供足够的能量或营养[14]。包括(1)胃潴留:≥200 mL/24 h;(2)呕吐:从口咽或鼻咽部呕吐1 次或多次;(3)腹泻:24 h 内出现≥3 次的稀水样粪便,每次排便量>200 g;(4)腹胀:腹内压≥12 mmHg(1 mmHg=0.133 kPa);(5)误吸:口咽食物、分泌物或食管反流进入声门下气道;(6)反流:胃内容物反流到口咽部,无恶心、干呕等症状。相关研究表明EFI 发生高峰为启动营养支持治疗的第3 天[15],本次研究回顾数据时间为喂养开始到第7 天。呕吐、误吸、腹胀、反流、腹泻性状等根据医疗和护理记录判断;当同时出现多种不耐受临床表现和体征时,以最主要的症状作为结局。根据有无发生EFI 分为耐受组和不耐受组。
1.4 统计学处理 使用R(4.0.1)软件进行数据分析。正态分布的计量资料以表示,组间比较采用两独立样本t检验;非正态分布的计量资料以M(P25,P75)表示,组间比较采用非参数检验;计数资料采用例(%)表示,组间比较采用χ2检验。使用logistic 回归分析筛选有意义的变量,将单因素分析P<0.05 的变量纳入多元回归分析,筛选出风险因素并建立列线图。绘制ROC 曲线和校准曲线验证模型的可靠性。使用Bootstrap 重新抽样法进行模型内部验证评估模型的预测效能。绘制决策曲线并分析不同阈值概率下的模型辅助预测的净收益。P<0.05 为差异有统计学意义。
2 结果
2.1 基本情况 纳入的140 例患者,年龄81(65,87)岁,常见的基础疾病为呼吸系统疾病(50 例,35.71%)和神经系统疾病(35 例,25.00%)。耐受组71 例,不耐受组69 例,EFI 发生率为49.29%。发生时间为启动肠内营养治疗的2~5 d。临床表现胃潴留、腹泻、腹内压升高、呕吐、反流、误吸和消化道出血,其中胃潴留、腹泻和腹胀发生率最高,分别为19.29%(27 例)、10.00%(14 例)和9.29%(13 例)。
2.2 危险因素分析 单因素分析显示,耐受组和不耐受组年龄、APACHE Ⅱ评分、mNutric 评分、是否使用镇静药物、腹内压、MBG、感染部位、抗生素种类、CRRT、血钾、血糖变异值、乳酸、目标能量等13 个因素比较,差异均有统计学意义(均P<0.05),见表1。以发生EFI 为因变量(否为0,是为1),单因素分析中具有统计学意义的13 个变量为自变量,赋值后采用二元logstic 回归方法进行多变量选择。结果显示:APACHE Ⅱ评分(OR=1.092,95%CI:1.006~1.185)、mNutric 评分(OR=2.916,95%CI:1.842~4.616)、CRRT(OR=3.584,95%CI:1.043~12.311)、腹内压≥12 mmHg(OR=8.253,95%CI:2.400~28.370)是脓毒症患者发生EFI 的独立危险因素,低热卡能量是脓毒症患者发生EFI 的保护因素(OR=0.212,95%CI:0.069~0.644)。由此建立的模型为:y=0.087x1+1.070x2+1.276x3+2.111x4-1.551x5-8.390,式中,x1为APACHE Ⅱ评分,x2为mNutric 评分,x3为CRRT,x4为腹内压,x5为低热卡能量。见表2。
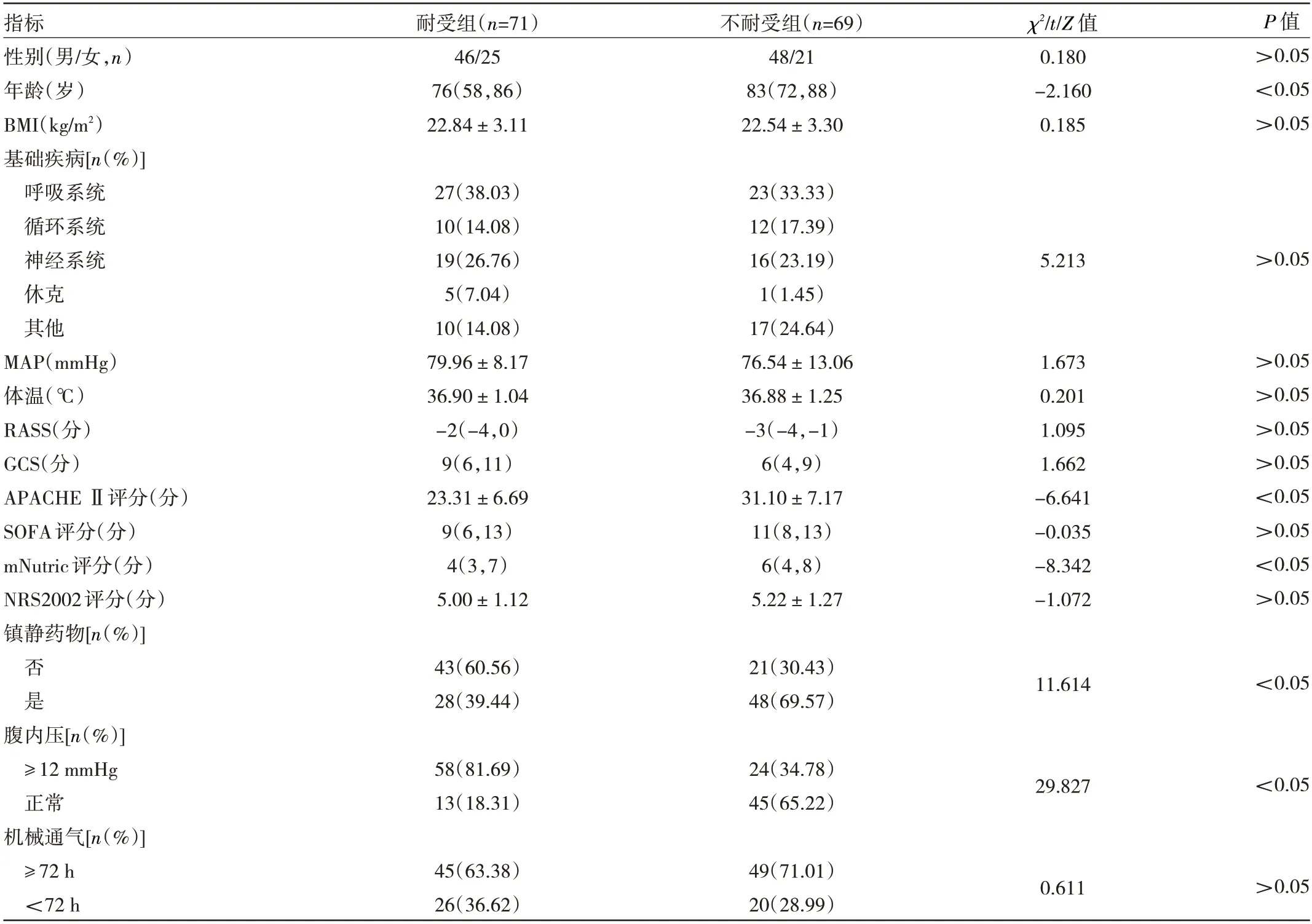
表1 两组患者一般资料比较

表2 脓毒症患者肠内营养喂养不耐受多因素分析
2.3 脓毒症患者发生EFI 概率的预测列线图 利用APACHE Ⅱ评分、mNutric 评分、CRRT、腹内压、低热卡能量等5 个风险因子构建预测脓毒症患者发生EFI 风险的列线图。将列线图中各个变量所得分值进行相加,得到的总分即可预测脓毒症患者发生EFI 的概率,见图1。

图1 脓毒症患者EFI 风险列线图
2.4 风险预测模型的验证 ROC 曲线显示,建立的风险预测模型评估脓毒症患者发生EFI 的AUC 为0.906,95%CI:0.783~1.000(P<0.01),最大约登指数0.192,特异度0.833,灵敏度0.875,见图2A。利用Bootstrap 对建模数据重复抽样进行内部验证,绘制校准曲线,结果显示校准曲线的预测结果与预期结果间差异无统计学意义(P>0.05),见图2B,可见模型具有良好的预测稳定性和一致性。

图2 脓毒症患者EFI 模型的ROC 曲线和校准曲线
2.5 决策曲线分析临床价值 决策曲线分析结果显示:模型对脓毒症患者EFI 发生具有较好的预测价值,见图3。

图3 模型临床决策曲线
3 讨论
ICU 患者因病情严重、血流动力学不稳定等原因常导致多器官功能障碍,其中胃肠道最早、最容易受累进而引起EFI[16]。Lavrentieva 等[6]研究显示ICU 患者EFI 发生率为30%~70%,其中ICU 的脓毒症患者EFI 发病率约为35%。邹圣强等[17]发现脓毒症患者EFI 发生率为41.27%~73.50%。本研究中脓毒症患者EFI 的发生率为49.29%,与既往一致。不耐受组的患者胃潴留发生率(19.29%)相较腹泻、呕吐、误吸要高,出现也最早;两组年龄、使用镇静药物、营养途经等比较,差异均有统计学意义,与Hu 等[18]报道一致。苏小平等[19]发现MBG 可能与脓毒症患者发生EFI 有关,和本研究发现血糖变异与EFI 也存在相关性的结果一致,这可能与患者糖代谢紊乱并因此影响了脓毒症的病理进程有关[20],而血糖变异度在一定时间内能够较好地反映机体血糖水平的动态变化[21],未来可进一步深入研究。
APACHE Ⅱ评分常用于评估患者疾病严重程度,广泛用于确定治疗和预测预后。APACHE Ⅱ评分涵盖多个参数,如血清乳酸水平和应用血管活性药物的低血压均与EFI 风险增加有关[22]。本研究发现高APACHE Ⅱ评分与脓毒症患者EFI 发生风险增加相关(OR=1.092),与向艳等[11]研究结果(OR=1.16)接近。APACHE Ⅱ评分增加提示病情加重,急性疾病状态下肠道缺血严重,可增加EFI 发生率[23],对高APACHE Ⅱ评分脓毒症患者应慎重考虑肠内营养的启动实施。美国重症医学会和ASPEN 指南推荐可对危重患者采用NRS2002 或mNutric 评分来评估营养不良风险[24-25]。mNutric 评分越高,EFI 发生率越高[26]。Jeong 等[27]对482例脓毒症患者测定mNutric 评分,其中值为4 分。本研究发现mNutric≥5 分是脓毒症患者EFI 的独立危险因子(OR=2.916)。mNutric 评分综合考虑年龄、共病数量、严重程度等变量,适用于确定器官功能障碍水平和死亡风险。然而,mNutric 因缺乏对基础营养的评估,作为EFI 预测因子仍需探讨。在ICU 患者中,营养风险越高越要及早启动肠内营养治疗。最新指南建议无休克脓毒症患者采用“早期渐进”肠内营养治疗[28]。研究发现,提供目标能量60%的肠内营养比全肠内喂养更有益,能改善屏障功能、营养及炎症,降低EFI 风险[9,29]。脓毒症患者因肠道功能下降,全能量喂养会加重胃潴留[30]。本研究发现低热卡能量喂养可降低EFI 发生率,这可能与低热卡能量可促进细胞存活、增强患者免疫功能和改善胃肠道保护机制有关[31]。因此,对脓毒症患者提供目标能量60%的中度肠内营养是预防EFI 的有效策略。
腹内压升高和CRRT 也是脓毒症患者EFI 发生的独立危险因素。危重患者腹内压升高发生率为18.3%~58.8%,是独立死亡预测因子[32]。本研究发现腹内压≥12 mmHg 是脓毒症患者EFI 发生的独立危险因子。脓毒症患者中腹内压升高发生率较高(76.5%),这与中心静脉压、呼气末正压、SOFA 评分、气道压力、液体平衡有关[33-34]。腹内压升高导致肠动力下降、供血不足,加剧肠功能障碍,引发EFI[35]。当腹内压≥20 mmHg时,EFI 发生风险增加2.7 倍[36]。建议对脓毒症患者应严密监测腹内压,动态调整喂养方案,减轻胃肠道负担,预防肠源性感染。脓毒症引发的血流动力学变化也是高死亡率的主因,通常需CRRT 改善微循环[37]。Yu 等[38]发现CRRT 是导致EFI 中胃潴留发生的独立危险因子,与本研究结果一致。相关研究证实,容量变化或可引起胃肠功能障碍,因此CRRT 治疗脓毒症时可能诱发EFI[39-40]。制定脓毒症患者喂养方案时需谨慎考虑CRRT 治疗引起的EFI。
本研究采用logstic 方法进行多变量的选择,最终确定了APACHE Ⅱ、CRRT、腹内压、mNutric 评分和低热卡能量5 个独立预测的风险因子,绘制的列线图清晰显示了预测因子与脓毒症患者发生EFI 的关联强度,为临床提供了定量的预测方式。同时对构建的EFI 风险预测模型进行了校准度、区分度、临床效能的多方位评估,显示该模型具有较好的预测能力。与其他模型相比,本模型包含的指标较容易获取和评估,更适合临床使用。同时该模型能够有效识别EFI 高风险患者,预测效能较好,能够为临床决策提供科学的评估依据。
早期肠内营养支持治疗已被证实对脓毒症患者具有积极效益,为寻求最佳营养,早期识别预测EFI 发生风险十分重要。本研究构建的风险预测模型可有效预测EFI 发生,临床医护可据此对患者进行个体化护理并及时调整营养方案调整。本研究也存在局限:如缺乏对EFI 的广泛定义;缺少EFI 客观的判断标准等。同时,回顾性的测量值可能受到包括研究者和管道相关因素的影响;目前本院数据库只收录单个中心的患者,样本量较少,因此缺少对模型的外部验证,并会导致研究结果的偏差。因此未来需要更加精心设计来进行多中心、大样本的研究验证。

