砂滤模式下马口鱼消化道细菌的组成、分类与相关性
韩明明,詹 炜,黄福勇,李方兴,楼 宝,*
(1.浙江省农业科学院 水生生物研究所,浙江 杭州 310021; 2.武义县心怡锦鲤家庭农场, 浙江 武义 321200)
肠道是鱼体内集营养物质消化和吸收、免疫、内分泌于一体的重要场所,其所含的微生物因种类繁多、基因组成复杂而被称为生物体的“第二基因组”[1-2],其中,细菌是鱼肠道微生物的主要组分[3]。海水鱼类肠道以革兰氏阴性兼性厌氧菌为主,主要包括不动杆菌属(Acinetobacter)、交替单胞菌属(Alteromonas)、气单胞菌属(Aeromonas)、黄杆菌属(Flavobacterium)、噬纤维菌属(Cytophaga)、微球菌属(Micrococcus)、莫拉氏菌属(Moraxella)、假单胞菌属(Pseudomonas)和弧菌属(Vibrio)[4-6]。淡水鱼类肠道中除气单胞菌属、不动杆菌属、假单胞菌属外,肠杆菌科(Enterobacteriaceae)、拟杆菌属(Bacteroides)、梭状芽孢杆菌属(Clostridium)和梭杆菌属(Fusobacterium)也是主要的优势菌属[7-9]。依据特殊菌类对养殖鱼类肠道的有益作用而筛选出的益生菌,如枯草芽孢杆菌(Bacillussubtilis)和乳酸菌等,已经成为鱼类养殖中的重要添加剂[1,10]。
微生物在促进宿主鱼类营养物质消化吸收和调节鱼类免疫系统方面具有重要作用。冯雪[11]以草鱼(Ctenopharyngodonidellus)和银鲫(Carassiusauratusgibelio)为试验对象,发现其肠道内的气单胞菌属、弧菌属、芽孢杆菌属(Bacillus)、假单胞菌属细菌可分泌胞外消化酶,且分泌的胞外消化酶能够促进两种鱼对饵料的消化吸收。除分泌消化酶外,鱼类肠道菌群还可以合成多种维生素,例如:鲤鱼(Cyprinuscarpio)肠道内的细菌能合成维生素B12、维生素B1、生物素、泛酸等。摄食藻类的鱼消化道内存在木聚糖分解菌,摄食甲壳质的鱼类消化道内存在甲壳质分解菌[12]。Chen等[13]在对大口黑鲈(Micropterussalmoides)肠道微生物的研究中发现,饲喂添加148 mg·kg-1维生素C的饲料,能够提高大口黑鲈肠道微生物对维生素E的利用率,降低肠道内的脂质积累,从而保护其肠道内的多不饱和脂肪酸免受过氧化,促进大口黑鲈的生长发育。
来自水环境和饵料中的微生物随着鳃和口腔进入鱼体,并与鱼体发生适应性生理生化作用,最终定殖在鱼类肠道中形成优势菌群[14]。这些附着在鱼体表面或者定殖在肠道壁表面的优势微生物菌丛通过防止病原菌定殖和繁殖而起到物理屏障的作用[15]。Olsson等[16]通过试验发现,在大菱鲆(Scophthalmusmaximus)肠道中定殖的鳗弧菌(Vibrioanguillarum)对肉食杆菌属(Carnobacteriumsp.)菌株的生长起到了抑制作用。鱼类肠道中的微生物菌群还可与肠黏膜免疫系统相互协作,刺激免疫信号通道、相关受体蛋白、非特异性因子表达,从而清除宿主病原体。张燕玉等[17]用海藻希瓦菌(Shewandlaalgae)感染半滑舌鳎(Cynoglossussemilaevis)后发现,后者肠道中的微生物菌群多样性和菌群结构发生改变,且肠道组织中与免疫功能相关的基因HSPA1A和HINTI表达紊乱,说明肠道微生物菌群参与了机体的免疫应答和疾病发生过程。迟骋[18]从鲤鱼(Cyprinuscarpio)肠道中分离出360株细菌,并利用其中的优势菌株BA-1、BA-2和BA-3进行注射攻毒试验,结果显示,BA-1和BA-3可以使鲤鱼的先天免疫指标,以及免疫相关基因的相对表达量显著升高,并且注射过这2株优势菌株的鲤鱼,即使被病原菌——嗜水气单胞菌(Aeromonashydrophila)感染,其生存率也显著提高,说明这两株优势菌对鲤鱼的先天免疫应答产生了积极的影响。
马口鱼(Opsariichthysbidens)属于鱼丹亚科马口鱼属,在我国,除青藏高原、新疆和台湾等地外,南至海南岛、北至黑龙江的东部江河中均有分布,其中,在浙江省内各水系的中上游和大小支流中都有分布。马口鱼的繁殖力强,生长速度快,肉味鲜美,深受广大消费者喜爱。但由于近年来捕捞强度过大和生态环境改变,瓯江流域的野生马口鱼资源已十分稀缺[19]。马口鱼是一种重要的溪流性经济养殖物种,但是在本研究检索范围内,关于其肠道微生物的研究、利用情况尚未见报道。为促进马口鱼养殖业的健康发展,本研究拟从其消化道微生物组成、环境来源和微生物之间的相关性等角度进行分析,以明确马口鱼消化道重要微生物的菌属组成与获取途径,为生产中添加适于马口鱼的微生态制剂提供参考。
1 材料与方法
1.1 试验设计
本试验所用的马口鱼取自武义县心怡锦鲤家庭农场,养殖水温(28.7±0.5)℃,溶解氧11.38 mg·L-1,盐度0.34‰,pH值6.95±0.05。养殖桶的直径1.50 m,高1.30 m,水深0.90 m。每个养殖桶都配有一个独立的砂滤系统,并与之组成一个密闭的循环系统。砂滤管道直径0.67 m,高度1.80 m,管内装有特制滤砂,并保持砂体高度1.40 m。养殖过程中投喂商品饲料,每天投喂2次。在砂滤系统的底部泵入空气,使得砂子保持翻转,养殖桶中的水体经底部出水口进入砂滤系统,过滤后经进水口重新进入养殖桶。完整的养殖用水循环如图1所示。
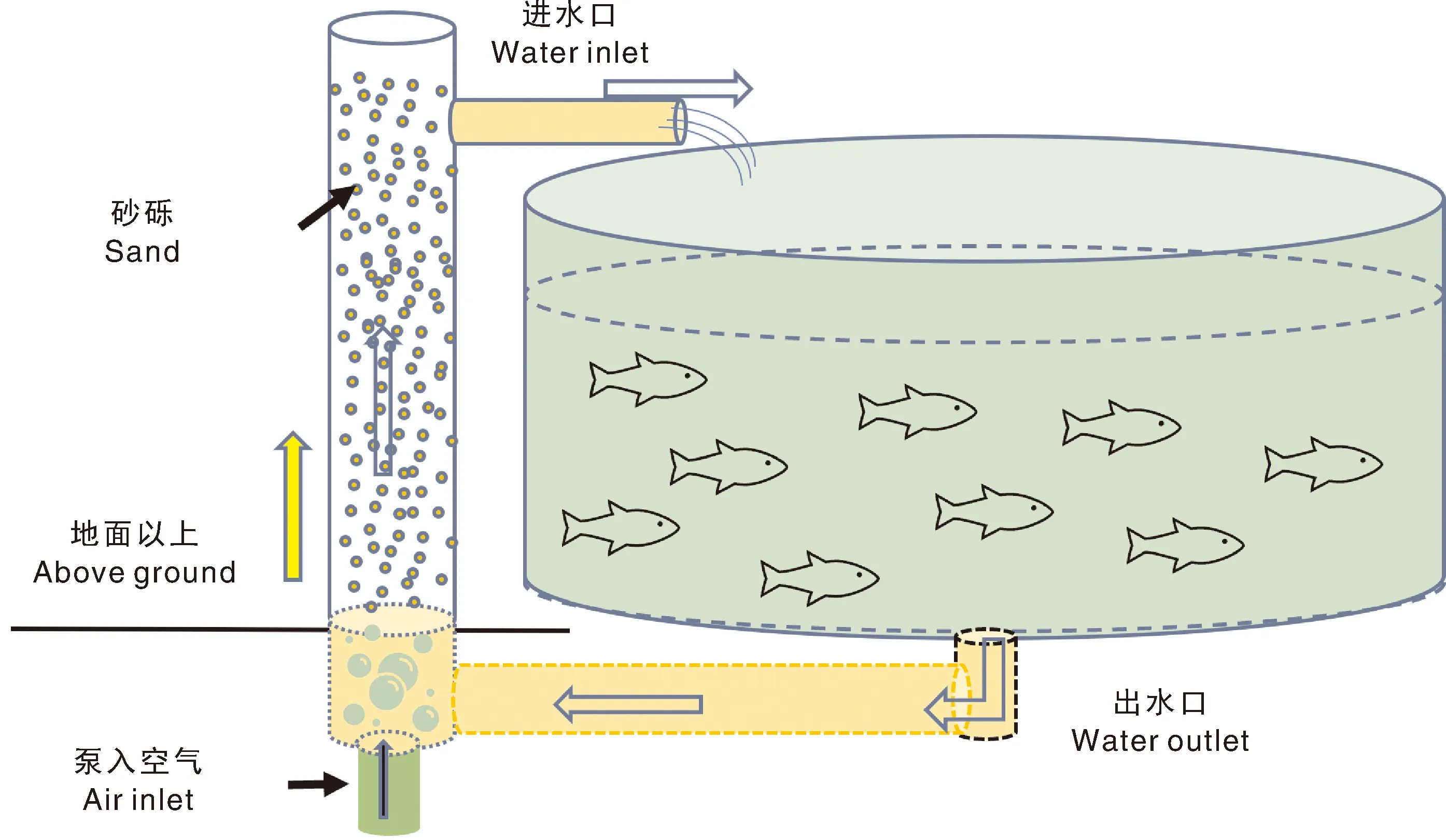
图1 养殖设施中的砂滤循环系统示意图Fig.1 Diagram of sand filtration circulation system in aquaculture facilities
1.2 取样
随机捞取9尾马口鱼(图2),经测量,其全长在9.0~11.6 cm。麻醉后,用无菌的解剖剪剖开其腹部,剪取包含胃部的完整消化道,经无菌的1×PBS缓冲液冲洗后,将每根消化道放入单独的冻存管中。同时,对滤砂和商品饲料进行取样,一并保存在液氮中。

图2 试验用马口鱼的照片Fig.2 Photo of O. bidens samples used in this experiment
1.3 消化道微生物分析
1.3.1 DNA提取
自液氮中取出冻存的消化道、滤砂和饲料样品,经1×PBS缓冲液冲洗后,用无菌剪刀将消化道剪成小段,并放置在2 mL离心管中,加入研磨珠,在JXFSTPRP-24L全自动样品快速研磨仪(上海净信实业发展有限公司)上研磨。用同样的方法研磨饲料。收集洗过砂子的PBS溶液。分别取30 mg经过研磨后的消化道样品、饲料样品和200 μL冲洗砂子的PBS溶液,各加入100 μL裂解液,后续按照MagPure Soil DNA LQ Kit试剂盒(广州美基生物科技有限公司)说明书上的步骤提取DNA。
1.3.2 PCR扩增与纯化
以提取的基因组DNA为模板进行第1轮PCR,首轮PCR产物经电泳检测和磁珠纯化(所用试剂盒为MagPure Soil DNA Kit,广州美基生物科技有限公司出品)后作为模板(模板量50 ng)进行第2轮PCR,产物经电泳检测和磁珠纯化后,使用Qubit法检测DNA的浓度。之后,根据PCR产物的质量浓度进行等量混样,用于测序。
第1轮PCR引物选用的是位于16S rRNA V3~V4区的特异引物343F(5’-TACGGRAGGCAGCAG-3’)和798R(5’-AGGGTATCTAATCCT-3’)[20],第2轮PCR引物选用的是Adapter I5(5’-TCGTCGGCAGCGTC-3’)和Adapter I7(5’-GTCTCGTGGGCTCGG-3’)。PCR反应体系均为30 μL,均包含2×Gflex PCR Buffer(缓冲液)15 μL、5 pmol·μL-1引物各1 μL、Tks Gflex DNA Polymerase(1.25 U·μL-1,日本Takara)0.6 μL和适量模板,不足部分用双蒸水补足。反应程序如下:94 ℃ 5 min;94 ℃ 30 s,56 ℃ 30 s, 72 ℃ 20 s,循环;72 ℃ 5 min。其中,第1、2轮PCR的循环数分别为26和7。
1.3.3 测序、建库与分析
将样品送上海欧易生物医学科技有限公司,于Illumina NovaSeq 6000系统平台上测序。使用Trimmomatic v0.40软件对测序获得的FASTQ格式的原始双端序列进行去杂,去除含有模糊碱基(ambiguous)、单碱基高重复区(homologous)的序列和长度过短的序列,去掉含有N碱基的序列,保留碱基质量分数Q20不低于75%的序列。测序数据经过预处理生成优质序列之后,采用VSEARCH v2.8.1软件将序列相似度≥97%的划为一个OTU(分类操作单元)[21]。使用QIIME v2020.11[22]软件包挑选出各个OTU的代表序列,并使用 RDP classifier v2.10.2软件将所有代表序列在SILVA数据库(version 132)中进行比对注释[23],保留置信区间大于0.7的注释结果。对获得的ITS(内部转录间隔区),在UNITE数据库中进行比对。使用BLAST[24]程序对OTU序列进行物种比对注释。采用斯皮尔曼相关系数(Spearman correlation coefficient)对消化道主要微生物菌属开展相关性分析,按照相关系数绝对值大于0.8,且差异显著(P值分别小于0.05、0.01、0.001)的标准进行统计。
2 结果与分析
2.1 细菌群落组成及其分布
马口鱼消化道中相对丰度较高的菌属(表1)主要有支原体属(Mycoplasma,77.50%)、鲸杆菌属(Cetobacterium,2.47%)、Muribaculaceae(1.97%)、普雷沃氏菌属(Prevotella,1.35%)、拟杆菌属(Bacteroides,1.10%)、奈瑟菌属(Neisseria,0.89%)、链球菌属(Streptococcus,0.64%)、乳杆菌属(Lactobacillus,0.46%)、拟普雷沃菌属(Alloprevotella,0.31%)、毛螺菌科NK4A136组(Lachnospiraceae_NK4A136_group,0.30%)、鞘氨醇单胞菌属(Sphingomonas,0.30%)、粪杆菌属(Faecalibacterium,0.29%)、埃希氏-志贺氏菌属(Escherichia-Shigella,0.24%)、嗜血杆菌属(Haemophilus,0.14%)、严格梭菌属(Clostridium_sensu_stricto_1,0.13%)和密螺旋体属(Treponema,0.13%)。除上述菌属外,梭杆菌属(Fusobacterium,0.08%)、硝化螺旋菌属(Nitrospira,0.07%)、劳特普雷氏菌属(Lautropia,0.07%)、Haliangium(0.04%)、放线菌属(Actinomyces,0.03%)、新鞘氨醇菌属(Novosphingobium,0.03%)、黄杆菌属(Flavobacterium,0.02%)、红杆菌属(Rhodobacter,0.01%)和SWB02(0.01%)也是马口鱼消化道中的常见菌属。
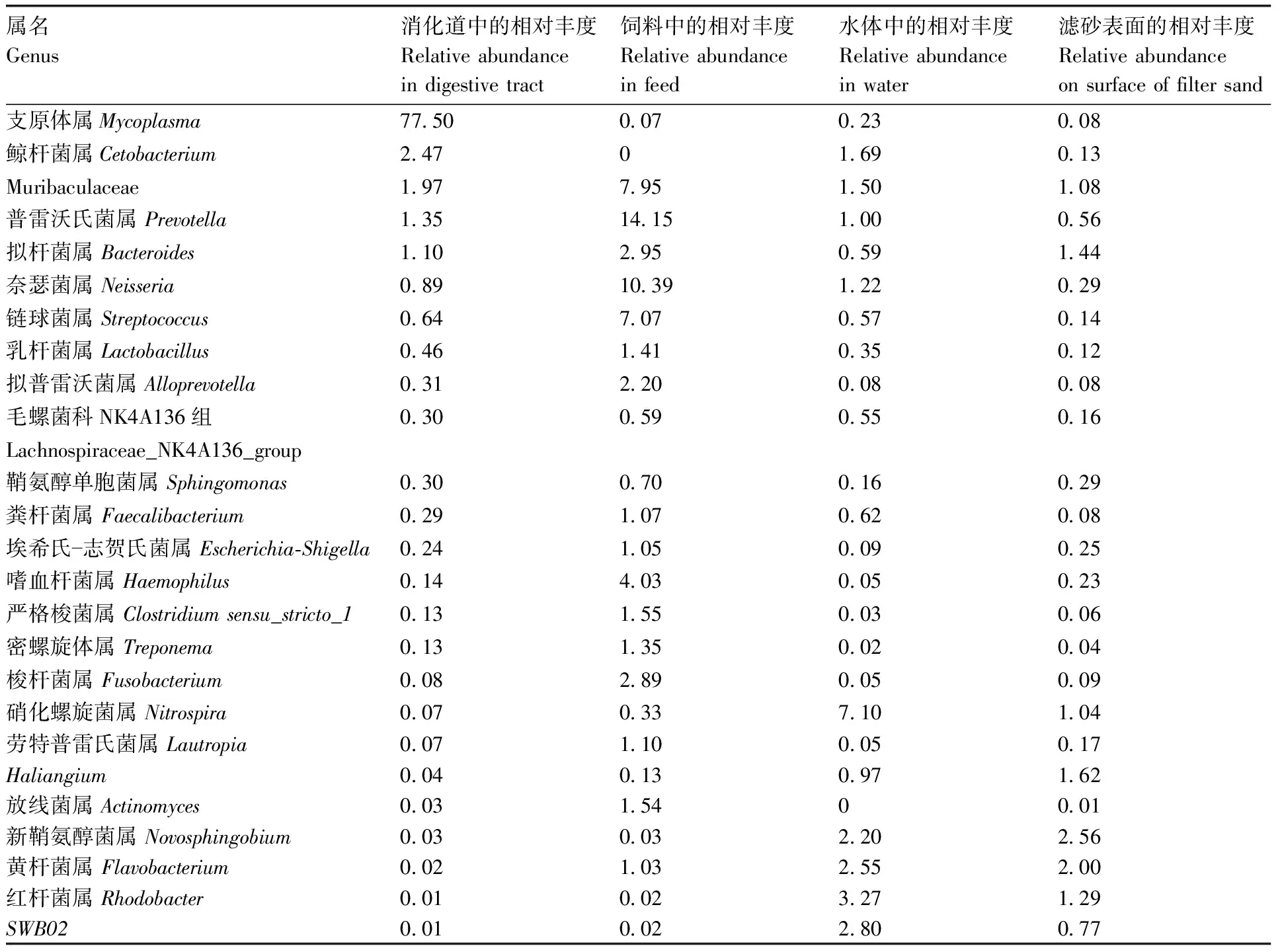
表1 马口鱼消化道中主要细菌的菌属及其在饲料、水体和滤砂表面的相对丰度
在环境分布上,上述菌属中的大多数在饲料中的相对丰度高于水体和滤砂表面,如Muribaculaceae、普雷沃氏菌属、拟杆菌属、奈瑟菌属、链球菌属、乳杆菌属、拟普雷沃菌属、毛螺菌科NK4A136组、鞘氨醇单胞菌属、粪杆菌属、埃希氏-志贺氏菌属、嗜血杆菌属、严格梭菌属、密螺旋体属、梭杆菌属等。硝化螺旋菌属、黄杆菌属、红杆菌属、SWB02、支原体属和鲸杆菌属在水体中的相对丰度要高于饲料和滤砂表面。Haliangium和新鞘氨醇菌属在滤砂表面的相对丰度最高。
对前述马口鱼消化道中的主要细菌在门、纲、目、科水平上的分布情况进行分析(图3、图4)。在门水平上,芽孢杆菌门(Bacillota)占79.32%,拟杆菌门(Bacteroidota)占4.75%,梭杆菌门(Fusobacteriota)占2.55%,变形菌门(Proteobacteria)占1.69%,螺旋体门(Spirochaetota)占0.13%,硝化螺菌门(Nitrospirota)占0.07%,黏球菌门(Myxococcota)占0.04%,放线菌门(Actinomycetota)占0.03%。其中,芽孢杆菌门主要包含梭菌纲(Clostridia)和芽孢杆菌纲(Bacilli)中的毛螺菌科(Lachnospiraceae)、梭菌科(Clostridaceae)、瘤胃菌科(Ruminococcaceae)、支原体科(Mycoplasmataceae)、链球菌科(Streptococcaceae)和乳杆菌科(Lactobacillaceae)。在纲水平上,芽孢杆菌纲在马口鱼消化道微生物中的相对丰度最高,为78.60%;在科水平上,以支原体科的相对丰度最高,为77.50%。
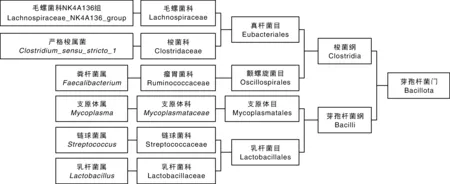
图3 马口鱼消化道主要细菌在门、纲、目、科分类水平上的分类Fig.3 Classificatin of dominant bacteria in the digestive tract of O.bidens at taxonomic category of phylum, class, order and family
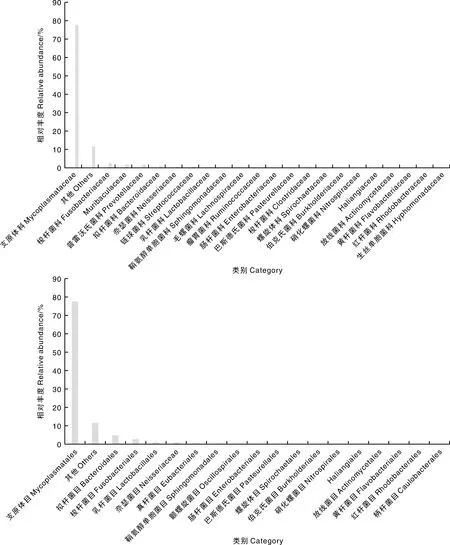
图4 马口鱼消化道主要细菌在门、纲、目、科水平上的相对丰度Fig.4 Relative abundance of dominant bacteria in the digestive tract of O.bidens at taxonomic category of phylum, class, order and family
拟杆菌门主要包括拟杆菌纲(Bacteroidia)的拟杆菌目(Bacteroidales)和黄杆菌纲(Flavobacteria)的黄杆菌目(Flavobacteriales),两个菌目的相对丰度分别为4.73%和0.02%。拟杆菌目主要包括Muribaculaceae、普雷沃氏菌科(Prevotellaceae)和拟杆菌科(Bacteroidaceae)共3个菌科,其相对丰度分别为1.97%、1.66%和1.10%。
变形菌门由阿尔法变形菌纲(Alphaproteobacteria)、贝塔变形菌纲(Betaproteobacteria)和伽马变形菌纲(Gammaproteobacteria)3个菌纲组成,包含鞘氨醇单胞菌目(Sphingomonadales)、红杆菌目(Rhodobacterales)、柄杆菌目(Caulobacterales)、奈瑟菌目(Neisseriaceae)、伯克氏菌目(Burkholderiales)、肠杆菌目(Enterobacteriales)、巴斯德氏菌目(Pasteurellales)7个菌目,是本研究中所含菌属最丰富的菌门。
2.2 细菌间的相关性分析
马口鱼消化道中的主要细菌菌属形成了两大关系网络(图5、图6)。其中一个是由17种菌属组成的密集的相关性网络(简称为密集网络),另一个由7种菌属组成的较为稀疏的关系网络(简称为稀疏网络)。
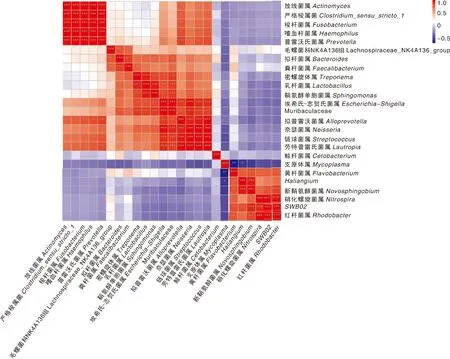
*表示P<0.05,**表示P<0.01,***表示P<0.001。* indicates P<0.05; ** indicates P<0.01; *** indicates P<0.001.图5 马口鱼消化道主要细菌菌属的相关性Fig.5 Correlations of dominant bacteria genus in the digestive tract of O.bidens
组成密集网络的菌属有Muribaculaceae、普雷沃氏菌属、拟杆菌属、奈瑟菌属、链球菌属、乳杆菌属、拟普雷沃菌属、毛螺菌科NK4A136组、鞘氨醇单胞菌属、粪杆菌属、埃希氏-志贺氏菌属、嗜血杆菌属、严格梭菌属、密螺旋体属、梭杆菌属、劳特普雷氏菌属和放线菌属。在上述17种菌属中,以Muribaculaceae为例,该菌属与拟杆菌属(P<0.01)、鞘氨醇单胞菌属(P<0.001)、密螺旋体属(P<0.001)、奈瑟菌属(P<0.001)、乳杆菌属(P<0.001)、链球菌属(P<0.001)、粪杆菌属(P<0.05)、埃希氏-志贺氏菌属(P<0.001)、拟普雷沃菌属(P<0.01)、劳特普雷氏菌属(P<0.001)共10种菌属的相对丰度正相关。与Muribaculaceae类似,普雷沃氏菌属与严格梭菌属(P<0.001)、放线菌属(P<0.001)、链球菌属(P<0.01)、奈瑟菌属(P<0.05)、劳特普雷氏菌属(P<0.01)、嗜血杆菌属(P<0.001)、梭杆菌属(P<0.001)、拟普雷沃菌属(P<0.001)、埃希氏-志贺氏菌属(P<0.05)共9种菌属的相对丰度正相关。同样地,分别有14种菌属与奈瑟菌属、劳特普雷氏菌属的相对丰度正相关(至少在P<0.05水平上显著,下同),有13种菌属与链球菌属的相对丰度正相关,有9种菌属与乳杆菌属的相对丰度正相关,有11种菌属与拟普雷沃氏菌属的相对丰度正相关,有8种菌属与严格梭菌属的相对丰度正相关,有10种菌属与鞘氨醇单胞菌属的相对丰度正相关。有2种菌属与毛螺菌科NK4A136组的相对丰度正相关,分别为粪杆菌属和拟杆菌属。
稀疏网络由黄杆菌属、新鞘氨醇菌属、Haliangium、红杆菌属、SWB02、硝化螺旋菌属和支原体属这7种菌属组成。有4~5种菌属与黄杆菌属、SWB02、新鞘氨醇菌属、Haliangium、硝化螺旋菌属、红杆菌属的相对丰度至少在P<0.05水平上显著正相关。支原体属分别与黄杆菌属和Haliangium属的相对丰度至少在P<0.05水平上表现为显著负相关,与其他菌属无显著相关性。
鲸杆菌属的相对丰度与其他菌属的相关性均未达到P<0.05的显著性水平。
3 讨论
一般来说,变形菌门、梭杆菌门、厚壁菌门和拟杆菌门构成鱼类的“肠道核心菌群”,但是各菌门在不同物种、不同阶段和不同生长环境中所占的比例不尽相同[19]。经过分析,我们发现,马口鱼消化道中的主要菌门有芽孢杆菌门(79.32%)、拟杆菌门(4.75%)、梭杆菌门(2.55%)、变形菌门(1.69%)等。其他淡水鱼,如匙吻鲟(Polyodonspathula),其肠道微生物中梭杆菌门占62%、变形菌门占16%、拟杆菌门占13%[8]。海水鱼类,如大菱鲆(Scophthalmusmaximus),其肠道中变形菌门、厚壁菌门和放线菌门的占比分别为82.0%、15.6%和2.4%[25]。此外,肠道中各菌门的丰度比重还与鱼体健康状况密切相关。魏娜[26]对健康和患病大黄鱼(Larimichthyscrocea)的肠道微生物进行分析,发现厚壁菌门、拟杆菌门和梭杆菌门是健康鱼的优势肠道菌群,而患病鱼中的优势肠道菌群则为厚壁菌门和梭杆菌门。马口鱼中上述各菌门与其健康状况的联系还需要进一步明确。
在本研究中,我们在马口鱼消化道中发现了数类益生菌或者潜在益生菌,如鲸杆菌属、乳杆菌属、埃希氏-志贺氏菌属、Muribaculaceae和链球菌属等,这些菌属在后续开发马口鱼专用肠道益生菌制剂方面具有重要意义。鲸杆菌属具有发酵多肽和碳水化合物的能力,可以代谢产生维生素B12,是大黄鱼肠道中一类重要的潜在的益生菌群[27-28]。但在马口鱼中,该菌属的相对丰度水平与其他菌属不具有相关性,我们推测该菌属在马口鱼消化道微环境中或许属于重要核心菌群,故而其在消化道中的定殖丰度不受其他微生物影响。Muribaculaceae属于拟杆菌门的拟杆菌目,在肠道的能量代谢等方面具有重要作用,是一种重要的有益菌。相关性分析发现,Muribaculaceae的相对丰度与拟杆菌属、鞘氨醇单胞菌属、密螺旋体属、奈瑟菌属、乳杆菌属、链球菌属、粪杆菌属、埃希氏-志贺氏菌属、拟普雷沃菌属、劳特普雷氏菌属共10种菌属呈显著正相关。在上述10种菌属中,包含多种益生菌属,如乳杆菌属、链球菌属、埃希氏-志贺氏菌属。同时,这3种菌属之间同样存在显著相关性。在高等脊椎动物中,单一益生菌的作用可能并不明显,但是当多种益生菌以一定的配比组合在一起,却能够显著提高宿主的健康状态[29]。马口鱼中多种益生菌之间的高度相关性网络从一定程度上印证了上述观点,为后续马口鱼肠道益生菌制剂开发中利用多菌协作来提高制剂效应提供了重要参考依据,但其具体作用机制目前还不清楚。
马口鱼消化道中还存在一个由黄杆菌属、新鞘氨醇菌属、Haliangium、红杆菌属、SWB02、硝化螺旋菌属和支原体属组成的特殊网络。此次取样的马口鱼肠道中支原体属的相对丰度(77.50%)远高于其他菌属,相关性分析结果显示,该菌属只与黄杆菌属和Haliangium的相对丰度呈显著负相关,与其他菌属无显著相关性,这说明黄杆菌属和Haliangium与支原体属可能存在竞争吸附的关系。支原体属不含有细胞壁,因基因组过小而使其不能靠自身完成许多代谢功能,故而营专性共生或寄生,广泛存在于植物和包括人类在内的动物中[30]。支原体属的许多成员是条件致病菌,虽然许多支原体属成员存在于宿主体内,但并未发现其对宿主的健康产生不良的影响[31]。如前人研究发现,支原体属在中等大小的大黄鱼(体重约304 g)和大菱鲆肠道中属于优势菌属[25-26]。支原体属的高丰度水平对鱼体健康的潜在影响还需要进一步研究。在该稀疏网络中同样存在益生菌。迟骋[18]在研究鲤鱼肠道中优势菌对其免疫性能的影响时发现,黄杆菌不论是其活的菌体还是胞外代谢产物均能显著提高鱼体对嗜水气单胞菌的抗病力,说明黄杆菌具有抗菌能力,在生产上是一种有效的益生菌。
本研究发现,饲料是马口鱼消化道微生物的主要来源,其次是养殖水体。另外,消化道和饲料中的微生物均能在滤砂表面检测到,尤其是嗜血杆菌属、Haliangium和新鞘氨醇菌属等在滤砂表面的相对丰度高于水体,说明该养殖系统中的滤砂对水体有一定的过滤作用,可基本满足该系统下马口鱼健康养殖的需要。
——马口窑文献与当代陶艺创作研究展

