大白菜苗期对Pantoea agglomerans抗性鉴定方法的建立与应用
李家玺,顾 冉,刘 焱,张耀伟
(东北农业大学 园艺园林学院,黑龙江 哈尔滨 150030)
软腐病是大白菜结球期的主要病害,在我国各大白菜产区都普遍流行,与病毒病和霜霉病并称为三大病害。大白菜软腐病病原通常被认为是胡萝卜果胶杆菌胡萝卜亚种Pectobacteriumcarotovorumsubsp.carotovorum[1](简称Pcc),果胶杆菌属P.aroidearum[2]、P.carotovorumsubsp.brasiliensis[1]、P.carotovorumsubsp.odoriferumhe[3]和P.polaris[4]等细菌也被鉴定为大白菜软腐病病原,此外,一种卵菌Pythiumultimumvar.ultimum[5]也可引起大白菜软腐病。2015年以来在哈尔滨市发现了一种新型大白菜软腐病,与Pcc引起的软腐病相比,短缩茎部位不易腐烂,叶球腐烂后易生侧芽,中肋腐烂部位呈深褐色,且没有明显的臭味,腐烂叶片中肋纤维分解较慢,经鉴定病原为成团泛菌(Pantoeaagglomerans)[6]。成团泛菌是革兰氏阴性菌,可以引起包括杨树枝干溃疡病[7]、冬枣叶枯病[8]、桃和李细菌性穿孔病[9]、火龙果细菌性腐烂病[10]和核桃细菌性黑斑病[11]在内的多种植物病害,但尚无报道对这些病害的抗性鉴定方法。
抗病育种是大白菜的重要育种目标之一,由Pcc引起的软腐病抗病育种工作已经进行了多年,很多抗病品种已经得到大规模推广和应用[12-14],而关于成团泛菌引起大白菜软腐病的抗性鉴定方法尚未见到报道,抗成团泛菌的大白菜种质资源还需鉴定。本试验设置了接种温度、湿度、苗龄、方法和菌液浓度共5个接种因素,以分离自哈尔滨市香坊区大白菜腐烂植株的成团泛菌为接种病原,对大白菜成团泛菌软腐病人工抗性鉴定方法和适宜发病条件进行研究,以期建立可在苗期快速鉴定大白菜种质资源对成团泛菌软腐病抗性的方法,为新品种选育提供支持。
1 材料与方法
1.1 试验材料
供试菌株成团泛菌分离自2018年采自黑龙江省哈尔滨市香坊区向阳乡的患软腐病大白菜植株(图1-a),由东北农业大学大白菜遗传育种研究室保存。用于确定最佳接种温度、湿度、苗龄和方法的供试大白菜品种为CR黄心(青岛明山农产种苗有限公司生产,田间表现为感病),用于确定最佳接种菌液浓度的供试大白菜品种为黄心冠军(辽宁裕田种业有限责任公司生产,田间表现为感病)、凯丰2号(哈尔滨刘元凯种业有限公司生产,田间表现为中抗)和珍亮(天津科润农业科技股份有限公司生产,田间表现为抗病)。用于抗性评价的大白菜种质共20份,包括CR金山(北京东汇盛种业科技有限公司生产)、CR凯旋(北京春奥种苗科技有限公司生产)、京春娃4号(京研益农种业科技有限公司生产)、黄娃60(北京络芙特科贸有限公司生产)、似锦(福州农播王种苗有限公司生产)和金奖(北京思贝奇种子有限公司生产)共6份杂交种和14份高代自交系(由东北农业大学园艺园林学院大白菜遗传育种研究室提供)。

a,成团泛菌引起的大白菜软腐病的田间发病症状。b~f,苗期病情分级示意图;b,0级;c,1级;d,3级;e,5级;f,7级。a, Symptom of soft rot caused by P. agglomerans on Chinese cabbage. b-f, Diagram of 0, 1, 3, 5 and 7 grade of disease seeding, respectively.图1 成团泛菌引起的大白菜软腐病田间发病症状与苗期病情分级示意图Fig.1 Symptom of soft rot caused by P. agglomerans on Chinese cabbage in filed and diagram of disease grades of seeding
1.2 试验方法
1.2.1 大白菜育苗
土壤经121 ℃、0.1 MPa灭菌后装于8 cm× 8 cm的营养钵中,每钵播种供试大白菜品种种子3粒,并置于温室中,昼/夜温度为25~28 ℃/15~18 ℃。十字期每钵留1株壮苗,待幼苗生长至相应苗龄时进行接种试验。
1.2.2 接种菌液的制备
取保存于-80 ℃冰箱的菌液,涂布于牛肉膏蛋白胨固体培养基上活化,12 h后用无菌涂布棒刮取数个单菌落于无菌水中用于接种,接种前使用平板计数法调整菌液浓度至1×108、1×1010、1×1012CFU·mL-1。
1.2.3 最佳接种温度的确定
由于该病害多在每年6月下旬至8月中旬流行,故本试验设计接种温度为15~20 ℃、20~25 ℃和25~30 ℃,共3个水平。每株均选取第2片真叶,在中肋基部接种,每处理接种20株,每处理3次重复,对照组同处理组。除温度外,其他条件设置情况为:空气相对湿度90%,苗龄7~8叶期,接种方式为用刀片轻划“品”字形小伤口,并滴30 μL 1×1010CFU·mL-1的菌液,对照组滴等量的无菌水。接种后放置于光照培养箱中,接种后第7天调查发病情况并统计发病等级。
1.2.4 最佳接种苗龄、湿度和方法的确定
确定发病适宜温度后,分析湿度、苗龄和接种方法对苗期接种发病的影响,试验各因素和水平见表1,具体实施方案见表2。试验接种温度为25~30 ℃,菌液浓度为1×1010CFU·mL-1,每株接种30 μL菌液。接种后放于光照培养箱中,接种后第7天调查发病情况并统计发病等级。
1.2.5 最佳接种菌液浓度的确定
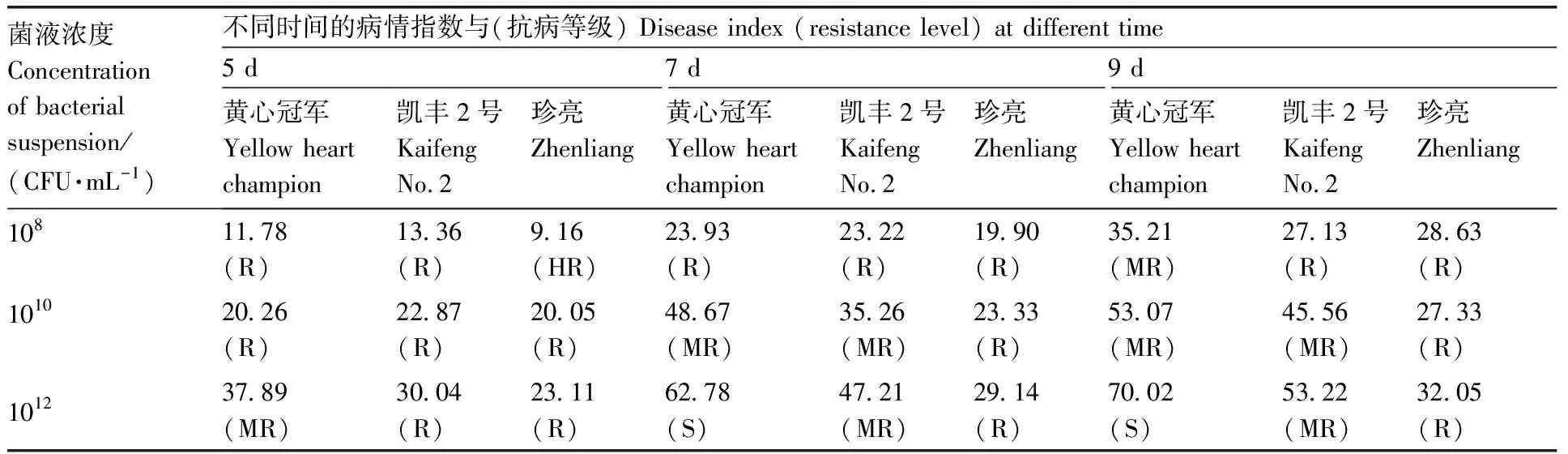
为确定合理的接种浓度,配置浓度为1×108、1×1010、1×1012CFU·mL-1的菌液,在上述最佳接种温度、湿度、苗龄和方法条件下,将菌液接种于3个田间不同抗性的大白菜品种黄心冠军、凯丰2号和珍亮上,接种方法同1.2.3节,接种后第5、7和9天分别调查病情指数。
1.2.6 病情分级与发病情况调查
以腐烂部位延叶柄延伸长度进行等级划分,单株发病情况分为0级、1级、3级、5级、7级(图1 b-f)。具体分级为:0级,接种部位不腐烂;1级,出现腐烂且长度<1 cm;3级,1 cm≤腐烂长度<2 cm;5级,2 cm≤腐烂长度<3 cm;7级,腐烂长度≥3 cm。
H=∑(v×n)×100/(N×vmax)。
(1)
式(1)中:H代表病情指数;v代表发病级代表值;n代表各级病株数;N代表调查总株数;vmax代表最高级发病值。
群体分级标准:免疫(I),H=0;高抗(HR),0 R=n1/N。 (2) 式(2)中:R代表发病率;n1代表发病植株;N代表总株数。 1.2.7 种质抗性评价 20份大白菜种质育苗方法同1.2.1节,按确定的最佳接种温度、苗龄、湿度、方法和菌液浓度进行接种,病情分级和发病情况调查方法同1.2.6节。 每个处理的病情指数为3次重复的平均值,病情指数进行平方根转换后,使用SAS软件(v9.4)进行差异显著性分析和方差分析。 不同接种温度下大白菜软腐病苗期病情指数分析结果表明,3个接种温度下病情指数差异极显著,接种温度为25~30 ℃时病情指数最大,为51.87,表明25~30 ℃利于大白菜软腐病发病。 由表2可知,9个处理组合间发病程度差异较大,发病率变化幅度为9.33%~91.00%,病情指数变化幅度为8.56~50.67。其中接种苗龄7~8叶期、湿度90%~100%和用刀片轻划“品”字形小伤口的组合大白菜发病率和病情指数均最高。 病情指数极差分析结果(表3)表明,接种苗龄的病情指数极差最大,其次为接种方法,接种湿度的病情指数极差最小,表明接种苗龄对大白菜软腐病苗期发病情况影响最大,接种方法次之,接种湿度的影响最小。 表3 极差分析结果 病情指数方差分析结果如表4所示,A和C因素的F值均大于F0.01,均达到极显著水平;B因素的F值小于F0.01但大于F0.05,达到显著水平;说明正交试验中苗龄和接种方法对大白菜成团泛菌软腐病苗期发病情况影响都较大,湿度对发病情况影响相对较小,但也是影响发病的重要因素。方差分析结果与极差分析结果基本一致。 表4 L9(34)正交试验病情指数方差分析结果 由表5可知,用1×1012CFU·mL-1菌液接种后的第7天和第9天,3个大白菜品种分别表现为感病、中抗和抗病,可以体现出不同品种的抗感差异;用1×108、1×1010CFU·mL-1菌液接种后第5天、第7天和第9天,均不能体现3个品种间的群体抗感差异。所以1×1012CFU·mL-1为最适宜的菌液接种浓度。第9天时不同抗性品种间病情指数差异较大,故选择接种后第9天调查最佳。 表5 最佳接种浓度的确定 根据病情指数计算公式和抗性评价标准,对20份大白菜种质进行抗性评价,结果表明,免疫和高感种质数量为0;高抗种质2份,占比10%,分别为似锦、A52-1;抗病种质4份,占比20%,分别为CR金山、A94-1、A239-1-1、C62-1-1;中抗种质8份,占比40%,分别为CR凯旋、金奖、A245、C20-121-211、C25-111-121、C70-1-1-1、C80-1、C80-2;感病种质6份,占比30%,分别为黄娃60、京春娃4号、A129、C30、C71-1、C79-2。 在蔬菜抗病育种工作中,明确流行病害的病原后,应及时建立抗性鉴定方法,以便明确现有种质资源的抗感程度。成团泛菌导致的软腐病发现较晚,但近些年逐渐呈现流行趋势,给农户带来较大损失,在2019年被鉴定为大白菜软腐病的新病原后,应尽快开展抗病育种工作。前人在对绿豆[15]、大白菜[16]和甘蓝[17]等作物的抗性鉴定方法研究中发现,温度是影响这些作物接种发病情况的最主要因素。成团泛菌的最适生长温度为30 ℃[6],田间调查时发现发病季节温度约为20~30 ℃。本试验结果表明,成团泛菌最佳接种温度为25~30 ℃,与该病害大规模发生和流行时的温度相符合[6]。 在接种苗龄方面,史国立等[18]建立大白菜对Pcc引起的软腐病抗性鉴定方法时,确定7~8叶期为最佳接种苗龄;田宇等[19]建立生菜细菌性软腐病抗性鉴定方法时也认为7~8叶期为最佳接种苗龄。本试验结果也显示,7~8叶期发病较快,能准确反映品种的真实抗病性,与前人研究结果基本一致。在苗龄相对较小的植株上不易发病,可能是因为其叶片中肋的细胞壁纤维素含量较高[20]。 田间调查发现,该病在高湿度环境下易发生,一般在大雨过后出现流行趋势。本试验利用光照培养箱控制湿度,结果表明,相对湿度90%~100%最适宜发病,可能是因为湿度大时伤口不易形成愈伤组织且木栓化慢,利于细菌侵染。 本试验设计的3个接种方法借鉴了Pcc引起的大白菜软腐病的接种方法。史国立等[18]研究发现,与常规滴接等方法相比,轻微刺伤后接种发病效果较好,但用针刺时伤口较小,不利于细菌的侵染。成团泛菌引起的软腐病发病部位主要在叶片中肋,本试验发现用刀片轻划“品”字形伤口发病情况最好,与史国立等[18]的结果一致。刺伤时注意刀尖刚刺入表皮即可,此时伤口大小适中,利于细菌侵染且不易木栓化,然后将菌液滴在伤口处形成悬滴,完成接种。另外,本试验选择第2片真叶中肋接种,可以有效避免在湿度大时外叶脱落而影响试验结果,同时可以更明显地观察发病情况。 接种菌液浓度是抗性鉴定方法中的重要因素。马燕勤等[21]研究表明,用6.4×108CFU·mL-1的Pcc菌液对甘蓝进行离体接种时发病最快。本试验采用活体接种,发现1×1012CFU·mL-1成团泛菌悬浮液最适宜接种。浓度低时发病情况不佳,可能是因为活体植株代谢旺盛,很难在短时间内侵染并使植株发病,适当提高浓度可以使植株快速呈现明显病症。如果浓度过高全部植株均表现出严重病症,无法区分种质资源抗病性。 依照本研究建立的抗性鉴定方法对现有种质进行抗性评价,既可以验证鉴定方法的合理性,也可以明确现有种质的抗病情况。抗性评价结果显示,6份杂交种和14份高代自交系种质的抗性等级和抗性表现与田间观察结果基本一致。自交系中鉴定出的1份高抗种质和3份抗病种质有较大的潜力可作为亲本用于选育抗病品种。本试验对大白菜成团泛菌软腐病抗性鉴定方法进行初次探讨,希望能为我国大白菜抗成团泛菌软腐病种质资源筛选和抗病育种提供借鉴。1.3 数据处理
2 结果与分析
2.1 接种温度对大白菜软腐病发病的影响
2.2 接种苗龄、湿度和接种方法对大白菜软腐病发病的影响
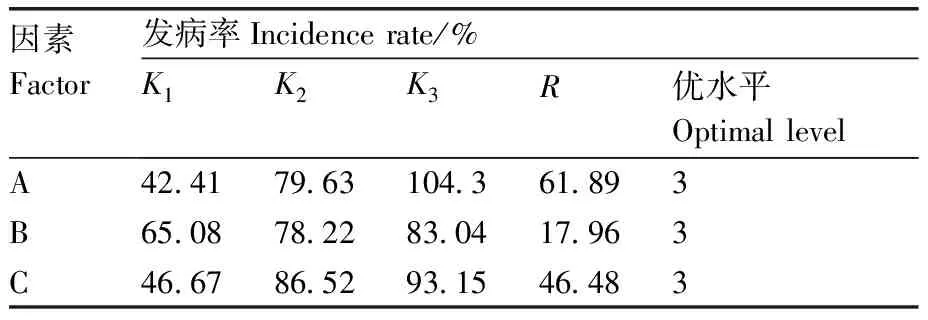

2.3 接种菌液浓度对软腐病发病的影响
2.4 种质抗性评价
3 结论与讨论

