电位滴定法测定氯代碳酸乙烯酯中的总氯
唐晓婵,刘友彬,王 艳,岳 涛
(青岛科技大学山东化工研究院,山东 济南 250014)
氯代碳酸乙烯酯(CEC)通常为无色或浅黄色液体,是合成碳酸乙烯酯、氟代碳酸乙烯酯的关键原料之一[1-2];现有工艺以碳酸乙烯酯为原料,采用磺酰氯或氯气法进行氯化制得,产品中常含有氯化氢、二氯代产物、三氯代产物或其他含氯化合物,较难分离、纯化,导致产品质量不高[3-4]。有机氯的检测常采用气相色谱法[5],因CEC中的氯化氢在气相色谱氢火焰离子化检测器(FID)上无响应,同时,高沸点多氯代产物在气相色谱仪中不能完全气化,且较难购买到多氯代化合物的标准品,难以建立气相色谱分析方法以测定每种含氯化合物的量。合成碳酸亚乙烯酯或氟代碳酸乙烯酯工艺中常使用三乙胺、哌嗪等缚酸剂[6-7],活性更高的氯化物可能优先与缚酸剂反应,生成三乙胺盐酸盐或哌嗪盐酸盐,消耗一部分缚酸剂,需要通过测定CEC原料中总氯化物(总氯)的含量,以保证足够的投料量;此外,总氯含量的波动也能反应生产工艺的稳定性。建立准确、快速的总氯含量测定方法,对CEC的产品质量控制和下游产品的生产有重要意义。
考虑将含氯化合物全部转化成氯离子,以氯离子的总量表示总氯的含量。文献报导的氯离子含量测定方法主要有离子色谱法[8]、分光光度法[9]和容量法[10-13]等。CEC中总氯含量较高,适合采用容量法测定。CEC在水中可缓慢分解,生成氯离子。由于CEC水解速率较慢,直接滴定氯离子时,滴定终点易反复,测定结果精密度较差。
本文作者用氢氧化钾将CEC中的有机氯全部碱解成游离氯化物,用硝酸银滴定总氯的含量。CEC碱解后,溶液呈红棕色,采用目视-指示剂法时,终点颜色变化不易观察;而采用电位滴定法,可准确判断滴定终点,有望提高方法的准确度和精密度,为监控CEC反应进程和产品质量控制提供依据。
1 实验
1.1 仪器与试剂
实验仪器:PHS-3E酸度计(上海产)、216型银电极(指示电极,上海产)、217型双盐桥饱和甘汞电极(参比电极,上海产)、SQP电子天平(德国产,精度0.000 1 g)、930离子色谱仪(瑞士产)、Metrosep A Supp 4-250/4.0阴离子色谱柱(瑞士产)及Metrosep A Supp 4 Guard/4.0保护柱(瑞士产)。
实验试剂:硝酸银(上海产,GR)、氯化钠(天津产,基准试剂)、甲基红(上海产,AR)、氢氧化钾(上海产,AR)、硝酸(天津产,AR)、淀粉(天津产,AR)、四甲基氢氧化铵(上海产,AR)、氢氧化钠(天津产,AR)、乙醇(上海产,95%)、碳酸钠(上海产,AR)、碳酸氢钠(上海产,AR)及CEC(威海产,工业级,约80%)。
氯离子储备溶液:1 000 mg/ml。
氯离子标准溶液:使用移液管分别移取2 ml、5 ml、8 ml、10 ml、12 ml、15 ml氯离子储备溶液至6个100 ml的容量瓶中,用高纯水稀释并定容,配制成氯离子浓度为20 mg/ml、50 mg/ml、80 mg/ml、100 mg/ml、120 mg/ml和150 mg/ml的标准溶液。
1.2 实验方法
硝酸银标准溶液的配制及标定:称取17.5 g硝酸银,溶于1 000 ml水中,摇匀,配制0.1 mol/L硝酸银标准溶液,贮存于密闭棕色瓶中。称取0.22 g于500~600 ℃的高温炉中灼烧至恒量的氯化钠,溶于70 ml水中,加入10 ml淀粉溶液(10 g/L),以银电极为指示电极,双盐桥饱和甘汞电极为参比电极,用配制的硝酸银溶液滴定。按GB/T 9725—2007《化学试剂 电位滴定法通则》[14]进行测定,记录消耗的硝酸银标准溶液的体积V0,硝酸银标准滴定溶液的浓度c按式(1)计算。
式(1)中:m1为氯化钠质量;M1为氯化钠的摩尔质量。
样品测定方法:称取约1.3 g CEC样品(约1 ml),置于250 ml容量瓶中,加入10 ml乙醇、20 ml氢氧化钾溶液(200 g/L),置于沸水浴中5 min,水浴冷却至室温,再加水稀释至刻度,摇匀。精密移取30.00 ml上述溶液,置于250 ml烧杯中,加入50 ml水、2滴甲基红指示液(1 g/L),用硝酸溶液(1+1,V/V)调至红色,再加入2 ml硝酸溶液、10 ml淀粉溶液,用0.1 mol/L硝酸银溶液滴定,待电位变化较大时,用0.1 ml等间隔滴定并记录电位值,用二级微商法确定滴定终点。
总氯的质量分数w(以Cl计)按式(2)计算。
式(2)中:V为滴定总氯消耗的硝酸银标准溶液的体积;M2为氯的摩尔质量;m2为样品的质量。
考察不同因素对测试结果的影响。
①碱解试剂:按照上述测定方法,将CEC样品分别用四甲基氢氧化铵溶液(200 g/L)、氢氧化钠溶液(200 g/L)和氢氧化钾溶液在沸水浴中加热5 min,水浴冷却至室温后,测定总氯含量,考察不同碱解试剂在相同时间下的碱解效果。
②乙醇加入量:按照上述测定方法,分别加入5 ml、10 ml、15 ml、20 ml、25 ml乙醇,促进样品和水的互溶,考察溶液澄清度,以及碱解后氯化钾是否析出导致溶液变浑浊。
③氢氧化钾浓度:按照上述测定方法,分别加入20 ml浓度为50 g/L、100 g/L、150 g/L、200 g/L和250 g/L的氢氧化钾溶液,考察不同浓度氢氧化钾的碱解效果。
④氢氧化钾加入量:按照上述测定方法,分别加入5 ml、10 ml、15 ml、20 ml、25 ml和30 ml氢氧化钾溶液,测定总氯含量,考察氢氧化钾加入量对碱解效果的影响。
⑤加热时间:按照上述测定方法,加入20 ml氢氧化钾溶液,分别考察沸水浴加热2 min、3 min、5 min、8 min和10 min时,是否碱解完全。
⑥淀粉溶液加入量:按照上述测定方法,分别加入5 ml、10 ml、15 ml和20 ml淀粉溶液,考察对结果的影响。
样品测定:取4批次CEC样品,按照上述测定方法,每个样品测定6次,计算结果平均值和相对标准偏差(RSD)。
准确度实验(加标回收率实验):称取9份CEC样品(测得含量为30.53%)约0.65 g,分别加入0.15 g、0.33 g与0.50 g氯化钠基准试剂,制成含低、中、高3个浓度水平的加标试样。按照样品测定方法,每个浓度的试样平行测定3次,计算回收率及RSD。
离子色谱法测定样品中的总氯:称取约1.3 g CEC样品,置于250 ml容量瓶中,加入20 ml氢氧化钾溶液,于沸水中加热至样品完全溶解,冷却至室温,加水稀释至刻度,摇匀;精密量取5.00 ml上述溶液移入100 ml容量瓶,用水稀释至刻度,摇匀。设置色谱柱温30 ℃,进样体积10 μl,洗脱液流量1.0 ml/min,用1.8 mmol/L碳酸钠溶液和1.7 mmol/L碳酸氢钠溶液作为淋洗液进行洗脱。
2 结果与讨论
2.1 样品前处理
2.1.1 碱解试剂
CEC在水相中分散较差且会缓慢分解生成氯离子,直接滴定时,可能未达到实际终点即显示滴定完成,因此,实验考察用不同种类的碱将CEC水解成游离氯离子,再用硝酸银标准溶液滴定氯离子的方法。用氢氧化钾、四甲基氢氧化铵和氢氧化钠溶液在沸水浴中碱解5 min后,测定总氯的质量分数,结果分别为30.66%、29.80%和29.50%。由于氢氧化钾的碱性大于四甲基氢氧化铵和氢氧化钠,在相同条件下,氢氧化钾的碱解速率优于四甲基氢氧化铵和氢氧化钠。实验选择使用氢氧化钾作为碱解试剂。
2.1.2 分散剂的加入量
由于CEC与水不互溶且密度比水大,会团聚于瓶底,碱解时逐渐变成白色油滴,需要较长时间加热才能完全消失,可能导致碱解不完全。实验加入乙醇,促进CEC与水的互溶,以加快碱解速度。乙醇加入量小于5 ml时,CEC与水尚未完全互溶,溶液浑浊;乙醇加入量过大,超过溶液总体积50%时,碱解产物氯化钾从溶液中析出,溶液亦呈浑浊状态;乙醇加入量为10~15 ml时,溶液澄清,滴定结果精密度较好。综合考虑,选择10 ml乙醇作为碱解时的分散剂。
2.1.3 氢氧化钾浓度、加入量和加热时间
CEC与氢氧化钾反应生成氯化钾、碳酸钾和乙醛醇,乙醛醇在强碱条件下可能发生自聚反应,导致碱解消耗的氢氧化钾的量比理论值多;由于乙醛醇的自聚反应,会加深样品溶液的颜色。
实验考察氢氧化钾浓度、加入量和加热时间对总氯含量的影响,结果见图1。

图1 氢氧化钾溶液浓度、体积及加热时间对总氯含量的影响Fig.1 Effects of KOH concentration,volume and heating time on the content of total chloride
从图1(a)可知,碱解程度随着氢氧化钾浓度的增加而提高,当氢氧化钾溶液浓度大于150 g/L时,总氯的质量分数维持恒定,碱解完全。综合考虑,选择200 g/L氢氧化钾溶液作为碱解液浓度。
从图1(b)可知,当氢氧化钾溶液的体积小于15 ml时,碱解不完全;体积为15~25 ml时,效果相当。为保证样品能够完全碱解,选择加入20 ml氢氧化钾溶液。
从图1(c)可知,当加热时间短于3 min时,总氯的质量分数偏低;当加热时间长于3 min时,碱解完全。综合考虑,选择加热时间为5 min。
2.1.4 淀粉的加入量
为防止氯化银沉淀包裹银离子电极,降低电极的敏感度,同时促使氯化银的沉降,沉淀滴定时常加入可溶性淀粉。实验分别加入5 ml、10 ml、15 ml和20 ml淀粉溶液,测得总氯的质量分数分别为30.49%、30.61%、30.59%和30.56%,说明淀粉溶液的加入量对测定结果无明显影响。综合考虑,选择加入10 ml淀粉溶液。
2.2 样品测定
称取1.3 g样品(约1 ml),按样品测定方法进行测定,平行测定6次,结果见表1。
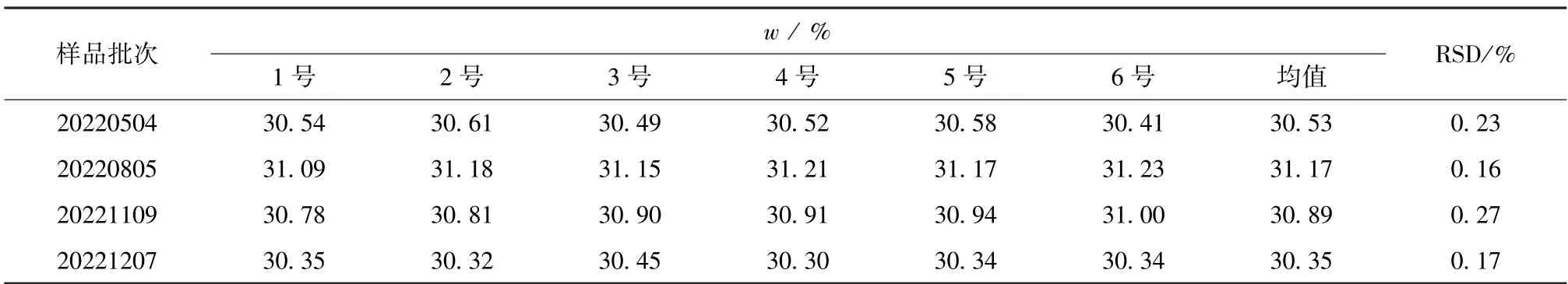
表1 样品测定结果(n=6)Table 1 Sample test results (n=6)
从表1可知,重复6次测定4批次样品中的总氯,RSD均小于0.5%,表明方法的精密度良好。
2.3 准确度实验
加标回收率结果和测定值的RSD见表2。
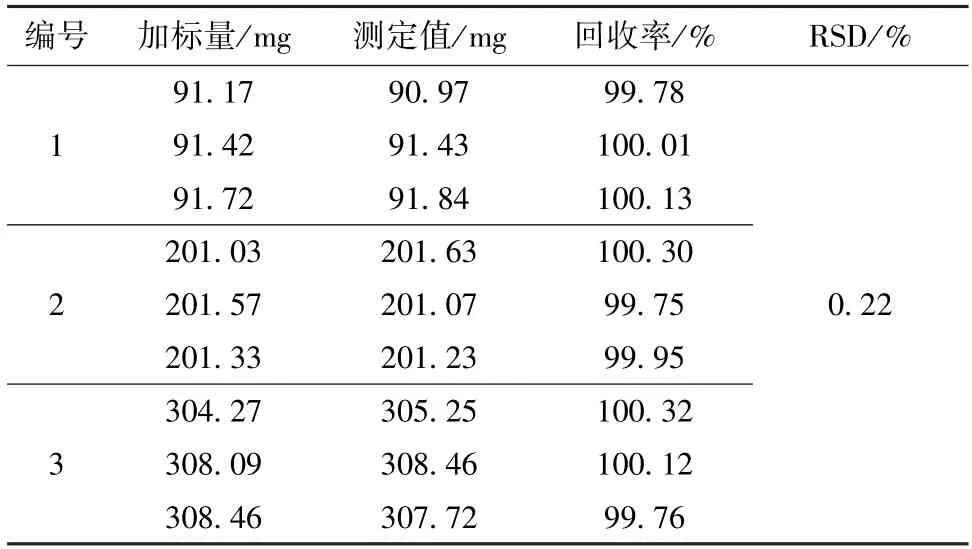
表2 加标回收实验结果(n=9)Table 2 Results of experiment for recovery (n=9)
从表2可知,样品的加标回收率为99.75%~100.32%,9次测定结果的RSD小于0.5%,方法的准确度可满足分析检测的要求。
2.4 测试方法对比
称取1.3 g样品,按照电位滴定法和离子色谱法测定样品中总氯,每个样品平行测定6次,总氯的质量分数及6次测定结果的RSD见表3。
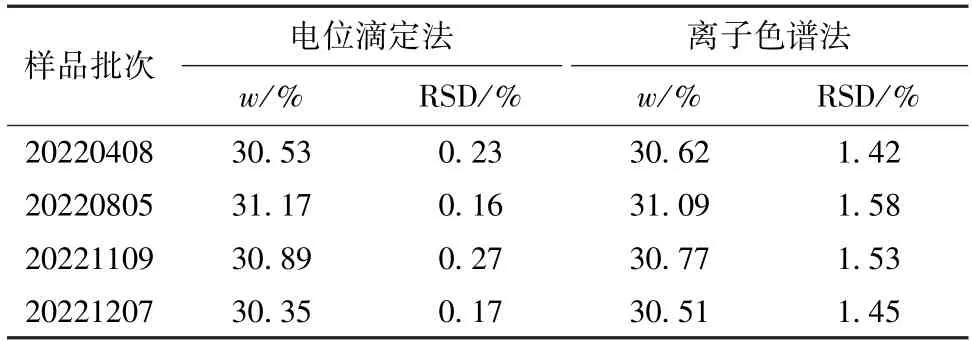
表3 两种方法对比结果Table 3 Comparison results of two methods
从表3可知,电位滴定法和离子色谱法测定CEC中总氯的含量结果基本一致。离子色谱法的进样浓度较低、进样量较小,样品需进一步稀释,可能会引入更大的误差,导致精密度低于电位滴定法,因此,采用电位滴定法测定更合适。
3 结论
本文作者通过碱解试剂种类、乙醇加入量、氢氧化钾浓度、氢氧化钾加入量、加热时间和淀粉溶液加入量等前处理条件,建立了电位滴定法测定CEC中总氯的含量。
实验结果表明,电位滴定法的加标回收率为99.75%~100.32%,RSD小于0.5%,测定结果准确度与离子色谱法基本一致,精密度优于离子色谱法。电位滴定法可减小直接滴定-目视判断终点引入的误差,满足测定要求,适用于CEC生产工艺的中控分析以及产品的质量控制,有助于产品的下游应用。

