低强度脉冲超声作用于膝骨关节炎炎症相关信号通路的研究进展
欧阳辉,林星瑾,王金英,沈龙彬,王成栋
1 暨南大学附属第一医院,广东 广州 510630;
2 暨南大学,广东 广州 510620
膝骨关节炎(knee osteoarthritis,KOA)是一种由多因素引起的以软骨侵蚀、滑膜炎症、软骨下骨增厚及骨赘形成为病理改变,涉及关节及关节周围组织结构病变的全关节疾病。危险因素包括年龄、性别、肥胖、创伤和代谢等[1-3]。KOA 在我国的致残率约为53%,是第三大致残疾病[4]。其发病主要涉及关节软骨的合成和分解代谢的失衡,细胞因子的启动与其密切相关。研究显示,骨关节炎病理改变涉及软骨细胞、破骨细胞、成骨细胞、滑膜中的成纤维细胞和单核细胞等多种细胞类型[5]。关节软骨损伤后白细胞介素-1β(interleukin-1β,IL-1β)、IL-6 和肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)高表达,其中IL-1β 和TNF-α 是促进炎症发展及诱导软骨下骨破坏的关键细胞因子,其出现于KOA 的多条致病信号通路中,调控KOA 的细胞内活动,在软骨细胞破坏、细胞外基质减少、软骨重塑异常、软骨下骨化和滑膜炎症等病理过程中扮演重要的角色[5-6]。目前临床不断寻求药物或非药物治疗方法来调控软骨代谢或阻断促炎因子的表达,以期促进软骨修复或抑制软骨破坏[7-8]。国内外指南均提倡针对KOA 以非药物治疗为首选,包括患者教育、运动治疗及物理治疗等[9-10]。超声治疗作为一种无创安全的物理治疗手段,在KOA 的治疗上已经有60多年的历史[11],研究较多且疗效较好的强度为0.02~1 W/cm²、频率为1~3 MHz 的低强度脉冲超声(low-intensity pulsed ultrasound,LIPUS)。LIPUS 作用于KOA 具有减轻关节炎症、缓解疼痛、促进软骨再生和保护软骨的作用[12-13]。通过对LIPUS 作用于KOA 炎症相关信号通路的研究进展进行综述,可以为LIPUS的临床应用寻找最佳干预方案。
1 LIPUS的作用机制
LIPUS 是一种机械波,其声能可通过介质传播到组织间和细胞内,在组织细胞内产生微气泡和微射流,引起分子间的振动和碰撞,产生非热效应和热效应,从而使组织细胞产生一系列生物效应。其中非热效应主要包括空化效应、声流和机械刺激等[14]。而关节组织对机械刺激非常敏感,适度的机械刺激可调节关节的稳态,维持软骨的正常代谢[15]。既往研究发现,LIPUS 通过非热效应在治疗骨折和骨不连等方面具有良好的疗效[16-17],另外LIPUS在控制炎症和促进软组织修复等方面也具有良好作用[18-19]。与其他强度的治疗性超声相比,LIPUS 具有最小的热效应,且能将声能定向传递到靶组织中,在生物信号传递上具有优越性[14]。利用LIPUS这一特性,可以调控膝骨关节中细胞的信号通路,改变细胞的理化性质,促进细胞新陈代谢,控制膝骨关节的炎症。
2 LIPUS对膝骨关节炎作用的信号通路研究
近年来LIPUS 已广泛应用于KOA 的临床治疗,LIPUS 与药物或其他治疗方法联合应用对KOA 的疼痛、膝关节功能改善、炎症控制和关节软骨修复等方面具有明显的治疗优势。高明霞等[20]应用LIPUS 联合药物干预KOA 患者6 周后,与单独应用药物组对比,在视觉模拟评分(visual analogue scale,VAS)、西安大略和麦克马斯特大学骨关节炎指数(Western Ontario and McMaster Universities Osteoarthritis Index,WOMAC)及Lysholm 膝关节评分(Lysholm knee score scale,LKSS)方面改善更明显,且差异有统计学意义(P<0.05)。亦有针对KOA 患者的临床研究将口服药物与LIPUS 联合使用,相较单独口服双氯芬酸钠组患者血清组织金属蛋白酶抑制因子-2(tissue inhibitor of metalloproteinases-2,TIMP-2)的生成增加而关节软骨基质金属蛋白酶-13(matrix metalloproteinase-13,MMP-13)的表达减少更显著,显示LIPUS 对软骨修复有积极作用[21]。除了运用量表与血清学检测作为评估疗效的手段外,通过影像学MRI 检测,也能观察到超声联合药物对关节软骨的修复作用,从不同角度揭示了药物联合超声治疗KOA 的机制[22]。此外,非药物联合治疗的临床应用也逐渐兴起,如王广等[23]运用本体感觉联合LIPUS 与单纯本体感觉训练治疗KOA 患者12周,通过比较其VAS、WOMAC 及跌倒效能量表评分(modified fall efficacy scale,MFES),结果显示前者改善更明显,差异具有统计学意义(P<0.05),表明LIPUS 在各类联合治疗中对KOA 的抗炎作用。KOA 的发病和治疗机制并不依赖于单个细胞因子,相同的信号通路可以被不同的细胞因子激活。在LIPUS 对KOA 炎症相关信号通路作用机制的研究中,基础研究主要包括对滑膜细胞、软骨细胞和间充质干细胞(mesenchymal stem cells,MSCs)的作用等方面,其成果值得临床研究借鉴,以期针对KOA的不同发病机制选择适合的治疗参数和作用靶点,并联合不同药物,最终提高临床疗效。
2.1 LIPUS对滑膜细胞作用
随着人体衰老,膝关节软骨中裂解的细胞外基质片段(如多糖和蛋白聚糖)被释放到关节腔中,激活滑膜细胞(主要包括巨噬细胞、成纤维细胞、树突样滑膜细胞和内皮细胞等[24])上的Toll样受体(Tolllike receptors,TLRs)、晚期糖基化终产物受体(receptor for advanced glycation end products,RAGE),以及滑膜细胞内的核苷酸结合寡聚化结构域样受体蛋白3(nucleotide-binding oligomerization domain-like receptor and pyrin domain-containing protein 3,NLRP3)炎症小体,进一步级联激活以核因子活化B 细胞κ轻链增强子(nuclear factor kappa-light-chain-enhancer of activated B cells,NF-κB)信号通路和丝裂原活化蛋白激酶(mitogen-activated protein kinases,MAPKs)信号通路为主要途径的细胞内途径,产生炎性介质如IL-1β、IL-6 和TNF-α 并释放入滑液中[25],介导滑膜无菌性炎症的产生。目前研究发现,LIPUS 具有抗炎的作用,LIPUS 可能通过干预滑膜细胞上的NLRP3 炎症小体通路及自噬通路发挥抗炎作用[26-27]。2020 年的1 项研究应用脂多糖-三磷酸腺苷处理滑膜巨噬细胞,促使巨噬细胞分泌的IL-1β 显著增加,模拟膝骨关节炎的炎症过程[28],然后进行LIPUS 的治疗,发现巨噬细胞膜中释放出的NLRP3 炎症小体信号通路中的关键酶——半胱氨酸天冬氨酸蛋白酶1(Caspase 1)裂解受到抑制,进一步抑制前体IL-1β 的加工[29],从而使成熟IL-1β减少。除了抑制NLRP3 炎症小体信号通路中Caspase 1 外,这项研究还发现LIPUS 可以通过促进丙酮酸激酶(pyruvate kinase muscle,PKM)的自噬来抑制滑膜组织中IL-1β,或通过增强PKM 和螯合体1的结合,进而促进溶酶体等自噬小体降解PKM,抑制成熟IL-1β的产生,最终发挥抗炎作用[28]。见图1。另一方面,IL-1β 等炎症因子的刺激同时也导致成纤维细胞的增生和滑膜的纤维化。LIAO 等[30]发现LIPUS 可通过抑制从OA 患者滑膜中分离出的成纤维细胞上的经典无翅型MMTV 整合位点家族蛋白(wingless-type MMTV integration site family,Wnt)/β-连环蛋白信号通路,从而抑制成纤维细胞的增殖及减少滑膜纤维化。Wnt/β-连环蛋白信号通路作为典型的Wnt 信号通路,是KOA 的炎症相关通路,存在于关节的滑膜和软骨中,参与KOA 的病理过程[31]。此研究表明,LIPUS 可通过经典Wnt 信号通路来抑制成纤维细胞增殖。以上研究阐述了LIPUS可能通过NLRP3 炎症小体通路、自噬通路和经典Wnt 信号通路,来分别影响滑膜中巨噬细胞和成纤维细胞的细胞活动,达到控制炎症的效果。见图2。
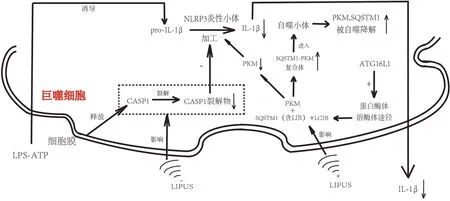
图1 LIPUS通过干预滑膜细胞上的NLRP3炎症小体通路及自噬通路发挥抗炎作用Figure 1 LIPUS exerts anti-inflammatory effects by interfering with the NLRP3 inflammatory vesicle pathway and autophagic pathway on synovial cells
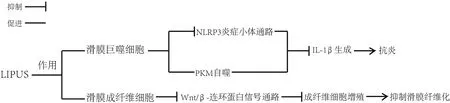
图2 LIPUS对滑膜细胞的作用Figure 2 Action of LIPUS on synovial cells
2.2 LIPUS对软骨细胞作用
随着KOA 的进展,大量炎症因子进入滑液后刺激软骨细胞,通过NF-κB 及MAPKs 等多种信号通路,产生如基质金属蛋白酶和聚集蛋白聚糖酶等软骨降解产物,介导软骨细胞的破坏[31-33]。LIPUS 通过抑制NF-κB 通路而阻断软骨细胞的破坏过程。UDDIN等[34]发现,LIPUS的机械刺激作用可以激活人软骨细胞上的整合素及牵张活化通道,使得IL-1β诱导的细胞质内NF-κB 的蛋白质磷酸化被抑制,通过抑制核转录,降低了细胞中MMP-13 和聚集蛋白聚糖酶-5 mRNA的表达,从而减少软骨细胞MMP-13和聚集蛋白聚糖酶-5 的生成,使Ⅱ型胶原蛋白(collagen type Ⅱ,Col Ⅱ)降解减缓,同时增加细胞外基质的合成,抑制软骨分解代谢,刺激软骨分化,最终起到保护软骨的作用。除此之外,LIPUS 还可作用于软骨中的MAPK 通路。MAPK 是一类广泛存在于真核细胞中的丝氨酸/苏氨酸蛋白激酶。MAPK中与KOA发病相关的酶主要有细胞外信号调节激酶(extracellular regulated protein kinases,ERK)、p38丝裂原活化蛋白激酶(p38 mitogen-activated protein kinase,p38 MAPK)和Jun 氨基末端激酶[17]。有学者提出LIPUS 可能是通过促进细胞内Ca2+内流来产生上述作用,LIPUS 产生的机械刺激激活瞬时受体电位香草素受体4 型通道蛋白(TRPV4),这种通过机械应力激活的钙通道,使Ca2+向细胞内流,进一步激活p38 MAPK通路及ERK1/2通路[35]。以上2种信号通路共同促进CCN 家族蛋白2/结缔组织生长因子(CCN family 2/connective tissue growth factor,CCN2/CTGF)的产生。CCN2 是LIPUS 作用于软骨细胞产生效应所需要的物质[36],可促进软骨细胞中Col Ⅱa1 和Acan 基因的表达(产物为Col Ⅱ和聚集蛋白聚糖),起到增加细胞外基质的作用。SEKINO等[37]也发现LIPUS 可以使小鼠软骨细胞内ERK1/2的活性和聚集蛋白聚糖的合成增加,MMP-13 的表达降低,增强软骨细胞分化和细胞外基质合成,最终促进软骨的合成。沈士浩等[38]则从不同角度揭示了LIPUS 对软骨细胞的作用,该团队提出LIPUS可能通过激活兔软骨细胞中整合素-黏着斑激酶(focal adhesion kinase,FAK)-MAPK 通路来减轻KOA 对软骨的破坏。在LIPUS 机械刺激的作用下,整合素被激活,进一步激活FAK,调控下游的MAPK水平,使ERK1/2、p38 磷酸化水平下降,最终促进Col Ⅱ的合成及减少MMP-13 的产生来保护软骨。这些结果说明LIPUS的机械刺激通过直接作用于软骨细胞上不同的靶点,对软骨细胞中2 种主要信号通路产生不同的作用,来抑制软骨降解产物的产生,抑制软骨分解,促进软骨合成,调控软骨代谢过程,延缓膝骨关节炎的进展。
2.3 LIPUS诱导MSCs再生软骨
除以上对滑膜及软骨的治疗机制外,近年来LIPUS 的研究热点逐渐趋于其对MSCs 的影响[39-40]。LIPUS 还可通过影响MSCs的增殖、分化及迁移来达到修复软骨的目的。MSCs是多能干细胞,广泛分布于滑膜、骨髓和骨骼肌等组织中,可增殖分化为多种细胞,如成骨细胞、基质细胞、软骨细胞等,其迁移到受损软骨组织中,具有修复软骨的作用,在治疗KOA 方面有巨大的潜力[41]。LING 等[42]和CHEN等[43]研究指出,LIPUS 通过激活磷脂酰肌醇3-激酶(phosphoinositide 3 kinase,PI3K)-蛋白激酶B(protein kinase B,Akt)信号通路和ERK1/2信号通路,促进人羊膜间充质干细胞的细胞增殖周期进入周期蛋白合成时期,从而上调细胞周期蛋白的表达,诱导MSCs 的增殖。XIA 等[44]观察到LIPUS 的机械刺激可使添加了转化生长因子-β1(transforming growth factor-beta 1,TGF-β1)的体外培养的大鼠骨髓MSCs 中的Col Ⅱ和聚集蛋白聚糖的基因表达增加而使Col Ⅰ的基因表达降低,促进MSCs分化形成软骨细胞,修复软骨。这个过程可能是通过促进骨髓MSCs 中的整合素-雷帕霉素的机制靶点(mammalian target of rapamycin,mTOR)信号通路来实现的。1 项大鼠体内外研究给出了更加新颖的观点,即LIPUS 可通过调节自噬来促进骨髓来源的MSCs外泌体释放[45],进一步增加Col Ⅱ等细胞外基质以保护软骨,此类外泌体也可通过抑制由IL-1β 激活的NF-κB 途径修复软骨[46]。因此LIPUS 除了直接抑制软骨破坏外,还可促进注射至关节腔的骨髓MSCs 分泌的外泌体修复软骨。另外,LIPUS 的机械应力可激活MSCs中的自噬通路并使其发生迁移,且此过程可被自噬抑制剂所抑制,但对自噬通路的激活过程及如何引起MSCs 的迁移并未具体阐明[47]。未来还需更多研究阐述LIPUS 在MSCs 迁移中的作用。近年的研究发现LIPUS通过多种经典的信号通路,在MSCs 的增殖、分化、迁移及其生物活性物质的产生、作用等方面产生效应,介导膝关节软骨代谢的调控,减缓KOA的发展。见图3。
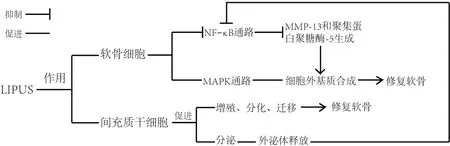
图3 LIPUS对软骨的作用Figure 3 Effect of LIPUS on cartilage
3 讨 论
综上所述,LIPUS 主要通过影响自噬、Wnt/β-连环蛋白、MAPKs、NF-κB、PI3K-Akt 和整联蛋白-mTOR 等信号通路对膝关节中的滑膜细胞、软骨细胞及骨髓间充质干细胞的细胞活动起积极作用。LIPUS 可通过增强巨噬细胞的自噬途径及抑制NLRP3 炎症小体通路使巨噬细胞产生的IL-1β 减少,减轻炎症反应。也可通过机械刺激抑制IL-1β诱导的NF-κB 途径及激活MAPK 通路,来调节软骨的分泌代谢,促进软骨细胞生成细胞外基质,保护软骨。在骨髓间充质干细胞方面,LIPUS 激活ERK1/2 和PI3K-Akt 信号通路促进MSCs 增殖分化,也通过整联蛋白-mTOR 信号通路来促进MSCs产生TGF-β1,促进软骨形成。另一方面,LIPUS 还可促进MSCs分泌外泌体,通过抑制IL-1β 诱导的NF-κB 途径改变软骨代谢,间接保护软骨。最近研究也发现LIPUS通过激活自噬来促进MSCs 的迁移。通过对LIPUS在KOA 炎症相关信号通路上不同作用途径的探索,有利于实现LIPUS 更精准的治疗。此外,干细胞新技术治疗骨关节炎疾病的临床试验已陆续开始在国内开展[10],未来应进一步寻找LIPUS 对膝关节内其他细胞或物质的影响通路,或进一步探究通过LIPUS的物理刺激让干细胞定向分化为软骨细胞并诱导其迁移修复受损软骨的可行性,为临床研究及联合治疗方案提供理论依据。