从海马区胶质细胞CD137L途径探讨电针治疗神经痛的作用机制
郑昌岳,兰艳艳,黄秋玲,江孟鸿,王志福*
1 福建省级机关医院,福建 福州 350003;
2 福建中医药大学附属康复医院,福建 福州 350003;
3 福建中医药大学针灸学院,福建 福州 350122
神经病理性疼痛(简称神经痛)是躯体感觉系统的损害或疾病导致的疼痛,临床表现为痛觉过敏、痛觉超敏等症状,并常伴随记忆障碍[1-3]。海马作为大脑内侧颞叶的一部分,在伤害性刺激的感受以及疼痛信号的处理过程中发挥重要作用[4]。神经痛发生时,海马功能呈现出不同寻常的表现,如记忆缺陷、胶质细胞激活和细胞因子释放等[5-7]。CA1区作为海马重要的功能分区之一,在痛觉调制和突触可塑性过程中同样扮演着重要角色[8],疼痛信息可诱导CA1 区蛋白表达和细胞功能的改变,如肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)释放等[9-11]。
大量研究证实,电针环跳、阳陵泉穴可显著抑制神经痛,在海马CA1 区观察发现,电针可以减少神经痛大鼠疼痛相关神经元电生理活动的异常[12]。前期研究通过蛋白组学筛查发现,电针可抑制海马关键蛋白TMEM126A 的表达,减轻神经痛敏反应,改善相关学习记忆障碍,而CD137L 是TMEM126A的重要结合蛋白[13-15]。通过文献进一步梳理分析,CD137属于肿瘤坏死因子(tumor necrosis factor,TNF)受体家族的成员,由肿瘤坏死因子受体超家族成员9(tumor necrosis factor receptor superfamily member 9,TNFRSF9)基因编码。CD137 是在活化的CD4+和CD8+T 细胞、NK 细胞、DC、巨噬细胞、肥大细胞等细胞上表达的诱导型共刺激受体,其配体为CD137L,表达于巨噬细胞、B细胞等。
在神经痛研究中发现,敲除CD137L 基因的小鼠疼痛阈值升高,并且早期使用CD137L 抗体能够有效改善痛敏反应;脊髓节段CD137L 可能通过调节小胶质细胞的活化和细胞因子的释放,促进神经痛的发生和发展[16]。然而,目前关于CD137 及配体CD137L中枢神经表达及电针镇痛的作用机制不清。基于此,拟探讨海马CD137 及CD137L 在电针改善神经痛及学习记忆中的作用。
1 实验材料
1.1 实验动物
24 只SPF 级雄性SD 大鼠,体质量160~180 g,购自浙江省医学科学院[许可证号:SCXK(浙)2019-0002],饲养于福建中医药大学实验动物中心[许可证号:SYXK(闽)2019-0007]。饲养环境保持适宜的温度、湿度、12 h光照明暗交替。本实验操作过程严格按照我国相关实验动物的规定及福建中医药大学动物管理制度,符合实验动物伦理要求(审批号:FJTCMIACUC2021006)。
1.2 仪器设备和试剂
1.2.1 主要仪器设备 Von-Frey 测痛仪(美国IITC公司,型号:NC12775);电子针疗仪(型号:SDZ-Ⅱ)、一次性针灸针(规格:1寸,0.30 mm×25 mm)均购自于苏州医疗用品厂有限公司;LEICA 冰冻切片机(德国徕卡公司,型号:CM1950);LEICA 显微镜(德国徕卡公司,型号:DFC425 C)。
1.2.2 主要试剂 5-0 非吸收性外科缝线(上海浦东金环医疗用品股份有限公司);CD137/CD137L抗体、小胶质细胞标记物(Ionized calcium-binding adapter molecule 1,Iba-1)抗体、星形胶质细胞标记物(Glial Fibrillary Acidic Protein,GFAP)抗体(美国Thermo 试剂公司);GFAP、Iba-1、CD137L、TNF-α 等ELISA 试剂盒(武汉伊莱瑞特生物科技股份有限公司)。
2 实验方法
2.1 实验分组
24 只SPF 级雄性SD 大鼠适应性喂养1 周后,按照随机数字表法分为假手术组、模型组和电针组,每组8只。
2.2 动物模型制备
参考DECOSTERD 的造模方法建立坐骨神经分支选择性损伤(spared nerve injury,SNI)模型[17]。大鼠经异氟烷麻醉后,剃除皮毛,75%乙醇消毒,切开右后肢皮肤,钝性分离肌肉,充分暴露坐骨神经主干及其远端分支,钝性分离胫神经、腓总神经和腓肠神经,5-0 丝线结扎腓总神经和胫神经并剪断,保留腓肠神经,造模后逐层缝合,切口处覆盖青霉素粉末预防感染。假手术组只暴露坐骨神经,不结扎不剪断坐骨神经及分支。
2.3 干预方法
造模后第7 天开始,电针组参照《实验针灸学》及前期研究方法[18]确定大鼠右侧环跳、阳陵泉穴位置,采用常规一次性针灸针(1寸,0.30 mm×25 mm)分别刺入10 mm、5 mm,连接电子针疗仪,电针频率为2 Hz,强度为1 mA,连续波,每天干预1 次,每次30 min,连续电针21 d。假手术组和模型组大鼠同等条件下进行抓取、固定,但不给予电针干预。
2.4 行为学检测
2.4.1 机械痛阈值检测 参考前期研究方法[18]进行机械痛阈值测试以及数值计算。在造模前及造模后第7 天(干预前)、造模后第28 天(干预后)检测3 组机械痛阈值。每次刺激后待大鼠重新安静后再开始下一次刺激,测量3 次得出的平均值记录为测试结果,代入up-and-down方法的公式计算,最终所得数值即为大鼠缩足阈值(paw withdrawal threshold,PWT),以此反映大鼠的机械痛行为学。
2.4.2 新物体识别实验 根据啮齿类动物具备对新的物体有探索的偏好本能,在造模后第28 天进行新物体识别实验,以反映大鼠的学习记忆能力。① 适应阶段:将动物依次放入测试箱内适应环境。每只大鼠放置在测试箱内10 min 任其自由探索,然后取出放回原笼内休息10 min,再放入测试箱10 min,最后归回原笼位。注意每次更换动物测试前必须清除测试箱内残留的粪便和尿液等,并用75%乙醇喷洒、擦拭、通风以消除气味。② 训练阶段:准备2个完全相同的圆柱体(物体A 和物体B),1 个长方体(物体C)。3 个物体和大鼠的体积匹配并具备一定体质量,以避免在实验过程中因大鼠攀爬而倾倒。先将物体A 和物体B放置在测试箱的左下角和右下角,调试视频分析系统并定义物体和环境的区域范围,打开录像设备。将大鼠背对2个物体放入测试箱中。实验人员离开测试房间以避免干扰。大鼠在测试箱内自由探索10 min 后,取出放回原笼内,间隔10 min后进行下一阶段。③ 测试阶段:将左下角的物体A 取出,换为物体C。打开录像设备,同样放置大鼠进入测试箱。实验人员离开房间,通过录像观察大鼠探索情况,物体识别测试时间为10 min。测试完成后将大鼠归回原笼内。通过视频分析系统采集录像,分析记录大鼠相关指标。
2.5 样本采集
造模后第28天进行样本采集。用1%浓度异氟烷麻醉大鼠后,新鲜快速取脑,分离海马CA1 区,置入EP 管液氮冻存待取。灌注取材快速灌入低温生理盐水,缓慢灌入低温4%多聚甲醛,取大脑制作冰冻切片。
2.6 酶联免疫吸附法
① 标准品稀释:根据说明书,对标准品进行梯度稀释,混匀备用。② 加样:分别设空白孔、标准品孔、待测样本孔。在酶标包被板上标准品准确加样50 μL,待测样本孔中先加样品稀释液25 μL,再加待测样本25 μL,轻轻晃动混匀。③ 温育:用封板膜封板后置37 ℃温育30 min。④ 配液:将30 倍浓缩洗涤液用蒸馏水30 倍稀释后备用。⑤ 洗涤:小心揭去封板膜,弃去液体,甩干,每孔加满洗涤液,静置30 s 后弃去,如此反复5 次,拍干。⑥ 加酶:加入酶标试剂50 μL。⑦ 温育、洗涤:操作同前。⑧ 显色:每孔加入显色剂A 50 μL,再加入显色剂B 50 μL,轻轻震荡混匀,37 ℃避光显色10 min。用450 nm 波长分别测量每个孔的吸光值(A值)。整个测定的过程应在加入终止液后的15 min 内完成。通过Excel绘制标准曲线可以计算出样品浓度值,并进行统计学分析。
2.7 免疫荧光组织化学
实验结束后取材腰段脊髓包埋,在恒冷冻切片机内进行切片,厚度为16 μm,将切好的组织片贴附在载玻片上;将切片PBS洗5 min×3次,用基因笔画圈,滴加封闭液,置于37 ℃恒温箱1 h;甩掉封闭液,分别滴加一抗(小鼠抗Iba-1、小鼠抗GFAP、小鼠抗神经元标记物(Neuronal Nuclei,NeuN)、兔抗CD137、兔抗CD137L),湿盒4 ℃过夜;次日,PBS洗5 min×3次,再避光加入二抗,置于37 ℃箱1 h;PBS 洗10 min×3 次,擦去组织周围的水分后,滴加含DAPI 的封片剂,盖上载玻片。使用荧光显微镜拍摄每只大鼠海马CA1区,每只至少随机选取5个视野拍片,并统计分析。
2.8 统计学方法
所有数据经SPSS 25.0 统计分析。计量资料符合正态分布以(±s)表示,多组间比较采用方差分析。不符合正态分布以中位数和四分位数间距[M(P25,P75)]表示,多组间比较采用非参数秩和检验。以P<0.05表示差异具有统计学意义。
3 结 果
3.1 3组机械痛阈值、新物体识别能力比较
3 组机械痛阈值采用重复测量方差分析进行统计,数据满足球形检验(P<0.001),3 组主体内时间效应差异具有统计学意义(F=32.54,P<0.001),3组主体间的组别效应差异具有统计学意义(F=31.92,P<0.001),随后进行两两比较。造模后第7 天,与假手术组比较,模型组和电针组机械痛阈值均显著下降(P<0.01)。电针干预21 d 后,与模型组相比,电针组可显著提高大鼠机械痛阈值(P<0.01)。见表1。3 组新物体识别指数采用单因素方差分析进行统计,造模后第28天,与假手术组比较,模型组新物体识别指数显著降低(P<0.01),提示大鼠学习记忆能力显著下降;与模型组比较,电针组新物体识别指数显著升高(P<0.01),提示大鼠学习记忆能力显著改善。见图1。
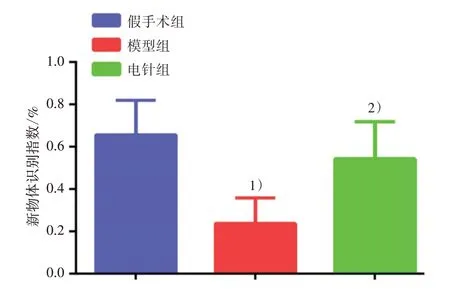
图1 3组大鼠新物体识别指数比较(±s)Figure 1 Comparison of new object recognition in dex in three groups (±s)
表1 3组大鼠机械痛阈值变化(±s)Table 1 Changes of mechanical pain threshold of rats in three groups (±s)
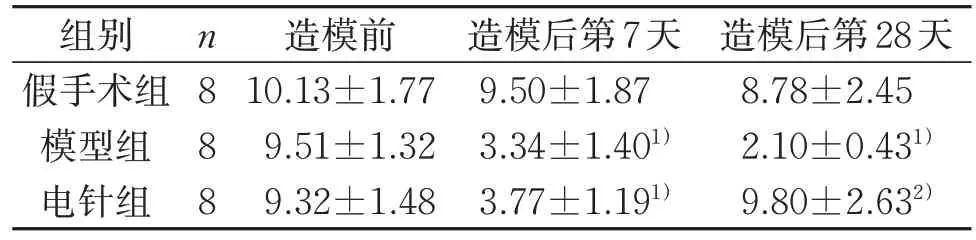
表1 3组大鼠机械痛阈值变化(±s)Table 1 Changes of mechanical pain threshold of rats in three groups (±s)
注:与假手术组比较,1) P<0.01;与模型组比较,2) P<0.01。Note: Compared with the sham group, 1) P<0.01; compared with the model group, 2) P<0.01.
组别假手术组模型组电针组n888造模后第28天8.78±2.45 2.10±0.431)9.80±2.632)造模前10.13±1.77 9.51±1.32 9.32±1.48造模后第7天9.50±1.87 3.34±1.401)3.77±1.191)
3.2 3 组大鼠海马CA1 区CD137、CD137L 与神经细胞共表达情况
免疫荧光检测表明,海马CA1 区CD137 免疫反应阳性物质与Iba-1、GFAP 免疫反应阳性物质共标记,而与NeuN 免疫反应阳性物质未共标记。见图2。同样,在海马CA1 区,CD137L 免疫反应阳性物质与Iba-1、GFAP 共标记,而与NeuN 未共标记。见图3。
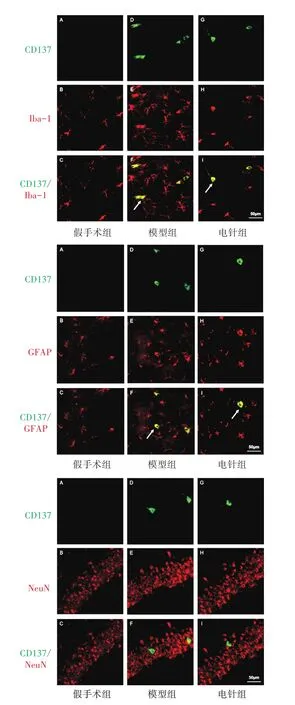
图2 3组海马CA1区CD137和Iba-1、GFAP、NeuN免疫荧光共标情况(×400)Figure 2 Co-labeling of CD137 with Iba-1, GFAP and NeuN immunofluorescence in hippocampal CA1 region of three groups (×400)
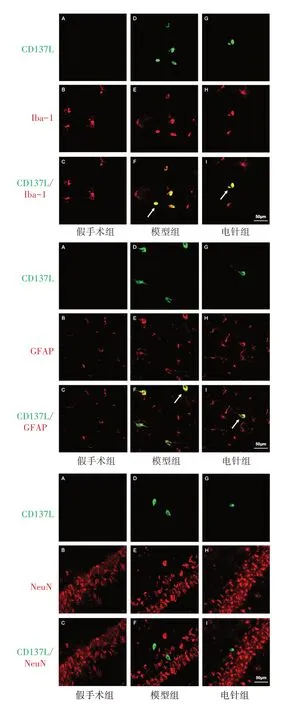
图3 3组海马CA1区CD137L和Iba-1、GFAP、NeuN免疫荧光共标情况(×400)Figure 3 Co-labeling of CD137L with Iba-1,GFAP and NeuN immunofluorescence in hippocampal CA1 region of three groups (×400)
3.3 3组海马CA1区CD137L浓度的比较
造模后第28 天,采用ELISA 检测大鼠海马CA1区CD137L 浓度。与假手术组比较,模型组CD137L浓度显著上升(P<0.01);与模型组比较,电针组CD137L浓度显著下降(P<0.01),见图4。
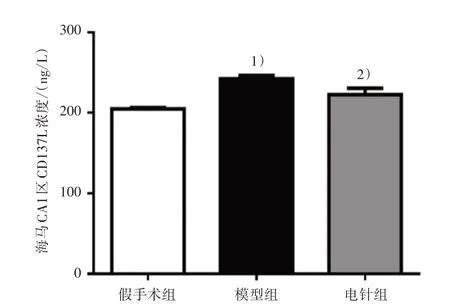
图4 3组大鼠海马CA1区CD137L浓度比较Figure 4 Comparison of CD137L concentration in hippocampal CA1 region in three groups
3.4 3组海马CA1区Iba-1、GFAP蛋白表达的比较
造模后第28 天,采用免疫荧光和ELISA 测定3 组海马CA1 区小胶质细胞和星形胶质细胞激活标记物的表达。与假手术组比较,模型组Iba-1 免疫反应阳性细胞个数和浓度均明显增多(P<0.01);与模型组比较,电针组Iba-1 细胞个数和浓度均明显减少(P<0.01)。见图5和图6。与假手术组比较,模型组GFAP免疫反应阳性细胞个数和浓度均明显增多(P<0.01);与模型组比较,电针组GFAP细胞个数和浓度均明显减少(P<0.01)。见图7和图8。
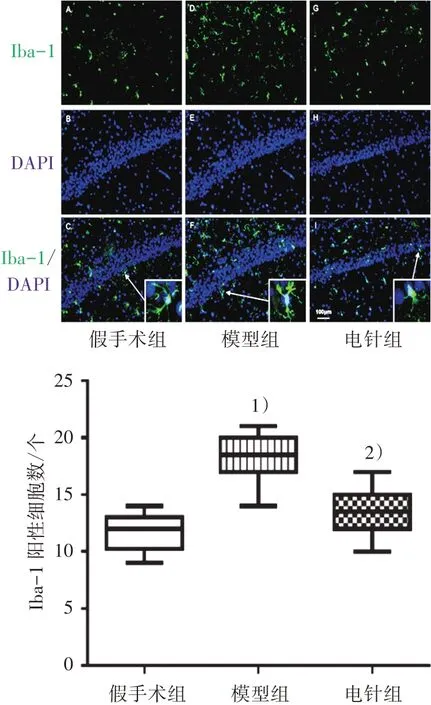
图5 3组大鼠海马CA1区小胶质细胞标记物Iba-1表达情况(×200)Figure 5 Expression of microglia marker Iba-1 in hippocampal CA1 and the number of immunoreactive cells in three groups (×200)
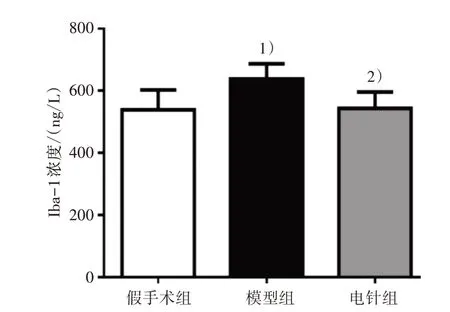
图6 3组大鼠海马CA1区Iba-1含量变化比较Figure 6 Comparison of Iba-1 content in hippocampal CA1 region of three groups
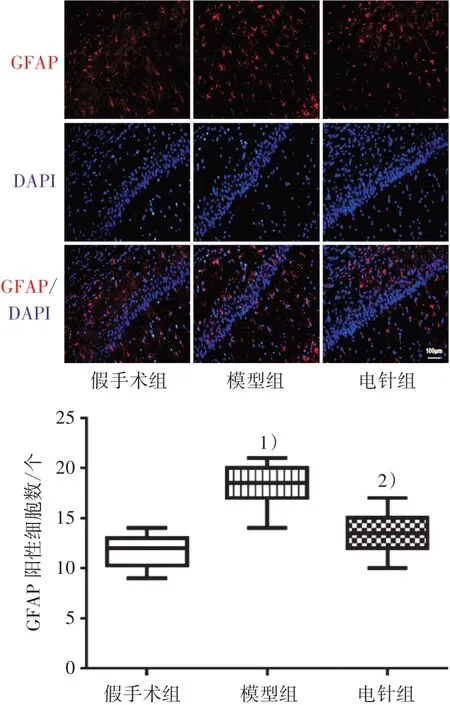
图7 3组大鼠海马CA1区星形胶质细胞标记物GFAP表达情况(×200)Figure 7 Expression of astrocyte marker GFAP in hippocampal CA1 region of three groups (×200)
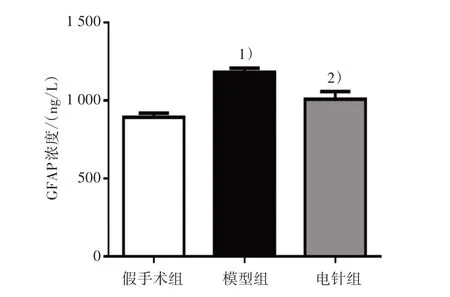
图8 3组大鼠海马CA1区GFAP含量变化比较Figure 8 Comparison of GFAP content of hippocampal CA1 region in three groups
3.5 3组大鼠海马CA1区TNF-α释放浓度比较
造模后第28 天,采用ELISA 检测大鼠海马CA1区TNF-α浓度。与假手术组比较,模型组TNF-α浓度显著上升(P<0.01);与模型组比较,电针组TNF-α浓度显著下降(P<0.05)。见图9。
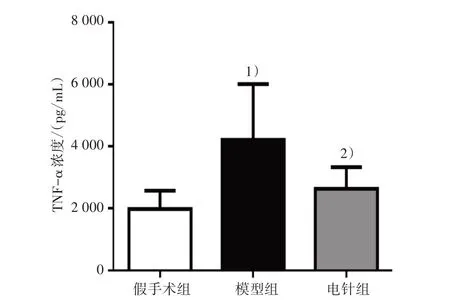
图9 3组大鼠海马CA1区TNF-α浓度比较Figure 9 Comparison of TNF-α concentration in hippocampal CA1 region of three groups
4 讨 论
近年研究表明,海马作为疼痛矩阵脑区的组成之一,是疼痛等伤害性信息加工及修饰的关键脑区,在整合疼痛信息、认知记忆等方面发挥着重要的作用[19]。神经痛发生时,海马区长时程增强(longterm potentiation,LTP)减弱,小胶质细胞活化及TNFα 释放增多,导致疼痛发生和记忆障碍;抑制海马区胶质细胞活化,降低TNF-α释放,可缓解神经痛[20-22]。
坐骨神经痛归属中医“痛痹证”范畴,应用足少阳经穴环跳、阳陵泉等进行电针,善治诸痛痹不仁,临床康复效果显著。我们前期实验研究同样表明,电针环跳、阳陵泉可显著抑制坐骨神经痛,但关于海马中枢的调控机制仍有待深入明晰[23-25]。
课题组前期蛋白组学筛选发现,电针可显著提高神经痛海马区TMEM126A 表达。进一步文献梳理发现,TMEM126A 可能结合CD137L 结合,在神经痛及电针干预中扮演重要角色[14]。基于此,本研究将CD137L 及其受体CD137 作为电针干预神经痛的可能作用靶点[26]。实验研究表明,海马CA1 区CD137L 及其受体主要表达于胶质细胞,电针可显著抑制神经痛海马区CD137L 表达和胶质细胞活化,降低炎症因子TNF-α的释放。
CD137 又称4-1BB,是一种有效的T 细胞共刺激分子,在活化T 细胞、NK 细胞和血管内皮细胞上表达。其配体CD137L 是一种跨膜蛋白,在活化的抗原提呈细胞(antigen presenting cell,APC)上与CD137结合,并将激活信号传递到APC中[27]。CD137-CD137L 的主要功能是调节细胞存活,抑制二者结合可阻止肿瘤坏死因子受体(tumor necrosis factor receptors,TNFRs)下游信号通路的激活,降低免疫炎症反应[28-29]。
然而,CD137 和CD137L 在疼痛疾病中的探索尚属于起步阶段。WAKLEY 等[16]研究发现,基因敲除CD137L 的神经痛小鼠表现出显著的痛敏反应,早期鞘内注射CD137L 抗体提高机械痛阈值,抑制脊髓小胶质细胞炎症反应。体内外实验发现,小胶质细胞与CD137L 共表达,激活小胶质细胞,诱导炎症因子如TNF-α 等的释放[30]。在炎症状态下,CD137L是巨噬细胞持续产生TNF-α 所必需的关键蛋白;巨噬细胞表达CD137L,与Toll 样受体相互作用,维持TNF-α产生[31]。
综上所述,电针可能是通过海马CA1区CD137L调节途径,抑制胶质细胞的激活和TNF-α 的释放,改善神经痛大鼠疼痛及其学习记忆障碍,今后将通过CD137L 及受体病毒干扰、基因敲除等技术,进一步深入验证CD137L/CD137在电针抗炎镇痛中的中枢作用机制。