舒尼替尼与阿苯达唑联合用药对泡状棘球蚴治疗效果的实验研究
杜云峰 姜慧娇 刘程豪 侯卜文 舒敏 黎广 陈雪玲 吴向未

摘要:目的 體内外实验探讨舒尼替尼联合阿苯达唑抗泡状棘球蚴活性。方法 体外对应药物浓度培养原头节后镜下观察其活性并计算成活率;腹腔感染泡状棘球蚴小鼠治疗60 d后,称量囊湿重并计算抑囊率。试剂盒检测AST、ALT、 IL-2,IL-4水平。HE观察病理学改变,免疫组化检测CD4、CD34表达水平。结果 体外培养第7 d ABZ+SU11248组原头节存活率(45.168%±3.903%)低于ABZ组(59.198%±1.894%)和SU11248组(69.232%±3.673%);ABZ+SU11248组的囊湿重(2.566±1.080)g低于 ABZ组(4.519±0.4934)g,SU11248(5.384±0.6586)g组和Control组(10.25±1.979)g;ABZ+SU11248组抑囊率74.94%高于ABZ组55.91%和SU11248组47.47%;ABZ+SU11248组ALT、AST水平中低于其他给药组,IL-2、IL-4水平较其他给药组明显升高。ABZ+SU11248组原头节畸形改变,角质层变薄,生发层紊乱。ABZ+SU11248组免疫组化CD4评分(10.13±1.46)高于Control组(4.00±1.07)和ABZ组(6.50±3.34);CD34评分(1.88±1.25)低于Control组(6.38±1.85),ABZ组(6.63±1.69)和SU11248组(4.25±1.17)。结论 舒尼替尼能够通过抑制血管新生来抑制泡状棘球蚴的生长,其与阿苯达唑联合治疗比二者单独治疗对泡状棘球蚴活性抑制作用更强且造成更低的肝损伤。
关键词:泡状棘球蚴;阿苯达唑;舒尼替尼;联合用药
中图分类号:中图分类号R532.32文献标志码:A文献标识码
Sunitinib in combination with albendazole for the treatment of alveolar echinococcosis
DU Yunfeng 1,JIANG Huijiao1,LIU Chenghao1,HOU Bowen1,SHU Min1,LI Guang1,CHEN Xueling2,WU Xiangwei 1,3*
(1 School of Medicine,Shihezi University/NHC Key Laboratory of Prevention and Treatment of Central Asia High Incidence Diseases,
Shihezi,Xinjiang 832000, China; 2 Department of Immunization, School of Medicine,
Shihezi University,Shihezi,Xinjiang 832000, China; 3 Department of Hepatobiliary Surgery, The First Affiliated Hospital of
Medical College,Shihezi University, Shihezi,Xinjiang 832000, China)
Abstract: Objective To investigate the anti-alveolar echinococcosis activity of sunitinib combined with albendazole in vitro and in vivo. Methods The activity was observed and the survival rate was calculated under the posterior microscope after cultured with the corresponding drug concentration in vitro. After 60 days of treatment, the wet weight of the cyst was measured and the rate of cyst inhibition was calculated. AST, ALT, IL-2 and IL-4 levels were detected by the kit. The pathological changes were observed by HE, and the expression levels of CD4 and CD34 were detected by immunohistochemistry. Results The survival rate of alveolar echinococcosis protoscoleces in ABZ+SU11248 group (45.168%±3.903%) was lower than that in ABZ group (59.198%±1.894%) and SU11248 group (69.232%±3.673%) on the 7th day of culture in vitro. The wet weight of capsule in ABZ+SU11248 group (2.566±1.080) g was lower than that in ABZ group (4.519±0.4934) g, SU11248 group (5.384±0.6586) g and Control group (10.25±1.979) g. The rate of sac inhibition in ABZ+SU11248 group 74.94% was higher than that in ABZ+SU11248 group 55.91% and SU11248 group 47.47%. The levels of ALT and AST in ABZ+SU11248 group were lower than those in other administration groups, and the levels of IL-2 and IL-4 were significantly higher than those in other administration groups. ABZ+SU11248 group was characterized by malformation, thinning of cuticle layer and disorder of germinal layer. Immunohistochemical CD4 score in ABZ+SU11248 group (10.13±1.46) was higher than that in Control group (4.00±1.07) and ABZ group (6.50±3.34). The score of CD34 (1.88±1.25) was lower than that of Control group (6.38±1.85), ABZ group (6.63±1.69) and SU11248 group (4.25±1.17). Conclusion Sunitinib can inhibit the growth of alveolar echinococcosis by inhibiting angiogenesis. The combination of Sunitinib and albendazole has a stronger inhibitory effect on the activity of alveolar echinococcosis and causes less liver damage than the two treatments alone.
Key words: echinococcus alveolaris;albendazole;sunitinib;combination of drugs
棘球蚴病(Echinococciosis)一种人与动物之间的传染病,主要由棘球蚴的幼虫感染引起。其特征是细粒棘球蚴感染所引起的囊型包虫病(Echinococcus granulosus,CE),以及多房棘球蚴所引起的泡状棘球蚴病(Alveolar Echinococcosis,AE)[1]。人类常因误食虫卵而被感染,在人体内的泡状棘球蚴随着血液运输至肝脏且在此定居引发肝泡状棘球蚴病(Hepatic alveolar echinococcosis,HAE)[2]。临床上肝泡状棘球蚴病通常以肿瘤的形式发展,即所谓的“寄生虫型肝癌”,如未及时治疗,90%的患者在确诊后10~15年之内就会死亡[3]。阿苯达唑(Albendazole,ABZ)是治疗泡球蚴病的一线药物,用于外科手术后的辅助治疗和姑息疗法,长期使用ABZ会产生严重的不良反应和耐药性[4]。
泡状棘球蚴的侵袭、生长和转移的重要机制与血管新生相关[5]。血管内皮生长因子(Vascular endothelial growth factor,VEGF) 在组织损伤、缺氧、炎症等环境中的表达增强,与血管内皮生长因子受体(VEGFR1-3)结合在促进新血管生成和淋巴管生成中起重要作用[6-7]。泡状棘球蚴感染时,因寄生虫的存在,会使宿主细胞不断产生VEGFA[8]、转化生长因子-β(Transforming growth factor-β,TGF-β)[9-10]和基质金属蛋白酶2(Matrix metalloproteinase 2,MMP2)[11],从而使其产生无法控制的血管新生。血管调节因子CD34是一种高度糖基化的I型糖蛋白,在人体和其它哺乳动物的血液中选择性表达[12]。CD34介导的黏附信号[13]是由酪氨酸蛋白激酶(Tyrosine protein kinase,TPK)所决定的,TPK特异性的抑制剂能阻止细胞的黏附。阿苯达唑是世界卫生组织推荐的治疗棘球蚴病的一线药物之一,通过抑制虫体摄取葡萄糖,使虫体生发层细胞糖原耗竭、内质网小体和线粒体变性,溶酶体增加,最终导致虫体死亡。能改善患者的生活品质并延长寿命。但存在胃肠道吸收率较低、半衰期较短、生物利用度低等,这些缺点使阿苯达唑难以在体内达到有效的血药浓度[14]。舒尼替尼(Sunitinib,SU11248)是一种多靶向酪氨酸激酶抑制剂,它可以选择性地针对多个酪氨酸激酶受体(Receptor tyrosine kinases,RTK)来治疗消化道基质肿瘤和转移性肾癌。RTK在细胞生长的调节中起重要作用,突变或过度表达的RTK与多种人类癌症有关[15]。舒尼替尼可逆转免疫抑制,治疗荷瘤小鼠时发现IL-10、TGF-β和Foxp3的表达降低,CD4和CD8细胞的百分比和浸润程度明显更高[16]。抑制VEGF信号途径可以抑制肿瘤的生长,血管新生和转移[17-19]。临床上对于舒尼替尼的不良反应有血细胞计数减少(特别是白细胞)、腹泻、疲劳、恶心等症状[20]。因此我们希望能探索一种新的药物剂量或改良给药方式在降低阿苯达唑和舒尼替尼药物不良反应的同时还能达到较好的治疗效果。
1 材料与方法
1.1 主要实验动物及来源
泡状棘球蚴腹腔感染6月的沙鼠购自新疆维吾尔地区疾控中心。雌性C57BL/6小鼠购于北京福贝斯公司,体重(20±2)g、6~8 周龄[动物生产许可证号:SCXK (京)2019-0030],在SPF级实验动物房饲养。
1.2 主要试剂
舒尼替尼(Sunitinib,SU11248)、阿苯达唑(Albendazole,ABZ)购于美国APExBIO公司;DMEM高糖培养液、磷酸盐缓冲液(PBS)、10%胎牛血清、青链霉素、购于美国Life-Gibco公司;伊红染液购于中国北京索来宝公司;谷草转氨酶(AST/GOT)测试盒、谷丙转氨酶(ALT/GPT)测试盒购于中国南京建成公司;Anti-CD4、Anti-CD34抗体、IL-2 ELISA Kit檢测试剂盒、IL-4 ELISA Kit检测试剂盒购于美国Abcam公司。
1.3 方法
1.3.1 泡状棘球蚴原头蚴的提取与活性鉴定
无菌操作取已保种泡状棘球蚴沙鼠腹腔中泡球蚴组织,进行洗涤、剪切、研磨、过滤、沉淀,重复3次。取10 μL悬浮液滴于玻片上,用0.1%伊红染液对泡状棘球蚴进行染色,染色率<5%,泡状棘球蚴活性好。一部分泡状棘球蚴原头节放入含青霉素和链霉素各100 U·mL-1和10%胎牛血清的高糖DMEM培养基,于37℃、5%CO2细胞培养箱中培养2 d后用于体外试验;另一部分泡状棘球蚴加无菌生理盐水配制成20%混合液用于体内实验。
1.3.2 实验分组及治疗方案
将体外实验分5组:Blank组(空白对照组)、DMSO组(溶剂对照组)、25 μg·mL-1 ABZ组(阿苯达唑粉剂组)、50 ng·mL-1 SU11248组(舒尼替尼组)[21],25 μg·mL-1 ABZ+50 ng·mL-1 SU11248(阿苯达唑粉剂联合舒尼替尼粉剂组)。按上述浓度配制各组培养基,加入6孔板中,每孔加入体外已培养2d的泡状棘球蚴原头节约5 000个,于培养箱中培养,每隔24h取原头节用0.1%伊红染液鉴定其活性,操作重复3次,泡状棘球蚴原头蚴活性率%=(未染色的泡状棘球蚴原头节数量/泡状棘球蚴原头节总数量)×100%;将40只腹腔接种泡状棘球蚴的C57BL/6小鼠随机分成5组:Blank组(空白对照组)、Control组(模型对照组)、ABZ组(阿苯达唑粉剂组)、SU11248组(舒尼替尼粉剂组)、ABZ+SU11248组(阿苯达唑联合舒尼替尼粉剂组),每组8只。阿苯达唑给药浓度为100mg·kg-1,舒尼替尼给药浓度为50mg·kg-1,联合用药组为每天单药交替给药,给药方式均为经口灌胃。给药治疗60d后取各组小鼠血清、肝脏、腹腔泡状棘球蚴组织备用。
1.3.3 检测小鼠血清AST、ALT水平
各组C57BL/6小鼠于离心机中12 000 r·min-1离心后,取上清液,按照谷草转氨酶(AST/GOT)、谷丙转氨酶(ALT/GPT)测试盒说明进行检测。
1.3.4 ELISA检测小鼠血清中IL-2、IL-4水平
取小鼠上清液,按照测Mouse IL-2 ELISA Kit检测试剂盒(酶联免疫吸附法)、Mouse IL-4 ELISA Kit检测试剂盒(酶联免疫吸附法)说明进行检测。
1.3.5 泡状棘球蚴组织病理学变化及CD4、CD34水平检测
取出泡状棘球蚴组织后用4%多聚甲醛固定组织48 h,石蜡包埋切片,对组织进行HE染色,显微镜下观察其病理学变化。以CD4(1∶1 000),CD34 (1∶2 000)抗体作为一抗,免疫组织化学检测泡状棘球蚴组织CD4、CD34表达水平,评判标准参考文献[22]。细胞质不显色或者显示不清记 0分,浅黄色记1分,黄色记2分,棕黄色记3分;选3个视野,高倍镜下每个视野计数细胞200个,计算阳性细胞百分率:<5%记0分,6%~25%记1分,26%~50%记2分,51%~75%记3分,>76%记4分。
1.4 统计学分析
利用SPSS 25.0软件对上述各项实验进行数据统计和分析,分析结果统一用均数±标准差(X±S)表示;多组之间的比较采用单因素方差分析(ANOVA),结果显示P<0.05说明差异有统计学意义。
1.5 伦理批准
本研究经石河子大学医学院第一附属医院伦理审查会批准 (批准号为 A2018-166),不涉及患者知情同意。
2 结果
2.1 联合用药对体外泡状棘球蚴原头节形态的影响
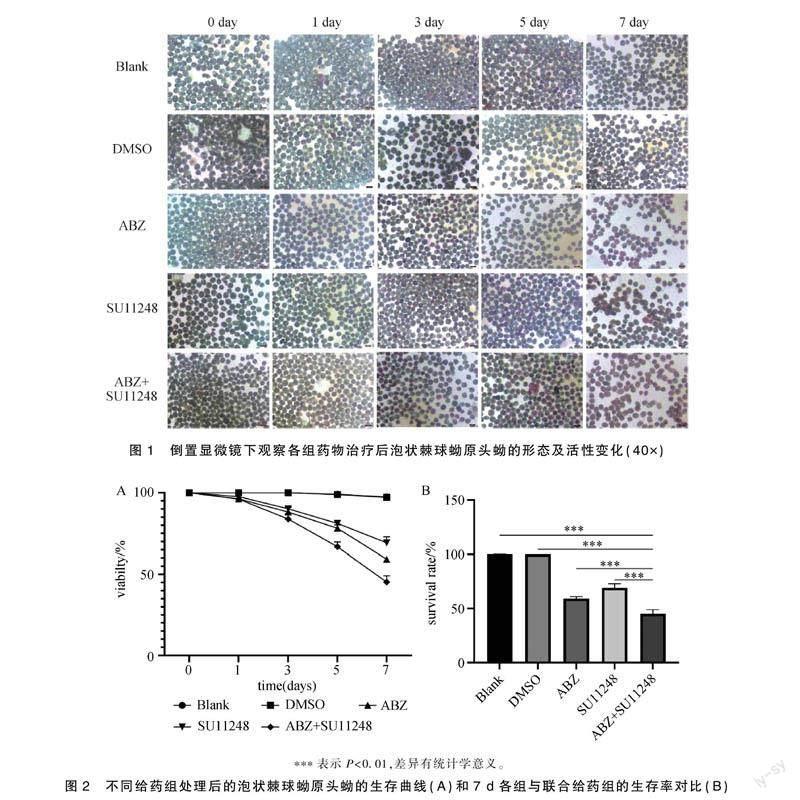
从给药第三天开始,随着给药时间增加,镜下可见泡状棘球蚴原头节形态发生明显改变。Blank组和DMSO组镜下原头节形态结构完整,有活动,伊红染液不染色,表明其活性良好。ABZ組,SU11248组和ABZ+SU11248组镜下原头节表现为不同程度的伊红着色。在ABZ+SU11248组中明显发现随着培养时间加长,镜下原头节染色程度加深,结构紊乱,吸盘外翻,活力下降易被伊红染色(图1)。
2.2 联合用药显著抑制体外泡状棘球蚴原头节的活性
泡状棘球蚴原头节在各组药物治疗1~7 d中,每24 h用0.1%伊红染色计算原头节生存率。重复测量后方差分析,各给药组原头节存活率与对照组差异具有统计学意义,随着给药时间增加,原头节活性逐步下降(F=804.9,P <0.05)(图2A)。在第7 d发现Blank组、DMSO组,ABZ组和SU11248组的泡状棘球蚴原头节活力为(97.357%±0.903%)、(97.133%±0.696%)、(59.198%±1.894%)、(69.232%±3.673%),与ABZ+SU11248联合组泡状棘球蚴原头节活力(45.168%±3.903%)相比差异具有统计学意义(F=480,P <0.001)。随着给药时间的增加,ABZ+SU11248联合用药组对泡状棘球蚴原头蚴的活力抑制作用更明显(图2B)。
2.3 联合用药显著抑制小鼠体内泡状棘球蚴的生长
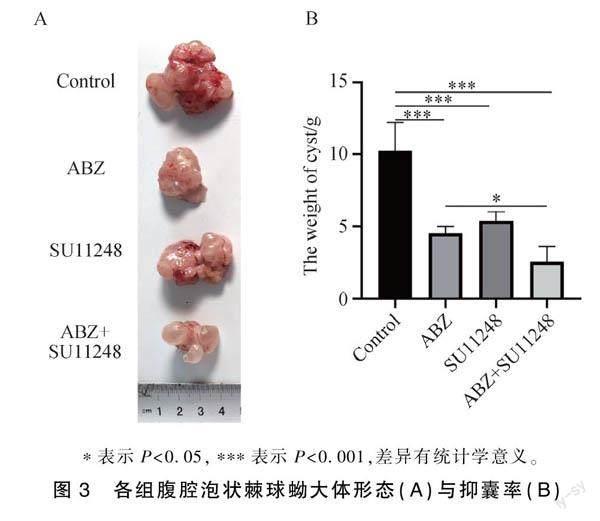
Control组的泡状棘球蚴囊泡较大,数目多,呈菜花样,囊壁有较高的张力,其表面可见新生血管形成。ABZ+SU11248组的囊泡较其他组小,数目少,囊壁张力低,其表面少见血管新生(图3A)。ABZ+SU11248组小鼠囊湿重为(2.566±1.080)g低于Control组(10.25±1.979)g,低于ABZ组(4.519±0.4934)g和SU11248组(5.384±0.6586)g(P <0.05)。ABZ+SU11248组囊泡的抑制率为74.94%,高于ABZ组55.91%和SU11248组47.47%(P <0.05),ABZ组与SU11248组囊湿重比较差异无统计学意义(P>0.05)。
2.4 联合用药对小鼠肝损伤更低
小鼠血清ALT浓度中的Blank组与Control组、ABZ组,SU11248组和ABZ+SU11248组相比具有统计学意义(F=24.17,P <0.001)。ABZ+SU11248组小鼠血清ALT浓度(51.73±6.309)U·L-1低于Control组(83.36±10.65)U·L-1,低于ABZ组(73.96±10.26)U·L-1和SU11248组(72.67±7.758)U·L-1(P <0.05)(图4A)。小鼠血清AST浓度中的Blank组与Control组、ABZ组,SU11248组和ABZ+SU11248组相比差异具有统计学意义(F=31.14,P <0.001),ABZ+SU11248组小鼠血清中AST浓度(96.60±9.880)U·L-1低于Control组(159.4±17.78)U·L-1和ABZ组(131.5±8.106)U·L-1和SU11248组(126.7±12.34)U·L-1(P <0.05)(图4B)。
2.5 联合用药使小鼠血清IL-2、IL-4水平升高
ELISA检测结果示:在IL-2表达水平中ABZ+SU11248组与Control组、ABZ组,SU11248组相比具有统计学意义(F=63.63,P <0.05),ABZ+SU11248组小鼠血清中IL-2浓度(171.00±9.502)U·L-1高于Control组(82.35±7.830)U·L-1,高于ABZ组(147.50±7.902)U·L-1和SU11248组(148.70±13.30)U·L-1(P <0.05),而与Blank组(170.40±11.22)U·L-1相比差异无统计学意义(P >0.05)(图5A)。在IL-4表达水平中ABZ+SU11248组与Control组、ABZ组,SU11248组相比具有统计学意义(F=18.88,P <0.05),ABZ+SU11248组小鼠血清中IL-4浓度(63.10±4.946)U·L-1高于Control组(37.05±4.752)U·L-1,高于ABZ组(49.66±3.992)U·L-1和SU11248组(49.67±6.789)U·L-1(P <0.05),而与Blank组(67.64±6.916)U·L-1相比差异无统计学意义(P >0.05)。
2.6 小鼠腹腔泡状棘球蚴组织病理学观察
伊红染色下Control组可见明显的原头节生成,囊泡周围的角质层结构和生发层结构清晰。ABZ组可见明显的炎性细胞浸润,囊泡内原头节呈发育不良的状态。SU11248组角质层变薄,囊泡内原头节也呈发育不良状态。ABZ+SU11248组的炎性反应带变窄,且明显可见囊泡生角质层变薄,囊泡内偶见少量畸形原头节生成(图6)。
2.7 联合用药腹腔泡状棘球蚴组织中CD4水平高表达,CD34水平低表达
免疫组组化结果显示,各组小鼠腹腔内泡状棘球蚴组织中均可检测到CD4、CD34的表达。
ABZ+SU11248组的CD4评分结果与ABZ组和和Control组间相比差异具有统计学意义(F=8.09,P<0.05),ABZ+SU11248组CD4评分(10.13±1.46)高于Control组(4.00±1.07)和ABZ组(6.50±3.34)(P<0.05)。ABZ+SU11248组与SU11248组间差异无统计学意义(P >0.05)。ABZ+SU11248组的CD34评分结果与ABZ组,SU11248组和Control组间相比差异具有统计学意义(F=17.08,P <0.05),ABZ+SU11248组CD34评分(1.88±1.25)低于Control组(6.38±1.85),低于ABZ组(6.63±1.69)和SU11248组(4.25±1.17)(P <0.05)。ABZ组泡状棘球蚴CD34评分与Control组组间差异无统计学意义(P>0.05)(图7)。
3 讨论
泡状棘球蚴病是一种人畜共患寄生虫病,常因误食多房棘球绦虫虫卵而被传染的,其生物学行为与肿瘤类似,故有“虫癌”之称[23]。目前治疗方式主要为根治性切除术,对不能手术者行化疗[4]。藥物治疗主要为苯并咪唑类药物,阿苯达唑是棘球蚴病的首选治疗药物,进入人体后转化成为阿苯达唑亚砜从而发挥杀虫作用,该药在肠道的溶解性差,吸收度低,体内广泛分布,从而导致虫体周围药物浓度不高,治愈难度大,但临床治疗效果欠佳,且需长期服药,不良反应风险提高[24],急需开发新药来提高疗效。泡状棘球蚴的生长依赖新血管的生成且血管中的养分能进一步促使泡状棘球蚴生长发育,本次实验通过使用舒尼替尼抑制血管生成的作用来观察其对泡状棘球蚴的原头节的抑制作用。在体外实验中发现舒尼替尼对泡状棘球蚴原头节也存在抑制作用,具体机制有待进一步探究。在体内实验中发现阿苯达唑联合舒尼替尼组的治疗对泡状棘球蚴生长抑制作用最强,泡状棘球蚴囊泡周围的角质层显著变薄,囊泡内原头节呈畸形发育。
在感染泡状棘球蚴后各个治疗组血清ALT、AST均升高,经过药物治疗后发现阿苯达唑联合舒尼替尼组的肝功指标较阿苯达唑组、舒尼替尼组和模型对照组均低,说明阿苯达唑联合舒尼替尼用药能有效抑制泡状棘球蚴的生长从而降低其对肝脏的损伤。同时舒尼替尼组与阿苯达唑组的肝功指标相比无差异,表明舒尼替尼对小鼠无明显药物毒性作用。
在被泡状棘球蚴感染时,辅助性T细胞1 (T helper type 1, Th1)细胞免疫应答的激活与Th2细胞免疫应答的激活不平衡,导致细胞因子的不同释放。研究表明,药物的治疗效果可以通过监测血清中IL-4的水平来评估[25-27],在泡状棘球蚴感染的晚期IL-4水平的降低有利于泡状棘球蚴囊泡的生长[28]在本实验,模型对照组血浆IL-4含量显著低于空白组,与之前的试验结果相符[29-31]。既往实验中发现在棘球蚴感染后期,IL-4水平和嗜酸性粒细胞百分比的升高有利于宿主[32]。IL-2是大多数感染性疾病中重要的炎症和免疫应答因子,具有增强宿主免疫,抑制肿瘤和寄生虫生长的功能[33]。当受到泡状棘球蚴感染时其会增加宿主体内IL-2受体的表达使IL-2大量消耗,进而抑制了T淋巴细胞的免疫活性,并触发泡状棘球蚴的免疫逃逸[34]。本实验中,模型对照组的IL-2低表达表明泡状棘球蚴能降低宿主IL-2水平,符合既往实验结果。与模型对照组相比,其余各给药组均IL-2表达水平明显升高,阿苯达唑联合舒尼替尼组的IL-2水平高表达,证明联合用药能提高宿主的免疫应答,其增强免疫能力比单药模式效果更好。尽管对泡状棘球蚴的免疫已经有了一定的了解,但许多免疫机制仍不清楚,需进行更深入的研究。
伊红染色下观察到模型对照组有明显的泡状棘球蚴原头节生成,囊泡内可见完整的生发层其周围可见清晰的角质层结构。经过用药治疗后发现舒尼替尼组能使泡状棘球蚴囊泡周围的角质层变薄,而阿苯达唑联合舒尼替尼组的囊泡中观察到囊泡内的原头节成畸形改变,周围角质层明显变薄。推测其原因是舒尼替尼组抑制血管生成阻断营养物质运输而导致囊泡的角质层发育不良而变薄,同时变薄的角质层更有利于阿苯达唑的渗透从而更好的抑制泡状棘球蚴的生长使其发育畸形。
CD34是最敏感的、具有最强抗原特异性的内皮标记物,它被广泛应用于标记新生血管生成中的微血管和内皮细胞[35]。本实验研究中,CD34在联合用药组中表达最低,舒尼替尼组的CD34的表达低于模型对照组和阿苯达唑组且具有显著性差异,表明舒尼替尼抑制酪氨酸激酶受体使CD34表达下调,从而抑制血管内皮细胞增生阻遏泡状棘球蚴周围新生血管生成。
CD4在人体免疫调节系统中起着重要作用,被称为辅助T细胞,因其对适应性免疫系统的显著作用而被关注,研究表明促进CD4向Th1细胞分化后可抑制肿瘤生长[36]。实验中阿苯达唑联合舒尼替尼组的CD4表达水平明显高于空白对照组、模型对照组,阿苯达唑组和舒尼替尼组,与既往结果一致。在肿瘤中舒尼替尼可活化Th1细胞增加CD4细胞浸润[16]。CD4高表达向Th1分化能更好的抑制泡状棘球蚴生长发育,然而其具体机制仍然不太清楚,尤其是那些涉及寄生虫与宿主关系的机制,因为它们非常复杂。因此,需进一步深入研究这些机制。
综上所述,在体外对泡状棘球蚴原头节进行给药处理中,阿苯达唑与舒尼替尼联合用药既降低了给药剂量又比单药给药对泡状棘球蚴原头节的活性的抑制效果更好,在对小鼠腹腔泡状内泡状棘球蚴的治疗中,阿苯达唑联合舒尼替尼能更好抑制泡状棘球蚴的生长,其囊泡内的原头节成畸形发育,治疗效果比单药模式更佳。阿苯达唑联合舒尼替尼给药模式降低剂量同时拥有更佳的治疗效果,有望为泡状棘球蚴病的治疗与预后提供一种新的策略和理论依据。
参考文献(References)
[1]KERN P, MENEZES D A, SILVA A, et al. The echinococcoses: diagnosis, clinical management and burden of disease[J]. Advances in Parasitology, 2017, 96: 259-369.
[2]D′ALESSANDRO A, RAUSCH R L. New aspects of neotropical polycystic (Echinococcus vogeli) and unicystic (Echinococcus oligarthrus) echinococcosis[J]. Clinical Microbiology Reviews, 2008, 21(2): 380-401.
[3]TORGERSON P R, SCHWEIGER A, DEPLAZES P, et al. Alveolar echinococcosis: from a deadly disease to a well-controlled infection. Relative survival and economic analysis in Switzerland over the last 35 years[J]. Journal of Hepatology, 2008, 49(1): 72-77.
[4]HEMPHILL A, STADELMANN B, RUFENER R, et al. Treatment of echinococcosis: albendazole and mebendazole--what else?[J]. Parasite (Paris, France), 2014, 21: 70.
[5]郭黎姣, 姜慧娇, 韩欢欢, 等. 肝泡状棘球蚴组织中HIF-1α、VEGFA的表达及对血管生成的作用[J]. 中国人兽共患病学报, 2019, 35(7): 639-646.
GUO L J, JIANG H J, HAN H H, et al. Expression of HIF-1α and VEGFA in hepatic alveolar echinococcosis and its effects on angiogenesis[J]. Chinese Journal of Zoonoses, 2019, 35(7): 639-646.
[6]ESWARAPPA S M, FOX P L. Antiangiogenic VEGF-Ax: a new participant in tumor angiogenesis[J]. Cancer Research, 2015, 75(14): 2765-2769.
[7]APTE R S, CHEN D S, FERRARA N. VEGF in signaling and disease: beyond discovery and development[J]. Cell, 2019, 176(6): 1248-1264.
[8]姜慧娇, 桂显伟, 郭黎姣, 等. VEGFA/VEGFR2在小鼠肝多房棘球蚴组织血管生成中的表达及作用[J]. 中国寄生虫学与寄生虫病杂志, 2020, 38(6): 673-681.
JIANG H J, GUI X W, GUO L J, et al. Expression and angiogenic effect of VEGFA/VEGFR2 in mice hepatic metacestode tissue of Echinococcus multilocularis[J]. Chinese Journal of Parasitology and Parasitology, 2020, 38(6): 673-681.
[9]NONO J K, LUTZ M B, BREHM K. Expansion of host regulatory T cells by secreted products of the tapeworm echinococcus multilocularis[J]. Frontiers in Immunology, 2020, 11: 798.
[10]CAO T, YANG Y W, YANG X, et al.[Expression and significance of TGF-β1, p38MAPK and BMP-7 protein in liver specimens of patients with alveolar hepatic echinococcosis][J]. Chinese Journal of Schistosomiasis Control, 2021, 33(4): 353-358.
[11]荔童, 吴向未, 張永国, 等. 抗骨桥蛋白抗体对沙鼠肝多房棘球蚴组织中的基质金属蛋白酶2和转化生长因子β1的影响[J]. 中国寄生虫学与寄生虫病杂志, 2013, 31(6): 450-453.
LI T, WU X W, ZHANG Y G, et al. Effects of anti-osteopontin antibody on expression of MMP-2 and TGF-β1 in hepatic alveolar hydatid tissue of gerbil[J]. Chinese Journal of Parasitology and Parasitology, 2013, 31(6): 450-453.
[12]DAZ-FLORES L, GUTIRREZ R, GARCA M P, et al. CD34+ stromal cells/fibroblasts/fibrocytes/telocytes as a tissue reserve and a principal source of mesenchymal cells. Location, morphology, function and role in pathology[J]. Histology and Histopathology, 2014, 29(7): 831-870.
[13]LVESQUE J P, SIMMONS P J. Cytoskeleton and integrin-mediated adhesion signaling in human CD34+ hemopoietic progenitor cells[J]. Experimental Hematology, 1999, 27(4): 579-586.
[14]WEN H, VUITTON L, TUXUN T, et al. Echinococcosis: advances in the 21st century[J]. Clinical Microbiology Reviews, 2019, 32(2):e00075-18.
[15]MOTZER R J, HOOSEN S, BELLO C L, et al. Sunitinib malate for the treatment of solid tumours: a review of current clinical data[J]. Expert Opinion on Investigational Drugs, 2006, 15(5): 553-561.
[16]OZAO-CHOY J, MA G, KAO J, et al. The novel role of tyrosine kinase inhibitor in the reversal of immune suppression and modulation of tumor microenvironment for immune-based cancer therapies[J]. Cancer Research, 2009, 69(6): 2514-2522.
[17]QI X, YANG M, MA L, et al. Synergizing sunitinib and radiofrequency ablation to treat hepatocellular cancer by triggering the antitumor immune response[J]. Journal for Immunotherapy of Cancer, 2020, 8(2):001038.
[18]SHAH A A, KAMAL M A, AKHTAR S. Tumor angiogenesis and VEGFR-2: mechanism, pathways and current biological therapeutic interventions[J]. Current Drug Metabolism, 2021, 22(1): 50-59.
[19]ITATANI Y, KAWADA K, YAMAMOTO T, et al. Resistance to anti-angiogenic therapy in cancer-alterations to anti-VEGF pathway[J]. International Journal of Molecular Sciences, 2018, 19(4):1232.
[20]FERRARI S M, CENTANNI M, VIRILI C, et al. Sunitinib in the treatment of thyroid cancer[J]. Current Medicinal Chemistry, 2019, 26(6): 963-972.
[21]ROSKOSKI R. Sunitinib: a VEGF and PDGF receptor protein kinase and angiogenesis inhibitor[J]. Biochemical and Biophysical Research Communications, 2007, 356(2): 323-328.
[22]許良中,杨文涛. 免疫组织化学反应结果的判断标准[J]. 中国癌症杂志, 1996(4): 229-231.
XU L Z, YANG W T. Evaluation criteria of immunohistochemical reaction results[J]. Chinese Journal of Cancer, 1996(4): 229-231.
[23]PIARROUX M, PIARROUX R, GIORGI R, et al. Clinical features and evolution of alveolar echinococcosis in France from 1982 to 2007: results of a survey in 387 patients[J]. Journal of Hepatology, 2011, 55(5): 1025-1033.
[24]DORN C, MASSINGER S, WUZIK A, et al. Xanthohumol suppresses inflammatory response to warm ischemia-reperfusion induced liver injury[J]. Experimental and Molecular Pathology, 2013, 94(1): 10-16.
[25]MA X M, BAO G, WAN J M, et al. Therapeutic effects of Sophora moorcroftiana alkaloids in combination with albendazole in mice experimentally infected with protoscolices of Echinococcus granulosus[J]. Brazilian Journal of Medical and Biological Research, 2007, 40(10): 1403-1408.
[26]MORENO M J, URREA-PARS M A, CASADO N, et al. Praziquantel and albendazole in the combined treatment of experimental hydatid disease[J]. Parasitol Res, 2001, 87(3): 235-238.
[27]TORCAL J, NAVARRO-ZORRAQUINO M, LOZANO R, et al. Immune response and in vivo production of cytokines in patients with liver hydatidosis[J]. Clinical and Experimental Immunology, 1996, 106(2): 317-322.
[28]ZHU J. T helper 2 (Th2) cell differentiation, type 2 innate lymphoid cell (ILC2) development and regulation of interleukin-4 (IL-4) and IL-13 production[J]. Cytokine, 2015, 75(1): 14-24.
[29]YUAN M, SONG X, LYU W, et al. Effect of anacardic acid against echinococcosis through inhibition of VEGF-induced angiogenesis[J]. Vet Res, 2019, 50(1): 3.
[30]LIU C, FAN H, GUAN L, et al. In vivo and in vitro efficacy of crocin against Echinococcus multilocularis[J]. Parasites & Vectors, 2021, 14(1): 364.
[31]MA X, WANG L, ZHAO H, et al. Th17 cells are associated with the Th1/Th2-cell balance during Echinococcus multilocularis infection[J]. Molecular Medicine Reports, 2014, 10(1): 236-240.
[32]YUAN M, LUO Y, XIN Q, et al. Efficacy of osthole for echinococcus granulosus in vitro and echinococcus multilocularis in vivo[J]. Vet Parasitol, 2016, 226: 38-43.
[33]EMERY I, LIANCE M, LECLERC C. Secondary echinococcus multilocularis infection in A/J mice: delayed metacestode development is associated with Th1 cytokine production[J]. Parasite Immunology, 1997, 19(11): 493-503.
[34]CORRêA F, HIDALGO C, STOORE C, et al. Cattle co-infection of Echinococcus granulosus and Fasciola hepatica results in a different systemic cytokine profile than single parasite infection[J]. PloS One, 2020, 15(9): e0238909.
[35]RAHMAH N N, SAKAI K, SANO K, et al. Expression of RECK in endothelial cells of glioma: comparison with CD34 and VEGF expressions[J]. Journal of Neuro-Oncology, 2012, 107(3): 559-564.
[36]CHEN F, LI J, WANG H, et al. Anti-tumor effects of chinese medicine compounds by regulating immune cells in microenvironment[J]. Frontiers in Oncology, 2021, 11: 746917.
(責任编辑:编辑唐慧)
收稿日期:中文收稿日期2023-03-17
基金项目:国家自然基金项目(81760570),中国医学科学院中央级公益性科研院所基本科研业务费专项(2020-PT330-003),新疆生产建设兵团促进科技成果转化引导计划项目(2021BB006),新疆生产建设兵团中青年领军人才项目(2018CB017)
作者简介:杜云峰(1997—),男,硕士研究生,专业方向为普通外科疾病研究。
*通信作者:吴向未(1973—),男,教授,博士生导师,从事肝胆外科良恶性疾病的临床与基础研究,e-mail: wxwshz@126.com。

