探究阿苯达唑对猪带绦虫糖原的影响
吴专丽 冶鹏辉 周雪雁
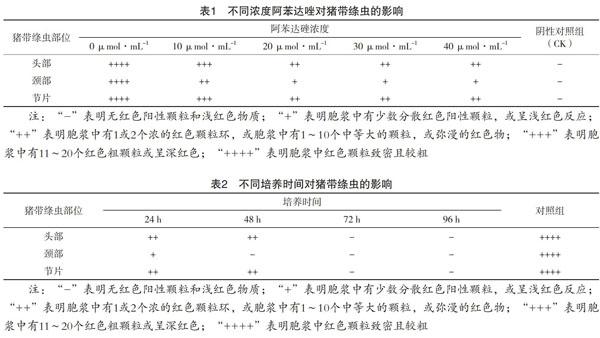
摘 要 为探究阿苯达唑对体外培养的猪带绦虫不同部位(头部、颈部、节片)的糖原作用效果,分别制备浓度为0 μmol·mL-1、10 μmol·mL-1、20 μmol·mL-1、30 μmol·mL-1、40 μmol·mL-1的阿苯达唑溶液,并加入等量含营养液的生理盐水,在此条件下各培养24 h、48 h、72 h、96 h,最后采用石蜡切片法制片、染色,观察猪带绦虫糖原在头部、颈部、节片的情况。结果表明:阿苯达?破坏猪带绦虫的最佳浓度为20 μmol·mL-1,且随着时间的延长,糖原可被完全破坏。此外,颈部糖原减少最明显,说明阿苯达?对颈部糖原破坏最大。
关键词 阿苯达唑;猪带绦虫;糖原
中图分类号:S858.28 文献标志码:B DOI:10.19415/j.cnki.1673-890x.2019.17.074
猪带绦虫病或称为囊尾蚴病综合征是一种由人类寄生虫引起的人畜共患病。猪囊尾蚴主要存活在猪的横纹肌内,尤其是肩部、颈部、腹部、腿部的肌肉中寄生的情况较为多见,同时还会在心脏、大脑等部位寄生,成虫猪带绦虫则寄生在人体小肠内,虫体为白色半透明带状[1]。猪带绦虫病是一种容易被忽视的疾病,给非洲、亚洲和拉丁美洲的发展中国家带来了较为严重的公共卫生和经济负担。基于此,探究阿苯达唑对猪带绦虫糖原的作用,以便于更好治疗猪带绦虫病。
1 材料与方法
1.1 材料与试剂
新鲜米猪肉,生理盐水,阿苯达唑,Hanks培养液,小牛血清,链霉素,青霉素,石蜡,糖原PAS染色剂(过碘酸、20 g·L-1甲基绿、醋酸钠-吡啶、Schiff氏液等),75%乙醇溶液,石蜡。
1.2 仪器与设备
恒温培养箱,上海一恒科学仪器有限公司;显微镜,奥林巴斯CX21;石蜡切片机
1.3 实验方法
从各肉制品加工厂、农贸市场挑选疑似含有囊尾蚴的新鲜肉品,此肉一般颜色较暗淡不鲜亮,瘦肉中呈黄豆样大小、乳白色半透明水泡[2]。购入后挑选充满透明囊液的大小类似、生长状况类似的囊尾蚴,以保证将实验过程中因绦虫个体差异引起的实验误差降到最低。
将收集到的猪囊尾蚴置于37 ℃生理盐水中轻轻地反复清理3~4次,然后用含40%猪胆汁的生理盐水置于42 ℃恒温培养箱内孵育至绦虫虫体头颈部孵出。然后选择生命力强且形态大小类似的虫体在37 ℃的生理盐水中漂洗2~3次。
配取浓度分别为0 μmol·mL-1、10 μmol·mL-1、20 μmol·mL-1、30 μmol·mL-1、40 μmol·mL-1的阿苯达唑溶液5 mL,分别置于5个直径为15 cm的平皿中,各加入2条猪带绦虫,再均加入Hanks培养液20 mL、小牛血清10 mL,为防止细菌对猪带绦虫生长造成影响,可在营养液中加入100 U·mL-1青霉素以及100 μg·mL-1链霉素。标号后置于39 ℃恒温培养箱中培养,并每12 h更换一次营养液,培养48 h后,观察比较不同浓度下各组猪带绦虫虫体头部、颈部和节片三部分糖原的情况,并设置阴性对照组即用醋酸酐-吡啶消化组织中的糖原。
采用对糖原影响最小的阿苯达唑浓度,取四个直径为15 cm的平皿各加入3条猪带绦虫,再加入Hanks培养液20 mL、小牛血清10 mL,为防止细菌对猪带绦虫生长造成影响,可在营养液中加入100 U·mL-1青霉素,100 μg·mL-1链霉素。标号后置于39 ℃恒温培养箱中培养,分别培养24 h、48 h、72 h、96 h,并每12 h更换一次营养液,达到各自培养时间后,观察各组猪带绦虫虫体各部分糖原的情况,并设置无阿苯达唑培养的对照组观察此组绦虫各部分糖原情况。
取出各组处理的囊尾蚴,在普通固定液中浸泡约10 min后取出,经脱水透明处理后开始浸蜡包埋,使用切片机切成厚度约20 μm的切片并编号标出头节、颈节、节片,然后附着于载玻片上烤干,最后进行脱蜡,制成切片[3]。进而使用PAS染色法进行染色[4],水洗数次后滴加过碘酸于涂片上,静置10 min后冲洗2~3次,然后浸入Schiff氏液30 min后取出冲洗,并用20 g·L-1甲基绿复染15 min即完成染色,镜下观察各组绦虫虫体各部分糖原变化。为了减少制片染色过程中糖原的损失,用0.5%火棉胶保护组织[5],冲洗过程应当缓慢轻柔或在静水中漂洗2次。
2 结果与分析
2.1 不同浓度阿苯达唑对猪带绦虫的影响结果
不同浓度阿苯达唑对猪带绦虫的影响结果如表1所示。结果表明,10 μmol·mL-1阿苯达唑对糖原作用不够明显,且随阿苯达唑浓度的增加则对猪带绦虫囊尾蚴中糖原的破壞也增加,且分别观察各组中头部、颈部、节片中糖原情况可发现,颈部糖原受破坏较严重。当无阿苯达唑作用时猪带绦虫各部分组织胞浆中红色颗粒均较多且粗大,少部分甚至呈现紫红色,此外也表现为颈部红色区域最多且颜色相对最深。实验结果显示,阿苯达唑浓度为20 μmol·mL-1、30 μmol·mL-1和40 μmol·mL-1作用的绦虫组织胞浆中有1个或2个红色颗粒环,有的则呈现弥漫红色物,表明这三个浓度在时间为48 h内的作用效果相似,推测造成此情况的原因有药物作用时间不足导致高浓度阿苯达唑并未完全发挥其作用,也可能是因为此药物对猪带绦虫的作用已达到最大。
2.2 不同培养时间对猪带绦虫的影响结果
不同培养时间对猪带绦虫的影响结果见表2。采用20%浓度阿苯达唑进行此实验,结果表明培养24 h和48 h的绦虫胞浆中有1~2个红色大颗粒或10个以下中等大的颗粒,有的则呈现弥漫状态的红色物,表明糖原含量较少。作用72h者和作用96 h者则无红色阳性颗粒和浅红色物质存在,表明无糖原存在或偶然造成糖原损失,应当重复进行试验。比较各组猪带绦虫头部、颈部、节片可发现,颈部红色区域相对较少,对照无药物作用的绦虫颈部糖原含量较多,可知此处受阿苯达唑破坏较严重。此外,随着培养时间的延长,阿苯达唑对糖原的破坏作用也加强直至完全破坏。
3 结论与讨论
阿苯达?破坏猪带绦虫的最佳浓度为20 μmol·mL-1,且随着时间的延长糖原可被完全破坏。此外,颈部糖原减少最明显,说明阿苯达?对颈部糖原破坏最大,推测造成这一作用特点的原因是颈部为新节片产生的部位,新陈代谢旺盛,糖原产生较多。
参考文献:
[1] 高学军,李庆章,刘永洁,等.奥芬达唑和阿苯达唑对猪囊尾蚴作用形态学比较观察[J].中国兽药杂志,2004(8):9-12.
[2] 陈兆浚,牛安欧,周梓林.阿苯达唑对猪囊尾蚴糖原作用的观察[J].中国寄生虫学与寄生虫病杂志,1988(S1):114.
[3] 郝艳红,李庆章,刘永洁,等.药物对猪囊尾蚴体外作用的比较研究[J].黑龙江畜牧兽医,2000(2):19.
[4] 黄琼华.上杭县猪囊尾蚴病的流行病学和防治调查[D].福州:福建农林大学,2016.
[5] 史大中,刘德山.吡喹酮对囊尾蚴糖原和碱性磷酸酶作用的观察[J].兰州医学院学报,1983(1):12-16.
(责任编辑:刘昀)

