关节腔注射用雷公藤甲素微球组织分布与代谢*
王丽娟,车坷科,张稳稳,丁永良,姜理华
(1.重庆医药高等专科学校药学院,重庆药物制剂工程研究中心,重庆 401331;2.重庆市人民医院药学部,重庆 400014)
类风湿关节炎(rheumatoid arthritis,RA)是一种发病率高、致残率高、严重影响患者生活质量的慢性全身性自身免疫性疾病,以关节病变引起肢体严重畸形,关节滑膜炎及浆膜、心肺、皮肤、眼、血管等结缔组织广泛性炎症为主要表现,目前认为RA中关节软骨和骨组织的损害主要由滑膜细胞活化和增生所致[1-2]。雷公藤甲素(triptolide,TPL)是雷公藤主要活性成分之一,低浓度即可抑制滑膜细胞增生,并诱导成纤维滑膜细胞凋亡[3]。虽然雷公藤中药制剂取得了较好的临床效果,但毒副作用较多,如胃肠道刺激、生殖系统毒性、皮肤黏膜反应、肝毒性、心律失常、急性中毒等。基于TPL疗效好但毒副作用大的特点,笔者所在课题组前期设计并制备了缓释性能良好的关节腔内注射用TPL微球(TPL microspheres for intra-articular injection,TPL-MS)用于治疗RA,该微球可将药物直接输送至受累关节,避开药物体内转运中的生理屏障,避免或减轻全身不良反应,延长药物在关节内的维持时间,以较小的剂量发挥最大药效,但其体内分布与代谢等问题仍有待明确。TPL主要通过细胞色素P450酶(cytochrome P450,CYP450)代谢消除,是TPL的主要解毒途径之一,肝脏对TPL的代谢能力与其肝毒性有关[4-6]。笔者在本实验采用超高效液相色谱-串联质谱(ultra performance liquid chromatography-tandem mass spectro-metry,UPLC-MS/MS)法及高分辨质谱法,考察TPL-MS在大鼠的组织分布和体内外代谢行为,并对可能存在的代谢产物种类进行分析,以期为其应用奠定基础。
1 材料与方法
1.1实验动物 SD大鼠,雌雄不限,平均体质量(200±20)g,由重庆医科大学实验动物中心提供,实验动物生产许可证号:SCXK(渝)2018-0003,实验动物使用许可证号:SYXK(渝)2018-0003。给药前自由进食饮水,标准饲养条件饲养[温度(25±1)℃,相对湿度(60±10)%,12 h光照和12 h黑暗交替,标准饲料],动物实验方案经重庆医药高等专科学校学术伦理委员会批准。
1.2药品与试剂 TPL对照品(中国食品药品检定研究院,纯度:98.5%,批号:201804),TPL-MS(重庆医药高等专科学校制剂工程中心实验室自制,批号:20200927),还原型烟酰胺腺嘌呤二核苷酸磷酸[nicotinamide adenine dinucleotide phosphate,NADPH,中科瑞泰(北京)生物科技有限公司,批号:20200501],混合雄性大鼠肝微粒体[肝脏疾病研究(上海)有限公司,20 g·L-1,批号:20200625],甲醇、乙腈、甲酸铵、甲酸为色谱纯,其他试剂均为分析纯。盐酸普萘洛尔对照品(propranolol hydrochloride,IS,中国食品药品检定研究院,纯度:99%,批号:201809)。
1.3仪器 AR2140电子分析天平(瑞士METTLER TOLEDO公司,感量:0.1 mg),Milli-Q Biocel A-10纯水机(Millipore公司),ZNCL-GS恒温水浴磁力搅拌器(河南爱博特科技发展有限公司),AvantiJ-26XP高速冷冻离心机(美国Beckman公司),Coolsafe110-4pro型冷冻干燥机(丹麦Labogene-Scanvac),Agilent 1290 Infinity II超高效液相色谱仪(美国Agilent公司,配二元泵、柱温箱、自动进样器、DAD检测器),Agilent 6460三重四级杆LC/MS(美国Agilent公司),DCY-16S型氮吹仪(昆山广测仪器设备有限公司),FSH-2型组织匀浆机(江苏省金坛市宏华仪器厂),GL-88B型旋涡混合器(山东良辰仪器设备有限公司),DW86L628海尔低温冰箱(海尔集团)。
1.4TPL含量测定方法
1.4.1色谱条件 Agilent ZORBAX SB-C18色谱柱(2.1 mm×100 mm,1.8 μm),流动相A:5 mmol·L-1甲酸铵溶液(含0.1%甲酸),流动相B:纯乙腈,梯度洗脱程序:30%B(0~3.7 min),95%B(4.0 min),95%B(4.0~10.0 min),30%B(10.1 min),30%B(10.1~15 min),流速0.4 mL·min-1,柱温40 ℃,进样量2 μL。
1.4.2质谱条件 电喷雾离子源(electron spray ionization,ESI),正离子检测,扫描方式多反应监测(multiple reaction monitoring,MRM),离子源温度350 ℃,毛细管电压4 000 V,干燥气流速10 L·min-1,雾化气压力241.3 kPa(35 psi),TPL检测离子对m/z378.1/361.0,内标IS检测离子对m/z260.0/116.2。
1.4.3UPLC-MS/MS方法学考察 专属性:将加入TPL和内标后的心、肝、脾、肺、肾、血浆、关节等组织处理后进样,观察杂质与TPL分离情况。肝微粒体酶样品同法操作。
检测限和定量限:将各组织或肝微粒体酶样品分别逐级稀释至一系列浓度,依次进样,以信噪比S/N=3:1计算检测限,以信噪比S/N=10:1计算定量限。
线性关系考察:配制系列浓度TPL对照品溶液,精密量取对照品溶液100 μL,加入空白组织匀浆,配制成系列浓度标准生物样品,处理后进样。以TPL峰面积与IS峰面积比值(Y)和药物质量浓度(X)进行线性回归。肝微粒体酶样品同法操作,但高浓度设置与其他生物样品不同。
相对回收率:配制低、中、高浓度TPL标准生物样品,处理后进样。根据回归方程计算理论浓度,以理论浓度与实际浓度之比计算相对回收率。
精密度和稳定性:配制低、中、高浓度TPL标准生物样品,处理后进样,每天进样5次,计算日内精密度;连续进样5 d,计算日间精密度;室温放置8 h后进样,考察室温下稳定性;样品经3次反复冻融,处理后进样,考察冻融稳定性。
基质效应:取空白组织或血浆,处理后加入TPL与内标,形成低、中、高浓度溶液,测定TPL与内标峰面积比值(A),另用流动相配制上述3种浓度溶液,测定TPL与内标峰面积比值(B),基质效应(%)=A/B×100%。
1.5高分辨质谱测定代谢产物种类方法 采用配备二元泵、在线真空脱气机、自动进样器、控温箱和二级阵列检测器的UPLC对原药及代谢物进行分离,采用高分辨质谱(HESI检测器的thermo Q-exactive质谱仪)测定TPL微球在肝微粒体、肝脏和胆汁中代谢物的准确分子量。C18色谱柱(2.1 mm×100 mm,2.2 μm),流动相条件为0.1%甲酸(10%)和乙腈(90%)等度洗脱。柱温30 ℃,流速0.2 mL·min-1,进样体积100 μL。质谱扫描模式为全扫描,母离子扫描范围为m/z50至m/z750。质谱条件具体如下:毛细管电压3 800 V,毛细管温度320 ℃,雾化气氮气压力275.8 kPa(40 psi),离子源温度350 ℃,Thermo Xcalibur Qual Browser软件控制仪器和进行数据分析。因代谢物类型不做定量检测,因此只需要排除内源性物质干扰,不进行方法学考察。
1.6体外代谢实验方案
1.6.1肝匀浆及肝微粒体中TPL的代谢百分比 实验分为TPL溶液组(TPL-IN,含8%丙二醇)和TPL-MS组[TPL-MS,微球经质谱测定载药量为(1.82±0.16)%],每组分别做肝匀浆和肝微粒体酶实验。
取健康SD大鼠,处死后手术取出肝组织(4 ℃下操作),置冰袋上,用眼科剪剪碎,pH值7.4磷酸缓冲液(phosphate buffered saline,PBS)洗去组织内血液,滤纸吸干,无菌下称重,按1:4比例加入上述PBS,组织匀浆机制成肝匀浆,测定匀浆液蛋白质浓度(g·L-1)。体外代谢孵育体系总体积250 μL,包括PBS、TPL-IN或TPL-MS(TPL终浓度均为50 μmol·L-1)、肝微粒体(或上述肝匀浆)、NADPH,肝微粒体组和肝匀浆组各设平行样品3个,蛋白浓度均为1.0 g·L-1。将肝微粒体(或肝匀浆)与TPL-IN(或TPL-MS)的混合溶液、NADPH分别在37 ℃预孵育5 min,将后者加入微球混合溶液中启动反应,并继续在37 ℃恒温振荡器继续孵育,于 5、15、30、45、60和120 min从孵育体系中取样40 μL,加入含内标(终浓度25 ng·L-1)的冰乙腈400 μL终止反应。样品涡旋振荡 1 min,15 000 r·min-1离心10 min(r=32.5 cm),取上清液检测剩余TPL浓度。同时实验平行设置不加NADPH的空白对照组、零时反应组和加入咪达唑仑的阳性对照组。根据浓度计算不同时间点时剩余TPL的峰面积与初始峰面积比值,以百分含量表示肝匀浆和肝微粒体孵育液中未代谢TPL占初始TPL量的百分比(%)。
1.6.2肝匀浆及肝微粒体中TPL代谢产物种类 取肝匀浆(或肝微粒体),稀释到蛋白质浓度1.0 g·L-1,加TPL-IN或TPL-MS(TPL终浓度50 μmol·L-1),再加NADPH溶液,最终使孵育体系总体积250 μL,37 ℃水浴振荡培养。所有孵育体系分别于30 min加入含内标(终浓度25 ng·L-1)的冰乙腈400 μL终止反应。样品涡旋振荡 1 min,15 000 r·min-1(r=32.5 cm)离心10 min,取上清液适当浓缩后检测可能存在的代谢产物。
1.7体内代谢实验方案 将12只SD大鼠称重后分为2组,每组6只,第一组关节腔注射TPL-MS(剂量10 mg·kg-1,按微球实际载药量折算制剂质量),第二组关节腔注射TPL-IN(剂量10 mg·kg-1)。每组取3只收集0-8、8-16、16-24 h粪便和尿液,粪便晾干后研磨混匀,尿液可根据总量多少适当浓缩,不做其他预处理;另外3只于1 h处死,取肝组织,用pH值7.4PBS洗净血液,擦干水分,-80 ℃冰箱内冻存,同时剥离并剪破胆囊,取胆汁-80 ℃冰箱内冻存。取粪便加4%牛血清白蛋白溶液(1:4,m/V),制成粪便匀浆,乙酸乙酯提取(提取2次,合并提取液),提取液用40 ℃氮气吹干,500 μL甲醇超声提取10 min,15 000 r·min-1(r=32.5 cm)离心5 min,取上清液检测代谢物。取胆汁加乙酸乙酯提取(提取2次,合并提取液),提取液用40 ℃氮气吹干,500 μL甲醇超声提取10 min,15 000 r·min-1(r=32.5 cm)离心5 min,取上清液检测代谢物。尿液处理方法同胆汁。取肝组织,用眼科剪剪成匀浆,取匀浆2.0 g,用乙酸乙酯提取(提取2次,合并提取液),提取液用40 ℃氮气吹干,500 μL超声提取10 min,15 000 r·min-1(r=32.5 cm)离心5 min,取上清液检测代谢物。对不同时间段(0-8、8-16和16-24 h)粪便和尿液中原药和代谢物检出情况进行分析。
1.8组织分布测定 取SD大鼠54只,称重后随机分成2组: TPL-MS关节腔给药组(A组,TPL-MS 10 mg·kg-1,按载药量折算成微球质量);TPL-IN关节腔给药组(B组,TPL-IN10 mg·kg-1)。A组于给药后30 min、2 h、8 h、1 d、2 d、3 d、5 d、8 d、12 d取心、肝、脾、肺、肾、给药侧关节等组织(每个时间点处死3只)和全血(交叉取血,每个时间点取3只);B组于给药后15 min、30 min、1 h、2 h、4 h、8 h、12 h、1 d、2 d取心、肝、脾、肺、肾、给药侧关节等组织(每个时间点处死3只)和全血(交叉取血,每个时间点取3只)。取全血,12 000 r·min-1(r=50.8 cm)离心10 min,分离血浆。给药侧关节取出后,用PBS冲洗,擦干,取全部软骨滑膜组织,称重。其他组织用pH值7.4PBS洗净血液,擦干,称重。以上血浆和各组织均于-80 ℃冰箱内保存。测试前室温下解冻,取组织0.1 g(或血浆200 μL),加内标溶液(100 μg·mL-1)50 μL,乙酸乙酯共3 mL分2次涡旋提取TPL,合并提取液后离心[12 000 r·min-1(r=50.8 cm),10 min],取上清液氮气吹干(40 ℃),甲醇200 μL复溶,用孔径0.22 μm滤头过滤后进样。以内标法计算各组织中TPL浓度(ng·g-1或ng·mL-1)。必要时将样品适当稀释后进样,保证浓度在线性范围内。
2 结果
2.1UPLC-MS/MS方法学考察结果 大鼠各组织、血浆、肝微粒体质谱图见图1,内源性物质不干扰测定,TPL峰(保留时间约3.1 min)和内标IS峰(保留时间约2.4 min),分离度R>1.5。检测限0.3 ng·mL-1,定量限3 ng·mL-1。各组织标准曲线及线性范围结果见表1。相对回收率≥87%。日内精密度RSD≤4.69%,日间精密度RSD≤6.14%。室温放置8 h稳定性RSD≤4.72%,3次反复冻融后稳定性RSD≤4.12%。基质效应≥92.8%。
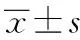
表1 大鼠组织、器官中TPL标准曲线Tab.1 Standard curves of TPL in rat tissues and organ

A.心;B.肝;C.脾;D.肺;E.肾;F.血浆;G.关节;H.肝微粒体。图1 大鼠各组织及肝微粒体加入TPL与IS后的UPLC-MS/MS色谱图 A.heart;B.liver;C.spleen;D.lung;E.kidney;F.plasma;G.joint tissues;H.liver microsome.Fig.1 UPLC-MS/MS chromatograms of TPL and IS in rat tissues and liver microsome
2.2体外代谢百分比 肝匀浆及肝微粒体TPL代谢百分比结果见表2。由表2可知,2种制剂在肝匀浆和肝微粒体中随着时间延长不断被代谢,30 min时TPL-IN在肝匀浆和肝微粒体中分别下降50.32%和49.47%,TPL-MS在肝匀浆和肝微粒体中分别下降47.62%和46.39%,2种制剂体外代谢规律基本一致,差异无统计学意义。

表2 2种制剂在大鼠肝匀浆与肝微粒体中代谢百分比Tab.2 The percentage of TPL metabolism in rat liver homogenate and liver microsome
2.3体内外代谢物种类分析 体内外代谢研究中共观察到TPL原药及其4种代谢物,质荷比分别为m/z361.1646(原药,[M+H]),m/z377.159 5(代谢物,[M1+H]),m/z377.159 5(代谢物,[M2+H]),m/z391.138 7(代谢物,[M3+H])和m/z391.138 7(代谢物,[M4+H]),保留时间分别是11.4~11.7,7.9~8.4,10.0~10.4,3.4~4.3和7.1~8.2 min,代谢物保留时间均早于原药,可能由于代谢物主要是羟基化产物,极性较原药大。M-M4的提取离子流图谱和二级质谱图见图2。实验发现,TPL可以转化为m/z359.148 9(TPL,[M-H]);M1和M2除了有[M1/M2+H]峰外,均可以转化为m/z375.143 8(代谢物脱氢,[M1/M2-H]);M3和M4除了有[M3/M4+H]峰外,均可以转化为m/z389.124 4(代谢物脱氢,[M3/M4-H])。这可能由全离子扫描模式造成,因此需要结合保留时间进行评价,以验证是否为代谢物。
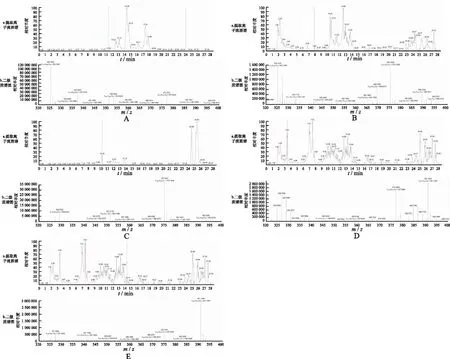
A.TPL;B.M1;C.M2;D.M3;E.M4。图2 TPL及其代谢物M1-M4提取离子流与二级质谱图 A.TPL;B.M1;C.M2;D.M3;E.M4.Fig.2 Extraction ion flow diagrams and secondary mass spectrograms of TPL and its metabolites M1-M4
TPL-IN与TPL-MS在肝匀浆、肝微粒体、体内肝脏、胆汁、粪便和尿液中的具体代谢物种类分布结果见表3。由表3可知,大鼠体内肝脏发现原药及代谢物3种,M4未发现;胆汁中仅发现原药与M2,可能由于浓度较低;尿液中发现原药及代谢物M1、M2和M3,粪便中发现原药及单羟基代谢物M1与M2。TPL-IN与TPL-MS代谢产物结果显示,2种剂型代谢途径和代谢物种类相似,剂型变化未改变TPL代谢途径和代谢物种类。
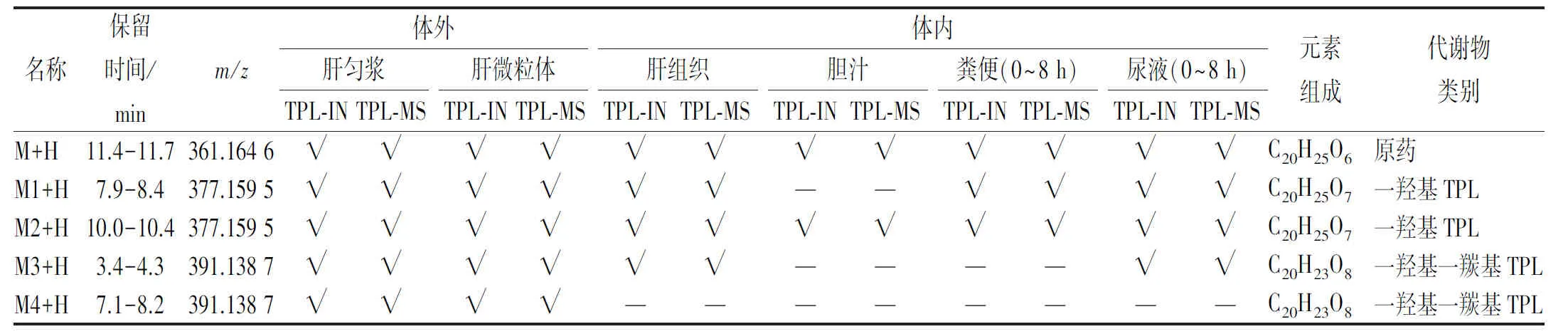
表3 TPL-IN与TPL-MS在体内外的代谢物Tab.3 Metabolites of TPL-IN and TPL-MS in vivo and in vitro
2.4体内代谢速度分析 大鼠粪便及尿液代谢物检出情况见表4。结果显示,TPL经肝脏代谢后主要经尿液排出,TPL-IN组主要代谢时间集中在给药后8 h,8-16和16-24 h代谢物基本检测不出来,TPL-MS组可在0-8、8-16和16-24 h尿液中持续检出代谢物,表明TPL-MS改变了体内释放速度。
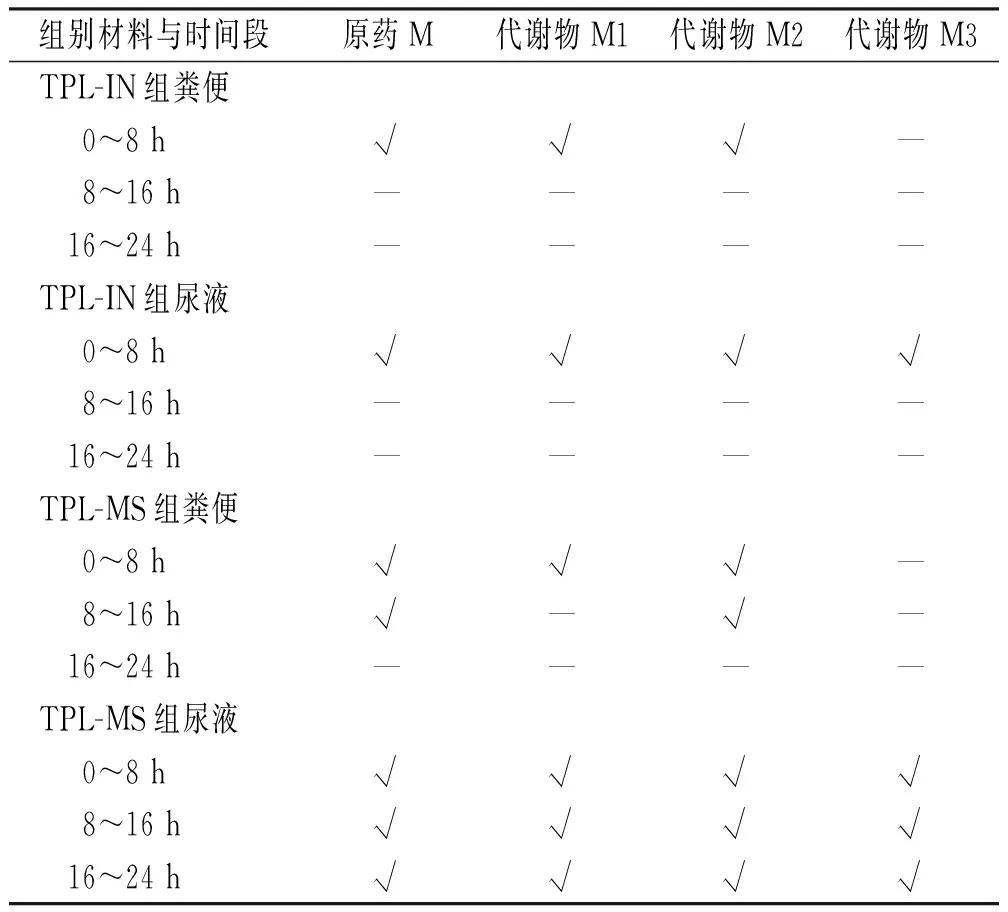
表4 大鼠粪便及尿液中TPL原药及代谢产物在不同时间段检出情况Tab.4 Detection of TPL and its metabolites in feces and urine of rats at different time periods
2.5体内组织分布情况 各组数据结果见表5。结果显示,关节腔注射给药后,关节组织药物浓度均较血浆及其他组织高,说明关节腔给药有一定局部靶向作用。但与TPL-IN组相比,TPL-MS组TPL在关节组织滞留时间更持久,第3天达到最高浓度[(243.79±14.12)ng·g-1],在关节组织内维持时间近2周,长时间缓释作用更强。而TPL-IN组注射后即刻达到最高浓度[15 min关节组织浓度(278.29±12.65)ng·g-1],此后逐渐下降,48 h后TPL浓度很低。除关节外的其他组织(心、肝、脾、肺、肾、血浆),TPL-MS组也是在第3天才达到最高浓度。从各组织内最高点药物浓度数据看,TPL-MS组较TPL-IN组有所降低,TPL-MS组心、肝、脾、肺、肾、血浆最高药物浓度为(20.08±1.17)、(23.39±1.97)、(23.65±1.76)、(18.78±1.32)、(16.81±1.67) ng·g-1和(18.86±1.47)ng·mL-1;TPL-IN组分别为(29.65±1.59)、(34.12±2.57)、(28.37±2.75)、(26.49±3.21)、(30.39±2.81) ng·g-1和(21.03±1.86)ng·mL-1。TPL被制备成微球后,能较长时间停留在关节组织,进一步减少关节腔给药次数,降低除关节之外其他组织血药浓度峰值,缓释效果较溶液剂型有明显提高,有利于药物发挥治疗效果,且降低全身毒副作用。
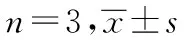
表5 关节腔注射TPL-MS或TPL-IN后TPL在组织中的分布Tab.5 Distribution of TPL in tissues following intra-articular administration of TPL-MS or TPL-IN
3 讨论
笔者所在课题组制备的TPL-MS形态圆整[7-8],大小均一,平均粒径约5 μm,平均载药量约2%,体外释放研究显示TPL-MS第1天处于突释阶段,累积释放率超过30%,此后进入缓释阶段,到第10天总累积释放率超过60%。笔者在本实验采用的TPL-MS平均粒径4.75 μm,载药量(1.82±0.16)%。
文献报道TPL在大鼠和人体内的主要代谢物是单羟基和双羟基代谢物[9-10]。本研究发现4种代谢物,其中M1和M2是单羟基TPL代谢物,可能是一对同分异构体,M3和M4是TPL的单羟基和单羰基代谢物,也可能是一对同分异构体。体外肝匀浆和肝微粒体酶中发现了原药及其4种代谢物M1-M4,较体内发现的代谢物种类(M1-M3)多,可能由于代谢产物在体外孵育体系中不断蓄积,浓度较高。而体内代谢是一个连续的过程,代谢产物随尿液和粪便不断排出体外,含量较低。与文献报道的代谢物类型相比,笔者在本实验并没有检测到新的代谢物;TPL-MS与TPL-IN相比,代谢物种类一致。说明使用TPL-MS不会引入新代谢物,安全性较好。
组织分布结果显示,关节腔注射微球剂型和溶液剂型后呈现完全不同的分布行为。在关节组织中,TPL-IN组在15 min即达最高浓度,2 d后TPL从关节腔内完全消除,说明溶液剂型在关节腔内滞留时间有限;TPL-MS组达峰浓度出现在给药后第3天,直至第12天仍有释放,说明微球剂型在关节腔内形成了药物储库,逐渐释放药物。从心、肝、脾、肺、肾和血浆的数据看,TPL-MS组在各监测点的浓度较TPL-IN组均有不同程度降低,说明长期用药时微球能降低药物在非靶器官的积累,减少毒副作用。
研究表明,TPL剂量越大毒性越大[11],改变剂型和给药方式是重要的减毒手段之一,如TPL自乳化给药系统[12]可减轻肝脏毒性;TPL肾靶向纳米粒[13]可减轻肝毒性、生殖毒性和免疫毒性。笔者在本实验中将TPL制成TPL-MS,并采用UPLC联合高分辨质谱[14]对不同时间段粪便和尿液中原药和代谢物的出现时间、离子丰度进行比较分析。结果显示,TPL-IN组代谢物浓度在0~8 h达到峰浓度,而TPL-MS组代谢物浓度在16~24 h达到峰浓度,表明TPL被包裹成微球进行关节腔注射后,在肝脏被代谢转化的时间被延迟,间接证实TPL-MS可延缓药物体内释放过程,扩大TPL治疗窗,改善用药安全问题,这与组织分布测得的结果一致。
综上所述,TPL-IN与TPL-MS 2种制剂在肝匀浆和肝微粒体孵育实验中,含量均随着时间延长而显著降低,两者体外代谢规律基本一致。在体内外代谢研究中共寻找到TPL原药及其4种代谢物,2种制剂代谢途径和代谢物种类相似,但代谢速度有差异。TPL-MS在关节腔内滞留时间较溶液制剂长,微球对药物的包裹能明显延缓药物在体内分布和代谢行为,证实了TPL-MS在临床实践中延长药物释放的可行性。

