神经内镜辅助颅底显微神经外科手术对原发性脑肿瘤患者神经功能及日常生活能力的影响
唐文海
(单县中心医院神经外科,山东菏泽 274000)
原发性脑肿瘤即原发于中枢神经系统的肿瘤,包括胶质瘤、脑膜瘤等,大部分为良性肿瘤,以恶心、头痛、视力改变等为主要症状[1]。 现阶段,临床针对原发性脑肿瘤患者主要采用手术治疗,其中颅底显微神经外科手术是较为常用的术式,具有微创、手术时间短的特点,可在较小的视角下完成手术,促进患者病情改善。 但由于脑部是人体最为重要的器官之一,对手术操作的精度要求极高, 而显微手术视野不够开阔,易造成脑肿瘤切除不彻底,引起病情复发[2]。神经内镜是微创神经外科的重要组成部分, 可与显微镜相结合,在直视条件下对脑肿瘤进行有效切除,且损伤小、疗效佳[3]。基于此,本研究选取2020年7月—2022年7月单县中心医院收治的88 例原发性脑肿瘤患者为对象,探究神经内镜辅助颅底显微神经外科手术治疗的效果。 报道如下。
1 资料与方法
1.1 一般资料
选取单县中心医院收治的88 例原发性脑肿瘤患者为研究对象。 纳入标准:出现头痛、耳鸣、呕吐及脑神经麻痹等症状,经CT 及MRI 检查确诊为原发性脑肿瘤;符合手术指征;患者或家属知情同意。 排除标准:既往有脑外伤行开颅手术治疗者;合并其他脑部疾病或其他肿瘤者;对麻醉药物过敏者。 本研究经单县中心医院医学伦理委员会审批。按患者选择的手术方式将其分为两组, 每组44 例。 对照组男20 例,女24 例;年龄28~72 岁,平均年龄(50.26±9.56)岁;病程4 个月~5年,平均病程(2.68±1.05)年;肿瘤直径2~6 cm,平均直径(3.56±0.71)cm;疾病类型:神经胶质瘤15 例,脑膜瘤10 例,垂体腺瘤11 例,室管膜瘤8 例;肿瘤性质:良性23 例,恶性21 例。观察组男22 例,女22 例;年龄28~73 岁,平均年龄(50.56±11.02)岁;病程6 个月~5年,平均病程(2.76±1.05)年;肿瘤直径2~5 cm,平均直径(3.58±0.68)cm;疾病类型:神经胶质瘤21 例,脑膜瘤13 例,垂体腺瘤6 例,室管膜瘤4例;肿瘤性质:良性24 例,恶性20 例。 两组患者的各项一般资料比较,组间差异无统计学意义(P>0.05)。
1.2 方法
对照组行颅底显微神经外科手术。对患者进行全身麻醉,以颅底作为手术切口,在显微镜下分离肿瘤组织,并对肿瘤进行切除,然后逐层缝合,同时进行抗感染治疗。
观察组行神经内镜辅助颅底显微神经外科手术。依据患者肿瘤部位及影像学检查资料合理选择手术入路,对患者进行全身麻醉,骨瓣开颅,对肿瘤体积较小、范围较窄者采用后颅窝中线直切口,对肿瘤体积较小但累及范围较广者采用联合入路,鞍区肿瘤入路点翼点。在显微镜直视下,将肿瘤囊液吸净,置入神经内镜,对肿瘤周围及其背部进行认真观察,并在神经内镜的引导下电凝肿瘤内部,将肿瘤包膜、瘤结节进行细致分离,确保肿瘤周围有充足的空间;之后再次置入神经内镜,观察显微镜下的死角,之后对肿瘤进行切除, 继续使用神经内镜查看直至肿瘤完全切除,术后采用缓冲生理盐水(北京天坛生物制品股份有限公司,国药准字S10870001,规格:1.5 mL/支)持续清洗瘤床,确保无瘤内容物残留,最后逐层缝合,关闭颅骨。
两组术后均行MRI 增强扫描, 判断手术肿瘤切除程度及有无术后残留,并持续随访6 个月。
1.3 观察指标
(1)肿瘤切除情况:分为完全切除、大部分切除。(2)临床相关指标:包括手术时间、住院时间及术中出血量。 (3)神经功能及日常生活能力:治疗前及治疗6个月后,采用美国国立卫生研究院卒中量表(NIHSS)评价患者的神经功能,总分42 分,评分越低,神经功能越好;治疗前及治疗6 个月后,采用日常生活能力评定量表(ADL)评价患者的日常生活能力,总分100分,评分越高,日常生活能力越好。 (4)并发症发生率及复发率:并发症包括伤口感染、出血等。
1.4 统计方法
采用SPSS 20.0 统计学软件进行数据分析。 肿瘤完全切除率等计数资料用[n(%)]表示,采用χ2检验;手术时间等计量资料用(±s)表示,采用t 检验。P<0.05 为差异有统计学意义。
2 结果
2.1 两组肿瘤切除情况比较
观察组的肿瘤完全切除率高于对照组,差异有统计学意义(P<0.05)。 见表1。
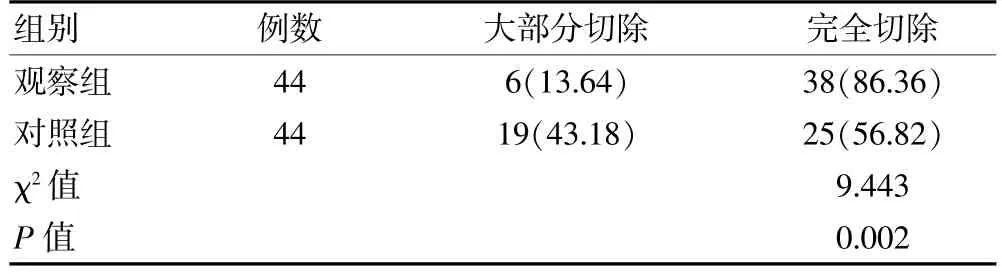
表1 两组原发性脑肿瘤患者肿瘤切除情况比较[n(%)]
2.2 两组临床相关指标比较
观察组的手术时间、住院时间均短于对照组,术中出血量少于对照组,组间差异有统计学意义(P<0.05)。见表2。
表2 两组原发性脑肿瘤患者临床相关指标比较(±s)
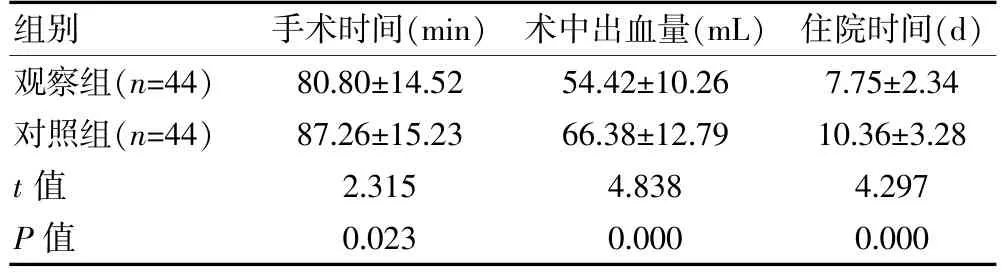
表2 两组原发性脑肿瘤患者临床相关指标比较(±s)
组别手术时间(min)术中出血量(mL) 住院时间(d)观察组(n=44)对照组(n=44)t 值P 值80.80±14.52 87.26±15.23 2.315 0.023 54.42±10.26 66.38±12.79 4.838 0.000 7.75±2.34 10.36±3.28 4.297 0.000
2.3 两组神经功能及日常生活能力比较
治疗前, 两组的NIHSS 评分及ADL 评分比较,组间差异无统计学意义(P>0.05);治疗6 个月后,两组的各项评分均改善,且观察组的NIHSS 评分低于对照组,ADL 评分高于对照组,差异有统计学意义(P<0.05)。 见表3。
表3 两组原发性脑肿瘤患者干预前后NIHSS 评分及ADL 评分比较[(±s),分]
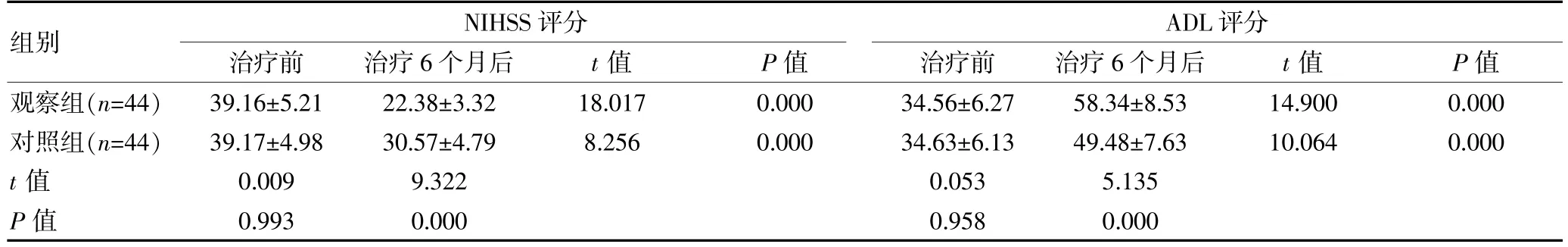
表3 两组原发性脑肿瘤患者干预前后NIHSS 评分及ADL 评分比较[(±s),分]
组别NIHSS 评分治疗前治疗6 个月后t 值P 值ADL 评分治疗前治疗6 个月后t 值P 值观察组(n=44)对照组(n=44)t 值P 值39.16±5.21 39.17±4.98 0.009 0.993 22.38±3.32 30.57±4.79 9.322 0.000 18.017 8.256 0.000 0.000 34.56±6.27 34.63±6.13 0.053 0.958 58.34±8.53 49.48±7.63 5.135 0.000 14.900 10.064 0.000 0.000
2.4 两组并发症发生率及复发率比较
观察组出现伤口感染1 例, 并发症发生率为2.27%(1/44);对照组出现伤口感染6 例、出血3 例,并发症发生率为20.45%(9/44)。 观察组的并发症发生率低于对照组, 差异有统计学意义(χ2=7.221,P=0.007)。观察组的复发率为2.27%(1/44),低于对照组的18.18%(8/44), 差异有统计学意义(χ2=4.456,P=0.035)。
3 讨论
目前,临床针对原发性脑肿瘤多采用颅底显微神经外科手术治疗,可在不破坏患者脑部神经功能的前提下,最大程度安全切除脑肿瘤,具有快速、舒适、安全的特点[4]。但由于颅底结构的相对特殊性,显微镜下照射的平行光束易被颅骨、脑组织等阻挡,光线昏暗,视野死角区域较大, 从而造成术后肿瘤病灶残留,肿瘤全切率相对较低[5]。
神经内镜技术作为一种微创技术,已在脑肿瘤等神经外科疾病中得到广泛应用,可提供高强度的照明及多角度镜头, 其辅助下进行颅底显微神经外科手术,能对残留肿瘤进行切除,提高手术切除率,加快患者术后恢复[6]。 本研究结果显示,与对照组比较,观察组的肿瘤完全切除率明显较高, 临床相关指标均较优,NIHSS 评分较低,ADL 评分较高, 并发症发生率及复发率均较低,组间差异有统计学意义(P<0.05),这提示神经内镜辅助颅底显微镜神经外科手术的效果显著, 可提高原发性脑肿瘤患者的肿瘤切除率,改善临床相关指标,促进其神经功能恢复,提升日常生活能力,降低并发症发生率及复发率。分析原因,采用颅底显微镜神经外科手术治疗原发性脑肿瘤患者的过程中,会引起较大创伤,易对脑神经组织产生较强的牵拉作用,导致神经功能缺失,而采用神经内镜辅助显微镜,能利用其多角度镜头转动的特点,对肿瘤内部及周围结构进行完备的定位观察,全面了解周围组织解剖关系,提高脑肿瘤完全切除率,更好地发挥微创手术效果[7]。相较于常规显微镜观察,神经内镜镜头的手术视野更广,光照条件良好,有利于消除显微镜盲区,在小视角情况下即可近距离清晰地对患者深部病灶及病灶周围进行探查, 不仅可彻底清除肿瘤,提升肿瘤全切率,还可减小颅骨开窗,避免伤及周围的正常组织,为手术成功奠定了坚实基础,有助于改善患者预后[8-9]。此外,神经内镜可与显微镜互相弥补,神经内镜具有视野范围广、光照好、微创等优势,术中可对病灶周围结构进行观察, 避免损伤脑部组织,提高手术切除率,降低复发风险,缩短引流管留置时间,提升安全性; 但神经内镜在直视图分辨率的限制下,无法对病灶的状态进行清晰观察,而在显微镜协助下可避免这一状况,改善其不足,从而发挥协同作用[10]。
综上所述,采用神经内镜辅助颅底显微镜神经外科手术治疗原发性脑肿瘤的效果显著,可提高肿瘤完全切除率,改善临床相关指标,促进患者神经功能恢复,提升其日常生活能力,并可有效减少围术期并发症发生,降低复发风险,值得临床推广使用。

