重返透析移植肾失功受者的临床管理
张淑宇 综述 李月红 审校
[作者单位]清华大学附属北京清华长庚医院肾内科 清华大学临床医学院(北京,102218)
肾移植是终末期肾病的优选治疗,可提显著高患者生活质量。1960年吴阶平教授成功开展了我国首例尸体肾移植手术,此后我国肾移植数量逐年增加[1]。然而,肾移植术后面临很多临床问题,如移植肾功能延迟恢复、急性排斥反应、感染及移植肾失功等。有关移植肾失功的定义目前尚无统一共识,肾移植失功包括肾功能稳定但估算的肾小球滤过率(eGFR)<20 mL/(min·1.73 m2)、或肾功能出现不可逆的进行性下降、或重返肾脏替代治疗等[2]。随着肾移植技术进步,我国移植肾失功受者百分比逐年降低,但总人数仍逐年增加。与移植肾功能正常的受者相比,移植肾失功受者的总死亡率、心血管病死亡率和感染相关死亡率均显著升高[3]。目前亟需多学科合作,决策肾移植术后失功受者的慢性肾脏病并发症管理、肾脏替代治疗时机、免疫抑制剂调整及是否移植肾切除等,以改善肾移植失功受者的总体结局。
慢性肾脏病并发症的管理
肾移植医师的目标是延长同种异体移植物的存活率,但不能以慢性肾脏病相关并发症控制不佳和透析开始时机过晚为代价。恶性高血压、血脂异常、重度贫血、慢性肾脏病矿物质和骨异常(CKD-MBD)、营养不良、机会性感染不仅导致死亡率升高,也会加重移植肾功能的恶化[4]。
英国一项研究表明,大多数eGFR<30 mL/(min·1.73 m2)的肾移植受者未达到目标血压或目标血脂水平[5]。控制血压优选肾素-血管紧张素-醛固酮系统抑制剂和钙离子通道阻滞剂;代谢综合征和血脂异常是移植肾失功进展和心血管病死亡的重要危险因素[6],降血脂治疗优选不经CYP3A同工酶代谢的降脂药,如氟伐他汀、普伐他汀和瑞舒伐他汀,以减少与免疫抑制剂的相互作用[7]。
有关贫血治疗,促红细胞生成素和血红蛋白最佳靶标在肾移植受者中的获益仍不确定。最近一项随机对照研究结果表明,将血红蛋白纠正到125~13.5 g/L,可延缓移植肾功能恶化,有利于肾功能保护[8]。
肾移植受者的CKD-MBD包括肾移植前骨病、移植后骨病及激素治疗相关的骨质疏松等[9]。KDIGO指南建议每3个月评估血磷和血钙,每6个月评估甲状旁腺激素,对于骨质疏松症风险较高的受者,评估骨矿物质密度。CKD-MBD的诊断方法与慢性肾脏病患者相似[10],移植肾失功受者的CKD-MBD治疗须考虑甲状旁腺功能亢进症的治疗、骨质疏松症的预防、延长激素治疗的风险及肾移植后急性排斥反应的潜在风险等,提倡饮食限制磷的摄入及磷结合剂的应用。
透析时机和透析方式
移植肾失功受者何时再次过渡到透析治疗,选择血液透析还是腹膜透析,目前尚缺乏指南性建议。有研究表明,eGFR变化趋势、蛋白尿、供者特异性抗体存在和移植后肾小球病的发生是移植肾失功的重要预测指标[11-12]。一项多中心研究评估肾移植受者的四变量(年龄、性别、eGFR和尿白蛋白/肌酐比值)的肾衰竭风险方程,该方程可预测移植肾失功,尤其对于eGFR<45 mL/(min·1.73 m2)的患者[13]。“何时开始透析(initiating dialysis early and late,IDEAL)研究”[14]建议eGFR<15 mL/(min·1.73 m2)并有以下一种或多种情况时开始透析治疗:尿毒症症状或体征,容量负荷过重或血压过高无法控制,或营养状况进行性恶化。在有感染或糖尿病相关并发症的情况下,早期开始透析需要更快地减少免疫抑制剂。相反,无症状的患者可能会受益于延迟透析。在移植肾失功后,通常会推迟到远低于推荐的eGFR阈值才开始透析,采取比常规血液透析或腹膜透析更强化的透析方案。目前研究显示,腹膜透析和血液透析的长期生存率相近[15]。一项加拿大研究结果显示[16],与未行肾移植的慢性肾脏病患者相比,肾移植失功的受者更多选择腹膜透析,可能归因于年龄和自主性偏倚。法国一项队列研究将328例移植肾失功后的腹膜透析患者[17],与656例年龄、性别匹配的慢性肾脏病未移植患者进行对比,尽管腹膜炎发病率相似,但肾移植受者的腹膜透析失败率显著更高,腹膜透析转入血液透析的主要原因是透析充分性降低和超滤失败,但也有学者指出相比血液透析,移植肾失功后行腹膜透析的患者在保留残余肾功能方面更具优势[18]。
透析通路是肾移植受者的另一个重要问题,临床选择中心静脉导管多于动静脉内瘘[19]。肾移植受者使用免疫抑制剂感染发生率较高,更提倡计划性重返透析,先建立永久性通路。最近一项大型队列研究显示,中心静脉临时管作为重返透析的透析通路,是移植肾失功受者死亡的独立危险因素[20]。
抗排异药调整
移植肾失功后是否停用免疫抑制剂主要考虑三方面内容:再移植的可能性、免疫抑制剂的不良反应(包括心血管疾病、感染和肿瘤)及残余肾功能的保留。同种移植肾失功后,持续应用免疫抑制剂的支持点包括预防移植物不耐受综合征、减缓开始透析1年内肾功能下降速度、对有再移植需求的患者致敏预处理。但要权衡持续免疫抑制的收益与其并发症的风险,如心血管事件、感染、恶性肿瘤、继发性肾上腺功能不全等。目前尚缺乏高质量临床证据和指南,需进行个体化风险和获益评估(图1)[21]。
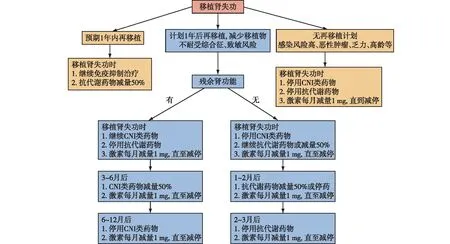
图1 肾移植失功受者免疫抑制剂调整策略
有研究[22]调查了来自92个移植中心的104例肾移植专家后发现,73%肾移植专家对于移植肾失功受者最常用的免疫抑制治疗是首先停用抗代谢药(如吗替麦考酚酯、硫唑嘌呤或雷帕霉素靶蛋白抑制剂),仅12%肾移植专家首先停用钙调磷酸酶抑制剂。超过60%的受试者表示是否有活体供肾是他们决定逐渐减少免疫抑制剂的最重要因素,其次是感染风险、致敏风险、衰弱和药物副作用。有研究表明晚期移植肾失功受者可从减少钙调磷酸酶抑制剂(CNI)剂量或完全停药中获益[23]。此外,一项回顾性单中心研究纳入了131例移植肾失功后开始透析的患者,提示使用两种以上免疫抑制剂是死亡的独立危险因素[24]。有关停用免疫抑制剂的一项前瞻性多中心研究,纳入加拿大16个移植中心的269例移植肾失功受者,结果显示肾移植失败后大于1年、长期使用免疫抑制剂与更高的死亡率、住院感染风险无关,但不足以防止人类白细胞抗原(HLA)抗体产生及预防移植物排斥反应[25]。最近一项研究比较了143例停用免疫抑制剂的移植肾失功受者和43例在透析中维持免疫抑制剂治疗的受者,发现两组因感染住院的比例分别为17%和35%。多变量分析中,维持免疫抑制剂与较高的感染住院风险相关,患者生存率降低[26],移植肾失功后持续免疫抑制剂治疗会导致感染并发症增加。
此外,也有支持移植肾失功受者长期使用免疫抑制剂的数据。一项观察性研究分析了119例同种异体移植肾失功且群体反应性抗体(PRA)<20%的受者,结果提示停用免疫抑制剂是移植物不耐受综合征的触发事件,是HLA致敏的独立预测因子[27]。2021年一项回顾性研究纳入了134例患者,比较免疫抑制剂停止时间<90 d、90~180 d和>180 d三组患者,结果延长免疫抑制剂停药时间并不降低致敏,但降低移植肾切除术的风险[28]。移植肾失功后维持免疫抑制剂治疗的主要难点是CNI的合适剂量。最近一项纳入45例移植肾失功受者,维持他克莫司治疗24月,结果显示他克莫司浓度≥3 ng/mL可防止同种异体致敏[29]。Lubetzky等[2]建议维持他克莫司治疗浓度为3~5 ng/mL。
为了减少致敏,移植肾失功后停用免疫抑制剂的新方法正在研究。2021年发表的一项随机对照研究,将13例同种异体移植肾失功受者分至贝拉西普与停用免疫抑制剂组,在随机化分组后36月评估HLA抗体水平。与贝拉西普治疗的患者相比,停药组HLA抗体水平更高,不良事件相似[30]。贝拉西普在预防移植肾失功后的同种异体致敏防治方面有一定作用。
综上,对于不符合再移植条件的肾移植失功受者,维持免疫抑制剂带来的益处并不大于其不良影响,建议可考虑停用免疫抑制药物,可在几周内停用CNI,在至少几个月内逐渐减少激素用量。但对于急性排斥反应而导致早期肾移植失败的患者,可考虑有计划的移植肾切除术,或继续免疫抑制治疗以限制HLA抗体致敏,直到移植肾切除术。
移植肾切除
同种异体移植肾切除术的适应证和时机尚无共识。移植肾切除术的潜在益处包括预防移植物不耐受综合征、感染、结石梗阻等导致的非免疫性移植肾失功综合征,及为新肾提供空间,风险包括残余肾功能丧失、HLA致敏及手术并发症发生率和死亡率增加。出现移植物不耐受综合征的受者,要权衡同种异体移植肾切除术或栓塞手术的获益和风险。
移植肾切除可改善肾移植失功受者贫血和慢性炎症状态下的低白蛋白血症,减少红细胞生成素抵抗[31]。为研究同种异体肾切除术对死亡率的影响,有学者分析了来自美国肾脏数据系统(US Renal Date System,USRDS)大样本移植肾失功受者队列(10 951例)的数据,移植肾切除受者比保留移植肾的受者平均年轻4.6岁,有较少的合并症。对潜在混杂因素调整后,同种异体移植肾切除术后受者死亡风险降低32%[32]。另一项回顾性分析发现,移植物切除术与移植后1年内移植肾失功受者的并发症和死亡率增加有关,主要死亡原因是心血管疾病,其次是脓毒症。相比之下,对于晚期移植肾失功受者,同种异体肾切除术可提高其生存率[33]。大多数早期移植物切除术是在紧急情况下进行,当需要同种异体肾切除术时,最好及时手术切除而不是观望。
血管栓塞是治疗移植物不耐受综合征的一种更为安全的微创技术,移植肾血管栓塞后常出现短暂的栓塞后综合征,主要表现为发热和局部疼痛,需要对症治疗,可通过短期使用激素来预防[34]。最近一项法国回顾性队列研究[35],比较血管栓塞作为一线治疗与手术切除的疗效和安全性,血管栓塞总成功率为84.4%,仅5例受者需要后续移植物手术切除,栓塞后2例出现穿刺部位血肿,手术切除组14例出现一种或多种并发症。移植物血管栓塞可能是移植物不耐受综合征受者一种有效且安全的替代治疗选择,特别是对于手术风险高的受者。
小结:移植肾失功受者面临的困境包括慢性肾脏病并发症管理、透析开始的适宜时机和透析方式、免疫抑制剂调整、移植肾切除术指征及获益风险等。需要肾科医师早期参与移植肾失功受者的管理,严格监控代谢指标,停止或减少免疫抑制剂要警惕移植后排斥反应的风险,监测炎症指标,提前准备透析血管通路等。目前仍需要前瞻性、高质量的研究来评估移植肾失功受者重返透析的时机、风险与获益。

