LncRNA-Gm4419对小鼠肾小球系膜细胞炎症、纤维化和增殖的影响
高 清 卢美琪 陈怡萱 林梦舒 王科嘉
[作者单位]1厦门大学附属中山医院肾内科 (厦门,361000);2厦门大学医学院;3福建医科大学第三临床医学院
糖尿病肾病(DN)是糖尿病最常见和最严重的并发症之一[1],也是导致慢性肾脏病和终末期肾病的主要原因[2]。研究表明,DN的发病机制与多种因素相关,如炎症反应、系膜细胞增殖、细胞增殖和纤维化等[3],但确切机制仍需进一步探究。
真核生物基因组中存在大量非编码RNA(ncRNA)[4],可分为长非编码RNA(lncRNA)(>200个核苷酸)和小非编码RNA(miRNA)(≤200个核苷酸)。LncRNA主要通过竞争性结合减少miRNA的表达,从而使miRNA失效[5],已有研究表明lncRNA在癌症[6]、心血管疾病[7]和DN[8]等疾病的发生发展中起重要作用。lncRNA-Gm4419主要分布在细胞质中,且高糖培养下系膜细胞中的lncRNA-Gm4419水平显著增高,其与系膜细胞的炎症、纤维化和增殖有关,对于DN的发生发展也起重要作用[9]。
我们通过miRDB-CustomPrediction数据库预测到lncRNA-Gm4419的配对miRNA为miR-7214-3p(5'-cucaguccugaccccuugagcgca-3')(图1)。为了探究lncRNA-Gm4419是否通过miR-7214-3p影响高糖诱导小鼠肾小球系膜细胞(mouse glomerular mesangial cell,MGMC)炎症、纤维化和增殖,本研究通过检测高糖和低糖培养下MGMC中miR-7214-3p的表达情况,并通过荧光素酶报告基因检测lncRNA-Gm4419与miR-7214-3p的结合能力。同时,通过实时荧光定量聚合酶链反应(qRT-PCR)方法检测在高糖条件下转染lncRNA-Gm4419和miR-7214-3p对MGMC炎症、纤维化和增殖的影响。

图1 LncRNA-Gm4419与miR-7214-3p之间的结合位点
材料与方法
细胞、试剂及仪器MGMC(SV40MES13)购自中科院细胞库,改良杜氏细胞培养基(DMEM)培养基购自(GE Healthcare Life Sciences,Logan,UT),胎牛血清购自翌圣生物,细胞计数试剂盒购自索莱宝,膜联蛋白V-异硫氰酸荧光素/碘化丙啶细胞凋亡检测试剂盒购自北京索莱宝,双荧光素酶报告基因检测试剂盒购自(Promega,Madison,WI),Trizo 试剂、RIPA 裂解液、聚偏二氟乙烯(PVDF)膜、电化学发光(ECL) 液购自(GE Healthcare,Chicago,IL,USA),Lipofectamine2000与 Trizol购自(Invitrogen; Thermo Fisher Scientific,Inc.),反转录试剂盒与荧光定量 PCR 试剂盒购自(Takara,Kyoto,Japan),miR-7214-3p寡核酸模拟物及抑制剂、阴性对照物购自GenePharma,pcDNA3.1 购自(Invitrogen; Thermo Fisher Scientific,Inc.),设计所有序列、引物的设计合成均由上海生工完成。
方法
细胞培养与分组 为了进行细胞培养实验,将MGMC培养于含有10%胎牛血清的DMEM培养基中,培养条件为37 ℃、5% CO2,待细胞在80%融合时进行传代培养,使用胰酶进行消化,然后将取对数期肾小球系膜细胞重悬后接种于96孔板中,细胞生长至70%融合时,使用含有5.5 mmol/L葡萄糖+19.5 mmol/L甘露醇的培养基培养细胞作为低糖组,使用25 mmol/L高糖处理肾小球系膜细胞,记作高糖组。
按照《Lipofectamine2 000试剂说明书》的要求,将阴性miRNA抑制物和miR-7214-3p抑制物分别转染至MGMC并使用低糖培养基培养细胞24 h,分别记作低糖+阴性miRNA抑制物组、低糖+miR-7214-3p抑制物组。将阴性miRNA类似物、miR-7214-3p类似物、空载体+阴性miRNA类似物、lncRNA-Gm4419+阴性miRNA类似物和lncRNA-Gm4419+miR-7214-3p类似物转染至MGMC使用高糖培养基培养细胞24 h,分别记作高糖+阴性miRNA类似物组、高糖+miR-7214-3p类似物组、高糖+空载体+阴性miRNA类似物组、高糖+Gm4419+阴性miRNA类似物组和高糖+Gm4419+miR-7214-3p类似物转染组。(miR-7214-3p类似物5'-CUCAGUCCUGACCCCUUGAGCGCA-3',miR-7214-3p抑制物 5'-ACGCGAGUUCCCCAGUCCUGACUC-3',阴性miRNA类似物/抑制剂5'-ACGCGAGUUCCCC AGUCCUGACUC-3')。
将各组细胞用脂质体进行转染,按照1∶3的量加入脂质体,轻轻吹打混匀后,与细胞共同培养5 h。然后补充新鲜培养液继续培养48 h。结束后用qRT-PCR法检测转染的效率,确定转染成功后方可用于后续实验研究。若转染效率未达到要求则重复上述转染,直至转染成功。
qRT-PCR实验 为了检测细胞的相对表达量,需要进行qRT-PCR实验。需要检测的细胞提取总RNA,然后将其转录为cDNA,并按照qPCR试剂盒要求检测模板中的miR-7214-3p、纤维蛋白(Fn)、胶原蛋白Ⅳ(Col.Ⅳ)、肿瘤坏死因子α(TNF-α)、白细胞介素1β(IL-1β)和单核细胞趋化蛋白1(MCP-1)的表达。以GAPDH、U6作为内参,采用2Ct法检测miR-7214-3p、MCP-1、TNF-α、IL-1β、Fn和Col.Ⅳ的相对表达量。引物信息如下:miR-7214-3p上游引物:5'-CTCAGTCCTGACCCCT TG-3',下游引物:5'-GCAGGGTCCGAGGTATTC-3';Fn上游引物:5'-ATGAGAAGCCTGGATCCCCT-3',下游引物:5'-GGCCCGGAACATGAGGATAG-3';Col.Ⅳ上游引物:5'-AACAACGTCTGCAACTTCG-3',下游引物:5'-GCAGAGGCGAGCATCATAGT-3';TNF-α上游引物:5'-ATGGCCTCCCTCTCATCAGT-3',下游引物:5'-ACCCTGAGCCATAATCCCCT-3';IL-1β上游引物:5'-GTGGCAGCTACCTGTGTCTT-3',下游引物:5'-CTCTGCTTGTGAGGTGCTGA-3';MCP-1上游引物:5'-AGCCAACTCTCACTGAAGCC-3',下游引物:5'-GCATCACAGTCCGAGTCACA-3'。将cDNA作为模板进行qRT-PCR反应。参照试剂盒配置反应体系,反应条件如下:95 ℃预变性60 s,95 ℃变性60 s,56 ℃退火30 s,72 ℃延伸30 s,共35个循环。
双荧光素酶报告基因实验 通过使用在线预测网站miRDB-CustomPrediction(https://mirdb.org/custom.html),预测lncRNA-Gm4419和miR-7214-3p之间的靶向结合位点。提取MGMCs总RNA,逆转录为cDNA,通过lncRNA-Gm4419引物扩增出lncRNA-Gm4419全长序列,用Bam HI和Eco RV双酶切连接在pcDNA3.1真核表达质粒,产物转化感受态细胞DH5α,涂板、挑菌并摇菌扩增后,获得表达载体。制作lncRNA-Gm4419上游引物5'-GGGGATCCGGCTTTCGACCTCCGAGGCTGCGAC-3'和下游引物5'-TTGATATCACAACATTTGTGGTAGA GGTTAAACGGATATC-3'。然后,将lncRNA-Gm4419全长序列5'第348位碱基A突变为碱基T,合成含有lncRNA-Gm4419结合位点的基因片段(突变型lncRNA-Gm4419)和含有突变的lncRNA-Gm4419结合位点的基因片段(野生型lncRNA-Gm4419)。根据Lipofectamine2000转染试剂说明书,将lncRNA-Gm4419野生型质粒或突变型质粒与阴性miRNA类似物、miR-7214-3p核酸类似物、阴性miRNA抑制物和miR-7214-3p抑制物一起转染,培养48 h后加入裂解液进行裂解,4℃,12 000 r/min离心10 min,取上清检测海肾荧光素酶活性和萤火虫荧光素酶活性,并用二者的比值表示lncRNA-Gm4419和miR-7214-3p之间的结合能力。
流式细胞术 收集各组对数期MGMCs,用预冷PBS洗涤3次。接着加入500 μL Binding Buffer悬浮细胞。将Annexin V-FITC和PI各5 μL滴入每个孔中并充分混匀。避光在室温下孵化20 min。使用FACS Calibur流式细胞仪检测细胞增殖率。
CCK-8实验 将需要检测的细胞调整至104个/mL,按照CCK-8试剂盒要求进行操作,取约1×103个细胞,加入10 μL的CCK-8反应液。在490 nm波长下检测细胞的吸光度。细胞的增殖率为(OD490样本/OD490对照-1)×100%。
统计学方法采用《GraphPad Prism 8.0》统计学软件进行数据分析,符合正态分布的计量资料以均数±标准差表示。使用独立样本t检验比较两组间差异,采用单因素方差分析比较多组差异,并用Tukey′s两两比较校正方法,P<0.05为差异有统计学意义。
结 果
在高糖诱导下,MGMC中miR-7214-3p表达下调与低糖组相比,高糖组中MGMC miR-7214-3p的表达显著降低,表明高糖条件可抑制MGMC中miR-7214-3p的表达(图2)。

图2 MiR-7214-3p在小鼠肾小球系膜细胞中表达情况
MGMC中lncRNA-Gm4419与miR-7214-3p的相互结合沉默miR-7214-3p后,与野生型lncRNA-Gm4419共转染组相比,突变型lncRNA-Gm4419共转染组荧光素酶活性显著减少(P<0.05);过表达miR-7214-3p后,与野生型lncRNA-Gm4419共转染组相比,突变型lncRNA-Gm4419共转染组荧光素酶活性显著增加(P<0.05);表明miR-7214-3p可以与lncRNA-Gm4419结合(图3)。
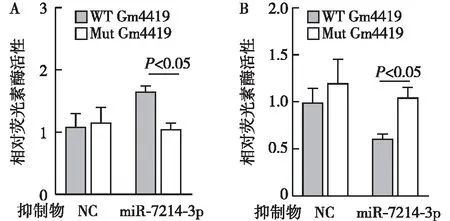
图3 双荧光素酶活性检测lncRNA-Gm4419与miR-7214-3p的结合力
MiR-7214-3p能够抑制MGMCs的炎症、纤维化和增殖在低糖条件下,与阴性miRNA抑制物组相比,miR-7214-3p抑制物组MCP-1、TNF-α、IL-1β、Fn和Col.Ⅳ表达水平和细胞增殖率显著升高(P<0.05);在高糖条件下,与阴性miRNA类似物相比,miR-7214-3p类似物组MCP-1、TNF-α、IL-1β、Fn和Col.Ⅳ表达水平和细胞增殖率显著减低(P<0.05)(图4)。表明miR-7214-3p能够抑制高糖诱导的MGMCs的炎症、纤维化和增殖。
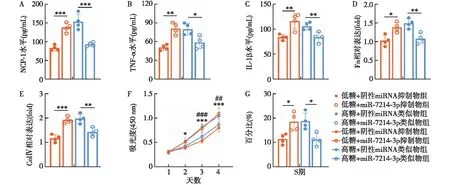
图4 MiR-7214-3p对小鼠肾小球系膜细胞炎症、纤维化和增殖的影响
高糖培养环境下lncRNA-Gm4419通过miR-7214-3p调节炎症、纤维化和细胞增殖MGMC在高糖培养环境下,与空载体组相比,转染lncRNA-Gm4419组中MCP-1、TNF-α、IL-1β、Fn和Col.Ⅳ表达水平和细胞增殖率显著升高(P<0.05);转染lncRNA-Gm4419的同时过表达miR-7214-3p,MCP-1、TNF-α、IL-1β、Fn和Col.Ⅳ表达水平和细胞增殖率较单纯转染lncRNA-Gm4419组显著降低(图5)。结合前面的研究结果,lncRNA-Gm4419可与miR-7214-3p结合,提示lncRNA-Gm4419可通过调控miR-7214-3p来影响MGMC的炎症、纤维化和增殖。
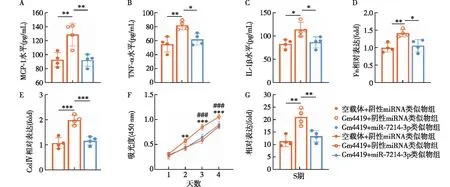
图5 在高糖培养条件下,转染lncRNA-Gm4419后,观察过表达miR-7214-3p对小鼠肾小球系膜细胞炎症、纤维化和增殖的影响
讨 论
随着全球糖尿病患病率的增加,DN患病率不断升高[2],最新研究表明,早期肾脏受累的糖尿病患者生存寿命预计会缩短16年[10]。因此,亟需明确DN发病机制并进行早期干预治疗。高级基因组研究结果只公布了小部分(3%)的基因组和蛋白质编码基因,其余部分(97%)被认为是“非编码RNA的未知领域”[11],随着高通量测序技术的进步,研究人员对基因组和转录组的理解有了显著提高,证实lncRNA和miRNA在遗传转录和表观遗传调控中发挥关键作用[12]。
研究表明,lncRNA已成为包括DN在内的多种疾病的基因调节和预后标志[13],如研究发现lncRNA-ENSMUST00000147869和lncRNA-CYP4B 1PS1-001参与DN肾小管上皮细胞增殖和纤维化[14]。越来越多的证据支持lncRNA“海绵状”[15]学说,即lncRNA通过竞争性结合减少miRNA表达,将miRNA从mRNA中吸走,从而使miRNA失效,如lncRNAMEG3/MIR-93/p21介导的途径调节细胞的存活、增殖和凋亡[16],lncRNA-GAS5 通过miRNA-142-5p对肾纤维化的保护作用[17],lncRNA-1700020I14Rik通过与miR-34a-5p相互作用来抑制高糖培养的MGMC的增殖和纤维化[18]。本研究发现,高糖条件下,lncRNA-Gm4419通过与miR-7214-3p相互作用来促进MGMCs的炎症、纤维化和增殖。
根据其所在的细胞位置LncRNA发挥不同的功能,lncRNA-Gm4419主要存在于细胞质中,表明lncRNA-Gm4419主要在基因调控方面发挥作用[19]。已有研究证明,在高糖条件下,MGMC中lncRNA-Gm4419表达显著上调[20-21]。为进一步探究高糖培养下的MGMC中lncRNA-GM4419的炎症、纤维化和增殖的生物学作用,本研究利用生物信息学方法预测到lncRNA-Gm4419与miR-7214-3p之间存在结合位点,并通过qRT-PCR方法检测到高糖培养下的MGMC中miR-7214-3p表达受抑制,提示高糖可抑制miR-7214-3p表达。
随后,本研究通过双荧光素酶报告基因实验检测lncRNA-Gm4419与miR-7214-3p的结合能力。结果发现,沉默miR-7214-3p表达的突变型lncRNA-Gm4419基因片段荧光素酶活性升高,而过表达miR-7214-3p后的突变型lncRNA-Gm4419基因片段荧光素酶活性降低,提示lncRNA-Gm4419与miR-7214-3p存在结合力。通过qRT-PCR和CCK-8方法检测在不同条件下miR-7214-3p对MGMC炎症、纤维化与增殖的影响,结果显示,在低糖条件下,沉默miR-7214-3p表达会增加MCP-1、TNF-α、IL-1β、Fn和Col.Ⅳ等炎症和纤维化指标表达水平,细胞增殖率显著升高;而在高糖条件下,过表达miR-7214-3p会降低炎症和纤维化指标表达水平,细胞增殖率显著降低。提示miR-7214-3p在抑制MGMCs炎症、纤维化与增殖中发挥作用。本研究还进一步探讨了lncRNA-Gm4419和miR-7214-3p在MGMCs中的作用关系。结果显示,过表达lncRNA-Gm4419后,MGMC中炎症、纤维化指标表达水平和细胞增殖能力均升高;而同时过表达lncRNA-Gm4419和miR-7214-3p后,MGMC中炎症、纤维化指标表达水平和细胞增殖能力均下降。以上结果提示,lncRNA-Gm4419和miR-7214-3p均可影响MGMC炎症、纤维化和增殖进程,lncRNA-Gm4419通过与miR-7214-3p的结合在MGMC炎症、纤维化和增殖过程中发挥作用。
综上所述,结合文献阅读和本研究结果,证明lncRNA-GM4419和miR-7214-3p在高糖培养MGMC中异常表达,高糖环境下可能通过过表达lncRNA-GM4419从而抑制miR-7214-3p来调控系膜细胞的炎症和纤维化标记蛋白表达和增殖能力,从而引起肾小球炎症反应、纤维化形成和系膜增生等生物学行为。这些结果为研究DN的发生和发展提供了新的启示,但相关机制仍需进一步探究。

