血液透析中的血液相容性
黄 力 综述 葛永纯 审校
[作者单位]东部战区总医院 国家肾脏疾病临床医学研究中心(南京,210016)
血液透析(HD)是终末期肾病患者维持生命的重要手段之一,透析质量对于患者生活质量和生存时间至关重要。HD部分替代肾脏功能的局限性主要体现在两方面,(1)为短时、间断性透析不能充分清除毒素;(2)为HD导致的机体反应。透析时血液与体外循环(ECC)管路和透析器接触引起的不良反应——即血液不相容性,是透析技术所面临的持续挑战。
本文将综述生物相容性在HD中的特殊性,主要从膜蛋白沉积、凝血激活、补体和炎症激活等方面概述HD中血液相容性的系列问题,以及为提高血液相容性而进行的技术改进。
生物相容性
生物材料指与活体组织或体液接触的合成材料,随着合成材料在医学领域研究深入与广泛应用,生物材料科学得以快速发展。“生物相容性”可用于质化评价生物材料与生命体的相互作用,指某材料不会对机体产生严重危害。从临床角度出发,Klinkmann等[1]提出了更为实用的定义,即无血栓形成、毒性、过敏或炎症反应;不破坏血液有形成分;无血浆蛋白和酶的变化;不诱发免疫反应;无致癌作用;不引起邻近组织损伤。
1986年举行的生物材料共识会议,将“生物相容性”定义为“在特定应用中,材料引发宿主适当反应的能力”[2]。2008年,Williams等[3]提出了新见解,认为生物学材料在机体中惰性存在不是真正的生物相容,而应通过更好地融入甚至重建人体组织来发挥作用。生物相容性的概念被更新为,生物材料在临床应用中发挥预期的作用,引发机体细胞或组织应答以优化相关的临床性能,且不引起患者局部或全身不良反应。
血液相容性是生物相容性的一种,旨在评价人工材料、设备或植入物与血液接触时所发生的相互作用。接触血液的生物材料可分为体内接触(如导管、支架、心脏瓣膜等)和体外接触(如HD、人工膜肺的体外循环、储血袋、注射器等)。
血液相容性
HD时,血液通过穿刺针或导管从血管内引至体外,接触透析管路、血滤器和空气。血液中各种物质在应对新环境的过程中,可能产生不同的生物学反应,进而打破血管壁和血管腔内的稳态平衡。此外,多种生化级联反应被激活,引起组织损伤、炎症和氧化应激。血细胞尤其是血小板,也会因每周3次的周期性激活导致数量减少和功能损害[4]。
透析器膜面积约占HD中血液与生物材料接触总面积的90%,HD的发展在很大程度上依赖于透析膜的发展。
纤维素膜(如铜纺膜)是临床最早广泛应用的透析膜,因其激活补体和白细胞,诱发炎症反应,被称为生物不相容性透析膜。通过化学方法对纤维素膜表面羟基进行修饰,使其激活补体作用减弱,生物相容性得以提升,被称为“修饰性纤维素膜/改性纤维素膜”,如血仿膜、醋酸纤维素(CA)膜。人工合成膜生物相容性更好。根据聚合物的组成可分为4类:(1)聚砜系列,包括聚砜(PSF)膜、聚醚砜(PES)膜、聚砜/聚乙烯吡咯烷酮(PES/PVP)混合物膜。(2)聚丙烯腈系列,包括聚丙烯腈(PAN)膜、磺化的PAN膜AN69,聚乙烯亚胺(PEI)涂层的AN69ST膜。(3)聚甲基丙烯酸甲酸酯(PMMA)膜系列。(4)乙烯乙烯醇(EVAL)聚合物系列。修饰性纤维素膜和人工合成膜是目前临床中常用的透析膜。
血液与体外循环(ECC)人工合成材料表面相互作用十分复杂,诸多因素参与其中。目前研究的重点是透析器膜材料,而ECC其他因素如静脉壶血液与空气接触、血泵导致血细胞损伤、管路材质、抗凝剂类型和血液流速等也会在补体和凝血激活、血细胞活化中发挥重要作用。
透析膜的血液-材料界面反应
吸附蛋白质形成“次级膜”生物材料和血液接触时,会吸附血浆中的蛋白成分,并激活后续一系列反应,包括血小板黏附、凝血激活、免疫激活、补体激活等[5]。被透析膜吸附的蛋白质可在透析膜表面形成厚度为2~10 nm的“次级膜”,“次级膜”内蛋白质浓度可高达血浆中浓度的1 000倍。HD中的“次级膜”受很多因素影响,包括血液成分、蛋白质化学特性、膜的物理化学特性(表面粗糙度、厚度、孔隙率、成分、疏水性和电荷)和透析器内环境(温度、血流动力学)。Leo Vroman通过观察接触系统蛋白质的理化性质,首次发现蛋白质在膜表面的吸附过程是复杂、变化和竞争性吸附和解离的动态过程[6],该现象被命名为Vroman效应。Vroman效应在带负电荷的亲水表面上尤为明显。
蛋白质层不仅会在膜材料表面引发系列反应,还会深入膜材料孔隙中,降低膜的筛分性能和对溶质的清除率。当抗凝效果欠佳导致凝血或超滤分数较高时,膜表面蛋白沉积现象更为突出。“次级膜”的形成降低了透析器弥散和对流能力,从而削弱了溶质转运能力。因此,透析膜的性能高度依赖于血浆蛋白的吸附情况。
凝血和血小板激活血管内皮细胞可抵抗血栓形成,而异物表面与血液接触则可引起血栓形成和触发炎症。吸附的蛋白质触发激活凝血因子Ⅻ(FⅫ)和血小板黏附、激活和聚集,同时激活补体系统。纤维蛋白原是最先沉积在人工材料表面的血浆蛋白之一。其他黏附蛋白包括纤维连接蛋白和血管性血友病因子,与纤维蛋白原共同参与介导血小板黏附。吸附的纤维蛋白原通常被接触系统的凝血因子和激肽系统酶原取代,包括FⅫ、FⅪ、激肽释放酶原(PK)、高分子量激肽原(HK)[7]。
内源性途径是接触生物材料激活凝血的最主要通路,FⅫ可在负电荷表面上吸附引发接触激活,经历构象变化后变成FⅫa并激活后续通路。FⅫa还能在HMWK存在的前提下将PK转化为激肽释放酶(KK),激活更多的FⅫ,促进自身反馈激活,并激活激肽系统。激肽系统在缓激肽(BK)介导的血压调解中起到重要作用,病理条件下BK升高,通过增加血管通透性或刺激其他血管扩张剂生成[如一氧化氮(NO)、前列腺素E2(PGE2)和前列环素(PGI2)],导致严重低血压[8]。因此,HD材料表面应避免强负电荷。外源性凝血途径由表达组织因子(TF)的细胞暴露于血液中而被激活,TF位于内皮细胞下细胞外基质以及成纤维细胞和平滑肌细胞中,在血管损伤时释放入血。长期以来,人们认为外源性凝血途径在血液-材料相互作用中没有发挥作用,但近期研究发现,血液与材料接触可诱导单核细胞及中性粒细胞表达TF,激活外源性凝血途径[9]。内源性和外源性凝血途径都将FX激活为FXa,FXa与活化的辅因子FVa复合物将凝血酶原转化为凝血酶,凝血酶再将纤维蛋白原聚合成纤维蛋白,形成血栓(图1)。
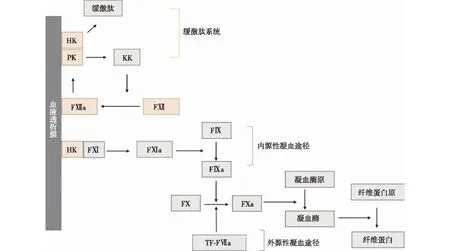
图1 血液透析膜激活凝血系统[10]
血小板激活的早期表现为血小板黏附于人工材料表面,随后伴随凝血级联反应,形成白色血栓。表面吸附的纤维蛋白原、纤维连接蛋白、血管性血友病因子(vWF),通过与血小板表面的糖蛋白Ⅱb/Ⅲa受体结合,诱导血小板黏附和活化。血小板在发生形变、聚集的同时,内部质膜小叶的促凝血磷脂(磷脂酰丝氨酸和胆碱)暴露,结合凝血因子。随后,含有多种促凝因子的α颗粒和致密颗粒内容物释放,进一步促进血小板黏附、活化和聚集,形成血小板-纤维蛋白网,加固血栓[11]。
除透析膜外,血泵(溶血释放ADP导致引发血小板聚集)和静脉壶(接触空气使蛋白质变性)都是凝血和血小板活化的发生部位[12]。即使透析期间没有出现明显的血凝块,凝血酶片段1+2、凝血酶-抗凝血酶Ⅲ复合物(TAT)显著升高,提示HD期间凝血系统被激活[13]。
补体激活和白细胞活化早在上世纪70年代,已有研究证实纤维素膜透析器可激活补体系统[14]。即使是在生物相容性较高的人工合成膜中,HD过程亦伴随补体激活。透析膜通过吸附在膜表面的甘露糖结合凝集素 (MBL)和血浆纤维胶凝蛋白2(ficolin-2)激活凝集素途径[15],备解素或C3b激活补体替代途径[16]。不同激活途径的共同结果为C3裂解成过敏毒素C3a和C3b,后者生成C5转化酶,将C5裂解成C5a和C5b(调理素),C5b和C6-C9结合最终形成膜攻击复合物(MAC)(图2)[17]。
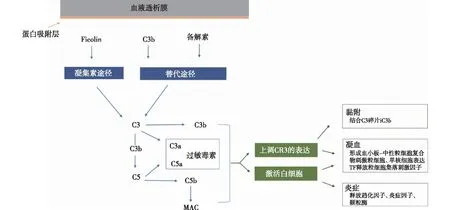
图2 血液透析膜激活补体从而诱发炎症和促凝反应[17]
补体激活促进白细胞募集和活化,引起促炎细胞因子和趋化因子的释放,如白细胞介素 (IL)-1β、IL-6、IL-8、肿瘤坏死因子α、单核细胞趋化蛋白1 和干扰素γ。C5a可刺激中性粒细胞、单核细胞释放TF,参与外源性凝血途径。补体激活进一步上调白细胞表面受体,尤其是补体受体3(CR3),使白细胞与沉积在透析膜上的C3片段结合,导致血白细胞减少;中性粒细胞表面的CR3上调可促进血小板-中性粒细胞复合物形成,进而促进颗粒酶(如髓化过氧化物和弹性蛋白酶)及粒细胞集落刺激因子的释放[18]。
补体激活与心血管疾病(CVD)事件密切相关,研究发现,HD患者中C3 和C5b-9水平升高与CVD 事件发生率和死亡率升高密切相关[19]。
血液不相容的预防
膜材料和表面修饰透析膜的生物相容性需要综合考量其各种特性之间的平衡,为克服某种血液不相容性而进行的透析膜表面修饰,也许会带来新问题。
高度亲水的表面渗透性强,有利于小分子毒素弥散,但易引发补体激活和白细胞活化;高度疏水的表面吸附能力强,易导致蛋白吸附和血小板激活;高负电荷的表面会激活FXⅡ依赖的凝血途径,与血管紧张素转换酶抑制剂(ACEI)共同作用会导致过敏反应,甚至诱发过敏性休克。因而,实现生物相容性所需的平衡,极具挑战性。
研究发现纤维素膜易引起补体激活和白细胞活化,其主要原因是由于聚合物中含大量羟基基团,用二乙氨基-乙基(DEAE)或乙酯酸取代羟基基团的改性纤维素膜,其补体激活和白细胞活化程度显著降低。非纤维素类人工合成材料具有高度疏水性,需要加入亲水性有机聚合物如聚乙烯吡咯烷酮(PVP)、壳聚糖 (CS)、聚酰胺、聚乙二醇 (PEG) 衍生物,以降低疏水性,减少蛋白质和血小板吸附。AN69膜带高负电荷,接触激活FXⅡ,促进缓激肽形成。血管紧张素转换酶(ACE)可使缓激肽失活,在服用ACEI的患者体内,缓激肽的半衰期延长,增强过敏反应。血浆缓激肽水平与过敏反应发生率呈正相关,用聚阳离子PEI改变表面可降低其负电荷性,防止接触激活和BK形成,避免与ACEI一同使用时引起的过敏性休克,并增强了与肝素结合的能力[20]。维生素E(α生育酚)涂层透析膜具有抗氧化能力,研究证实该透析膜有抑制炎症、抗血小板聚集和纠正贫血的作用[21-22],肝素涂层透析膜用于有出血风险的患者,可避免系统性抗凝,减少出血风险[23-24]。
此外,透析膜的灭菌模式和吸附内毒素的能力对于改善血液相容性也至关重要[25],HD患者每次透析需接触90~120 L透析液,由透析液污染和细胞因子诱导物质(CIS)诱发的慢性炎症反应与透析患者的预后相关[26]。
个体化抗凝HD能激活凝血和血小板,由此形成的血凝块会使滤器清除率降低、引发机器报警,因此HD过程中需要抗凝。理想的抗凝剂作用是预防滤器和管路凝血,同时不引起机体出血和其他不良反应。低分子肝素由普通肝素分离而成,对凝血酶作用小,同时保留对FXa的作用。肝素和低分子肝素可诱发肝素相关的血小板减少(HIT),表现为血小板减少和异常高凝状态。一旦怀疑HIT,应立即停用肝素/低分子肝素,选择替代抗凝剂,如比伐卢定、阿加曲班,同时也应避免使用肝素封管。枸橼酸局部抗凝是通过络合体外循环血液中离子钙,阻止凝血酶原转化为凝血酶,从而抑制凝血过程。枸橼酸根是生理性物质,进入体内经三羧酸循环代谢为碳酸氢根,并释放所螯合的离子钙,对体内凝血过程无明显影响,用于有活动性出血和有高危出血风险的患者具备优势,但在组织低灌注和严重肝功能不全的患者中存在蓄积的风险,需严密监测血气[27]。不同的患者血液状态和合并疾病不同,因此需个体化抗凝。
优化体外循环设计血液通过内瘘穿刺针或导管进出体内,伴随血泵和透析器的压力,会产生机械应力,激活血细胞,释放炎症因子。用于HD的标准血泵已从小型3头逐渐变为2头蠕动旋转泵。有研究表明,当泵前压达到-150 mmHg,血流量增至300 mL/min时会增加溶血的风险[28]。使用较低泵速,结合旋转和活塞技术的穿梭泵,可减少对血细胞的应力损伤[29]。凝血易发生在ECC的湍流点及气血接触处,因此,管路内径应恒定而光滑,减少三通接头的插入。动脉/静脉壶因较大的气血接触面积增加了凝血风险。在可穿戴透析设备中,通过透气、不透水的塑料管路来替代这一结构去除微气泡[30]。
上机前充分预充管路可提高生物相容性。目前用于制造体外循环管路、液体包装的聚合物多采用可降解生物材料,已逐渐替代了聚氯乙烯,但残存的有机物仍可从塑料管路和透析器接头中渗入患者体内,在上机后不久患者呼出的气体中壬烷、氯乙烷、L-丁烷和二氯甲烷含量增加[31]。尽管环氧乙烷消毒引发过敏反应发生率不高,但持续使用导致嗜酸性粒细胞轻度升高并不少见,因而,目前已不建议环氧乙烷用于透析器消毒。
小结:血液不相容性是所有接触血液的设备和治疗的必然结果。在复杂的HD治疗中,血液离开血管环境,可同时发生多种反应,并有多种因素参与。中空纤维透析器与血液接触面积最大,所以在血液不相容性中发挥最重要的作用。早期HD相关血液相容性的研究领域主要集中在抗血栓性,后来逐渐发现HD过程中伴随着补体激活、白细胞减少和炎症因子释放,目前已成为科学研究、评估HD相关血液相容性的重要方面,加强对HD血液不相容性的机制探索和全面认识,进而通过系列措施减轻血液不相容性,对于改善HD患者预后具有重要意义。

