司库奇尤单抗与阿达木单抗治疗强直性脊柱炎疗效比较
黄雪艳,宋明辉,林睿敏
作者单位: 365000 福建省三明市第一医院风湿免疫科
强直性脊柱炎(AS)是由于遗传、环境等因素激活自身免疫反应,导致肌腱韧带附着点发生炎性反应,并进一步发展为肌腱韧带钙化、附近骨质破坏融合的疾病,影像学检查可见脊柱竹节样改变,最终引起活动受限[1]。目前临床尚无完全根治AS的方法,多以控制疾病进展、缓解临床症状、维持现有功能为主[2]。非甾体抗炎药是AS患者的常用药物,其可在一定程度上缓解疼痛,缩小关节受限范围,但由于AS病程长,长期服用该药易出现耐药性,减弱疗效[3],因此,生物制剂类药物成为对非甾体抗炎药治疗无效患者的首选治疗。抗肿瘤坏死因子-α(TNF-α)拮抗剂是临床治疗AS患者常用生物制剂[4-6],其中司库奇尤单抗是常用于治疗银屑病的白介素类生物制剂,后逐渐将其治疗靶向扩大至AS患者[7],目前使用此药治疗AS患者的研究甚少。基于此,现比较司库奇尤单抗与阿达木单抗治疗AS的临床疗效,报道如下。
1 资料与方法
1.1 临床资料 选取2021年2月—2022年10月三明市第一医院收治的AS患者100例,按照随机数字表法分阿达木单抗组(n=50)与司库奇尤单抗组(n=50)。阿达木单抗组中男39例,女11例;年龄20~50(38.90±7.12)岁;体质指数(BMI)18.8~26.1(21.61±2.33)kg/m2;平均病程(32.61±4.34)周。司库奇尤单抗组中男38例,女12例;年龄20~50(38.50±7.86)岁;BMI 18.0~26.4(21.32±2.12)kg/m2;平均病程(31.81±5.11)周。2组临床资料比较,差异无统计学意义(P>0.05),具有可比性。本研究经医院伦理委员会审核批准。
1.2 病例选择标准 纳入标准:(1)符合《强直性脊柱炎的诊断与治疗》[8]中的AS诊断标准,具体如下:①腰背痛发生时间>3个月,疼痛可在活动后缓解;②腰部前屈、后伸、侧屈、旋转活动受限;③胸廓扩展范围小于健康同龄者;④Schober试验及枕墙和指地试验均为(+);⑤影像学检查显示骶髂关节发生病理性改变。(2)年龄>18岁,且前期使用2种及以上非甾体药物治疗疗效不佳。(3)患者及家属签署知情同意书。排除标准:(1)关节严重畸形者;(2)合并类风湿关节炎、系统性红斑狼疮等其他风湿性疾病者;(3)合并严重原发性全身系统疾病者;(4)合并十二指肠或胃严重糜烂或溃疡者;(5)妊娠期妇女;(6)意识障碍者;(7)对本研究药物过敏者。
1.3 治疗方法 阿达木单抗组给予阿达木单抗注射液(海正生物制药有限公司生产)40 mg/次皮下注射,每2周注射1次,连续治疗3个月。司库奇尤单抗组给予司库奇尤单抗注射液(Novartis Pharma Stein AG生产)150 mg/次皮下注射,前4周给药频率为1次/周,随后每4周给药1次,共治疗3个月。治疗期间,若患者出现症状加重或恶化则立即停药。
1.4 观察指标与方法 (1)脊柱功能评估量表:于治疗前与治疗3个月后,采用Bath强直性脊柱炎功能指数(BASFI)、Bath强直性脊柱炎计量指数(BASMI)评价2组患者脊柱功能,BASFI包括无辅助穿衣服、无辅助弯腰拾笔、无辅助站立、体力活动、无辅助高处取衣物、工作和家务等,总分100分;BASMI包括颈椎旋转、耳屏到墙壁距离、腰椎屈曲、最大踝间距、腰椎侧屈、血生化变化,轻度记1分,中度记2分,重度记3分。BASFI、BASMI越高则表明患者脊柱功能越差。(2)腰背部疼痛程度和晨僵持续时间:于治疗前与治疗3个月后,采用视觉模拟评分法(VAS)评价患者腰背部疼痛程度,评分范围0~10分,评分越高表明患者腰背部疼痛越严重;此外,记录2组患者晨僵持续时间。(3)实验室指标:于治疗前与治疗3个月后采集2组患者空腹静脉血8 ml,转速2 000 r/min离心12 min,分离血清后存放于-70 ℃低温环境中保存,采用酶联免疫吸附法检测C反应蛋白(CRP);应用全自动血沉抗压积测试仪检测红细胞沉降率(ESR)。(4)不良反应。
1.5 疗效评定标准 参考《强直性脊柱炎长期管理专家共识(2021年)》[9]评判疗效:治疗后,患者背部、腰骶部疼痛消失,脊柱活动度恢复正常为治愈;患者背部、腰骶部疼痛减轻,脊柱活动度改善为好转;患者背部、腰骶部疼痛程度及脊柱活动度无改善甚至加重为无效。总有效率=治愈率+好转率。

2 结 果
2.1 临床疗效比较 司库奇尤单抗组总有效率为88.00%,高于阿达木单抗组的72.00%(χ2=4.000,P=0.046),见表1。

表1 阿达木单抗组与司库奇尤单抗组临床疗效比较 [例(%)]
2.2 BASFI、BASMI比较 治疗前,2组BASFI、BASMI比较,差异无统计学意义(P>0.05);治疗3个月后,2组BASFI、BASMI较治疗前下降,且司库奇尤单抗组低于阿达木单抗组(P<0.01),见表2。
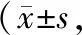
表2 阿达木单抗组与司库奇尤单抗组治疗前后BASFI、BASMI比较分)
2.3 腰背部VAS评分和晨僵持续时间比较 治疗前,2组腰背部VAS评分、晨僵持续时间比较,差异无统计学意义(P>0.05);治疗3个月后,2组腰背部VAS评分较治疗前降低,晨僵持续时间较治疗前缩短,且司库奇尤单抗组降低/缩短幅度大于阿达木单抗组(P<0.01),见表3。

表3 阿达木单抗组与司库奇尤单抗组治疗前后腰背部VAS评分和晨僵持续时间比较
2.4 实验室指标比较 治疗前,2组血清CRP水平与ESR比较,差异无统计学意义(P>0.05);治疗3个月后,2组血清CRP水平与ESR较治疗前下降,且司库奇尤单抗组低于阿达木单抗组(P<0.01),见表4。

表4 阿达木单抗组与司库奇尤单抗组治疗前后实验室指标比较
2.5 不良反应比较 司库奇尤单抗组治疗期间不良反应总发生率为4.00%(2/50),包括1例头晕头痛、1例呼吸道感染;阿达木单抗组不良反应总发生率为12.00%(6/50),包括1例发热、1例尿道感染、2例呼吸道感染、2例头晕头疼。2组不良反应总发生率比较,差异无统计学意义(χ2=1.223,P=0.269)。
3 讨 论
AS最先发病部位通常为骶髂关节,早期进行骶髂关节影像学检查是诊治的关键,但多数患者对该病的认知水平较低,未引起足够重视,随着疾病进展,患者逐渐出现外周关节病变,多为髋、膝、踝、肩关节肌腱附着点处,表现为病变处疼痛、关节活动度减小,若不及时干预可出现腰背部疼痛、活动受限,严重者可出现不可逆性中轴关节病变。AS目前尚无确切的发病机制。有研究表明,AS发病率在一般人群仅为0.1%,而AS患者的亲属患病率达4%,有明显家族聚集倾向,且与人体白细胞抗原B27(HLA-B27)有一定关联,90%的AS患者体内HLA-B27检测呈阳性,虽然目前并未证实HLA-B27阳性可导致AS,但发现HLA-B27阳性者AS发生风险更高[10-11]。目前临床针对AS患者的药物治疗有非甾体抗炎药、生物制剂、糖皮质激素等,其效果存在个体性差异。生物制剂作为目前治疗AS疗效较佳的药物,其可有效改善患者外周病变症状,降低炎性因子水平,大幅度缓解患者身心痛苦。少数AS患者经抗TNF-α拮抗剂治疗无效,且使用此类药物会增加呼吸系统及其他器官感染发生风险。综合有效性、安全性、经济性及便利性,阿达木单抗更占优势[12]。随着医学的发展,司库奇尤单抗作为全球唯一的全人源白介素-17A(IL-17A),对人体免疫功能的影响较小,相比于传统生物制剂,其感染发生风险较低,可较有效的抑制新骨形成,延缓中轴关节病变进展[13]。
本研究结果显示,治疗3个月后司库奇尤单抗组总有效率高于阿达木单抗组,BASFI、BASMI低于阿达木单抗组,表明司库奇尤单抗治疗AS的疗效优于阿达木单抗,其可更有效地改善患者的脊柱功能。此外,治疗3个月后司库奇尤单抗组腰背部VAS评分低于阿达木单抗组,晨僵持续时间短于阿达木单抗组,可见与阿达木单抗相比,司库奇尤单抗组治疗AS可更有效地缓解患者腰背部疼痛程度,缩短晨僵持续时间,分析原因为:肿瘤坏死因子可促进破骨细胞生成,从而对关节造成损伤,还可通过加重炎性反应导致局部组织水肿,而司库奇尤单抗通过抑制肿瘤坏死因子更有效地减轻炎性反应,从而改善脊柱功能,缓解腰背部疼痛,缩短晨僵持续时间。IL-17A是银屑病主要的炎症通路,司库奇尤单抗治疗银屑病可通过有效抑制IL-17A细胞分化、增殖,将角质形成细胞与细胞中IL-17A结合,以降低TNF-α水平,从而达到治疗的目的。王月明等[14]、刘芳宏等[15]研究表明,IL-17A能够激活树突状细胞、巨噬细胞释放TNF-α,加重炎性反应,抑制免疫系统,从而促进AS病情恶化;另有研究表明,IL-17A水平升高与血清CRP水平、ESR呈正相关,活动期患者血液循环加快,血清CRP水平与ESR降低,炎性因子随血液循环得以稀释,故AS患者在活动期疼痛可缓解。本研究结果显示,治疗3个月后司库奇尤单抗组血清CRP水平与ESR低于阿达木单抗组,且2组不良反应总发生率比较无统计学差异,可见与阿达木单抗相比,司库奇尤单抗治疗AS可更有效地减轻机体炎性反应,降低ESR,且安全性较高。阿达木单抗可抑制肿瘤坏死因子的生物活性,从而阻断了肿瘤坏死因子介导的细胞反应,使血清CRP水平与ESR降低,但司库奇尤单抗可直接作用于IL-17A,通过精准靶向抑制IL-17A分化减少TNF-α生成,故可更有效地减轻炎性反应,从而提高疗效。
综上所述,与阿达木单抗相比,司库奇尤单抗治疗AS的疗效更佳,能更有效地改善患者的脊柱功能,减轻患者腰背部疼痛,缩短晨僵持续时间,且安全性较高。
利益冲突:所有作者声明无利益冲突。

