二氧化碳-甲烷干气重整反应及其积炭控制的热力学分析
钱慧琳,冉金玲,何安帮,张爱红,刘作华,杜 军,陶长元
(1.重庆大学 化学化工学院,重庆 401331;2.重庆大学 煤矿灾害动力学与控制国家重点实验室,重庆 400044)
工业的快速发展消耗了大量不可再生的传统化石能源,如煤炭、石油等,显著增加了二氧化碳(CO2)的不可逆排放,导致了资源枯竭和环境问题[1-3]。二氧化碳-甲烷(CH4)干气重整(Dry reforming of methane,DRM)是碳捕集、利用及封存(CCUS)框架内一种典型的低碳过程。其产物合成气(n(H2)/n(CO)约为1.00)可通过成熟的费托工艺转化为清洁液体燃料和高价值化学品[4-6],符合绿色化工要求,具有高效利用C1资源与保护环境的双重效益。
CO2、CH4都具有较高的热力学稳定性,在高温下活化不仅会导致反应过程的能耗较高,还会在反应中生成积炭,导致转化速率衰减、选择性降低以及催化剂失活等问题。因此,高能耗和积炭是目前DRM 反应工业化所面临的主要瓶颈[4,7-9]。DRM 反应常用的Ni 基催化剂表面有3 种不同类型的积炭[10-12],包括300 °C以下生成的无定形炭(Cα),其活性高、易气化;300~500 °C 主要生成的丝状炭(Cβ);650 °C以上生成的石墨炭(Cγ),其活性最差。其中,Cβ和Cγ是长时间高温反应下造成催化剂失活的主要炭物种[13-15]。然而,DRM 的积炭与消炭行为尚未明晰,主导反应积炭的主要过程难以准确界定,导致催化剂的设计缺乏可靠的理论依据。NⅠKOO等[16]使用Aspen Plus 软件对DRM 积炭行为进行了热力学分析,发现DRM 的积炭温度范围较宽,而在重整过程中增加O2的含量,能够降低低温下炭生成的风险。CHALLⅠWALA 等[17]将干气重整与蒸汽重整、部分氧化重整结合,使用Matlab 软件进行了热力学计算,得到在750 °C、100 kPa 的条件下,当n(CH4)/n(H2O)/n(O2)/n(CO2) = 1.0/0.4/0.3/1.0 时,可以抑制积炭的生成。因此,不同反应温度、进料比(n(CH4)/n(CO2))和反应压力下的热力学计算,以及对积炭控制临界操作条件的研究,将有助于阐明DRM反应的积炭与消炭行为,设计出在最优热力学操作条件下能够有效抑制积炭的催化剂。
本文通过热力学计算软件FactSage,基于吉布斯自由能最小法,对DRM 反应进行热力学计算及分析,首先选用Reaction 模块计算出各主副反应进行的方向以及限度,选用Equilib模块计算出各组分反应平衡时的含量;进一步探究反应温度、进料比和反应压力对CH4、CO2转化率,H2、CO 选择性,产物组成以及积炭生成量的影响,并从热力学角度针对积炭问题作出积炭曲线和C-H-O三角图,得到控制积炭生成的临界操作条件,使DRM 反应位于最优非积炭区,以实现反应的高效、稳定进行。
1 热力学计算分析方法
1.1 吉布斯自由能最小法
吉布斯自由能最小法是获得任何反应体系平衡组成的常用方法。在无明确的动力学参数条件下,该方法仅需参与反应所有物种的特性参数,即可获得接近实际状况的产物分布。对于具有N种气体组分的复杂体系的总吉布斯自由能的计算方法见式(1)[18-20]:
式中,GT为系统总吉布斯自由能,kJ分别为系统中任一组分i的偏摩尔吉布斯自由能、标准生成吉布斯自由能,kJ/mol;ni为组分i在化学反应式中的化学计量系数;μi为组分i的化学势;R为气体常数,取值8.314J/(mol·K);T为热力学温度为混合物中组分i的逸度为标准状态下组分i的逸度,Pa。在气相系统中,使用拉格朗日乘数法,假设,每种气态物质的最小自由能的计算方法见式(2):
体系中的气态炭、固态炭的偏摩尔吉布斯自由能存在以下关系,见式(3):
当反应达到平衡状态时,总吉布斯自由能的微分为零。由于总吉布斯自由能总是在给定温度和压力的隔离系统中计算的,整个系统总吉布斯自由能的表达式见式(4):
式中,nC为系统中炭的量,mol。
1.2 Reaction和Equilib计算模块
DRM 反应体系复杂,副反应多[5,7],独立反应数为3,体系中的主要反应物和产物包括CH4(g)、CO2(g)、H2(g)、CO(g)、H2O(g)和C(s)。本文采用适用于分析多个同步反应的Reaction 模块,对各主副反应的可行性及反应限度进行热力学计算分析。在了解各反应热力学性质的基础上,选用化学平衡Equilib模块计算不同操作条件下反应达到平衡时6 个物种的含量,以此探究温度为600~1200 °C、进料比为0.50~2.00、反应压力为0.05~5.00 MPa 对DRM 反应过程中CH4、CO2转化率,H2、CO 选择性,产物组成以及积炭量的影响。
1.3 计算公式
选用热力学计算软件FactSage,基于吉布斯自由能最小法,对处于平衡状态的组分单相或多相进行分析。采用式(5)~式(10)评估DRM反应性能。
式中,Ci,in、Ci,out分别为组分i的进口量、出口量,mol;CC,out为炭的出口量,mol;XCH4、XCO2分别为CH4、CO2的 转 化 率,%;SH2、SCO分 别 为H2、CO 的 选 择性,%;n(H2)/n(CO)为产物合成气的组成;YC为积炭的生成量,%。
2 结果与讨论
2.1 DRM反应的热力学分析
2.1.1 反应温度对DRM反应的影响
DRM 反应涉及的主要化学反应见式(11)~式(16)[5,21]。使用FactSage 软件中的Reaction 模块,分析各反应的方向和自发程度。输入相应的化学反应方程式后,确定压力为常压、温度范围为25~1000 °C,以及升温步长为25 °C,即可得到相关热力学参数,并根据吉布斯自由能小于等于0 计算自发反应发生的温度。
不同温度下各主副反应的吉布斯自由能和DRM反应的热力学平衡曲线见图1。如图1(a)所示,主反应(式(11))是强吸热反应,高温低压有利于其正向进行,当温度高于642 °C时,反应在热力学上才是可行的。如图1(b)所示,逆水煤气反应(式(12))对平衡态下的主要产物H2和CO 的分布有显著影响,其会在一定程度上消耗反应物CO2和产物H2的量,使得体系中n(H2)/n(CO)小于1.00,以及CO2转化率高于CH4转化率,并在反应体系中生成H2O(g)。CH4裂解反应(式(13))和CO 歧化反应(式(14))是形成积炭的主要副反应。不同工况下积炭的来源不同,温度区间为548~700 °C 时积炭最严重;温度大于700 °C时,积炭的主要来源是CH4裂解,并一直伴随主反应发生。由式(14)~式(16)所示反应的逆反应可知,CO2(g)与H2O(g)均有利于消炭,因三者都是吸热反应,故温度越高越有利于消炭。

图1 不同反应温度下各主副反应的吉布斯自由能(a)和DRM反应的热力学平衡曲线(b)Fig.1 Gibbs free energy of primary and secondary reactions(a) and thermodynamic equilibrium curves of DRM reaction (b) at different reaction temperatures
2.1.2 进料比对DRM反应的影响
在温度范围600~1200 °C,考察了进料比对原料转化率和产物选择性的影响。由于DRM反应的强吸热特性,在所选的进料比范围(0.50~2.00)内,CH4、CO2转化率,H2、CO 选择性均随温度升高而增加,见图2。CH4转化率随进料比增大而降低,当进料比大于1.00 时,由于CO2是一种弱氧化剂,此时CH4转化率低于100%(图2(a))。同时,CO选择性也显著降低,当进料比分别为1.50和2.00时,CO选择性均小于80%(图2(d))。CO2转化率随进料比减小而降低,在进料比小于1.00时很难达到100%(图2(b)),这归因于CO2的热稳定性较高,其标准摩尔生成吉布斯自由能为-394.38 kJ/mol[22]。进料比大于或小于1.00时,H2选择性呈现不同趋势(图2(c))。当进料比大于1.00时,H2选择性随温度的升高而增加,并在900 °C以上达到100%;对于进料比小于1.00,H2选择性先随温度的升高而增加,到800 °C达到峰值后降低,主要原因是逆水煤气副反应(式(12))造成的选择性下降。因此,由于CH4、CO2的热力学惰性,从原子经济效益以及合适的反应速率来看,进料比为1.00最佳。

图2 进料比对CH4转化率(a)、CO2转化率(b)、H2选择性(c)和CO选择性(d)的影响Fig.2 Effect of feed ratio on CH4 conversion rate (a), CO2 conversion rate (b), H2 selectivity (c) and CO selectivity (d)
2.1.3 反应压力对DRM反应的影响
确定进料比为1.00,考察了反应压力对原料转化率和产物选择性的影响,见图3。高温对CH4转 化率、CO2转化率、H2选择 性 和CO 选择性都有积极影响,但反应压力升高却会带来负面影响。
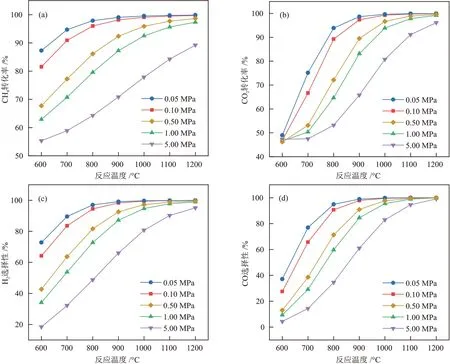
图3 反应压力对CH4转化率(a)、CO2转化率(b)、H2选择性(c)和CO选择性(d)的影响Fig.3 Effect of reaction pressure on CH4 conversion rate (a), CO2 conversion rate (b), H2 selectivity (c) and CO selectivity (d)
基于勒夏特列原理可知[21],反应压力升高使主反应(式(11))逆向进行,在特定温度范围下,转化率和选择性都表现出随反应压力增加而降低的趋势。值得注意的是,反应压力升高使CO歧化副反应(式(14))正向进行,不仅使CO选择性降低(图3(d)),还会加速积炭生成,对主反应体系不利,因此选择常压(0.10 MPa)操作最佳。
2.1.4 产物组成的调控
通过改变进料比和压力可以调整产物组成,获得合适的n(H2)/n(CO)以满足不同的费托合成工艺。在0.10 MPa 的条件下,计算了进料比对反应产物组成的影响(图4(a))。在所选进料比范围(0.50~2.00)内,产物n(H2)/n(CO)随温度升高而降低,并在温度为800 °C 或者高于800 °C 时趋于稳定。其中,在温度为700 °C或者高于700 °C时,产物组成n(H2)/n(CO)介于1.00~2.00,适用于费托工艺生产烯烃、重烃和含氧化合物[14,17]。此外,在同一温度下,n(H2)/n(CO)随进料比增加而增加,当进料比为2.00、温度小于700 °C时,反应产物n(H2)/n(CO)始终大于等于2.00,该产物组成适于用于烷烃(C1~C5)的合成[23]。

图4 进料比(a)和反应压力(b)对n(H2)/n(CO)的影响Fig.4 Effect of feed ratio (a) and reaction pressure (b) on n(H2)/n(CO)
在进料比为1.00时,计算了压力对反应产物组成的影响,见图4(b)。当温度低于900 °C时,n(H2)/n(CO)随反应压力的增大以及反应温度的降低而增加;当温度高于等于900 °C时,产物组成n(H2)/n(CO)受压力影响小,且产生的n(H2)/n(CO)接近1.00。其中,在温度高于等于700 °C时,产物组成n(H2)/n(CO)在1.00~2.50之间,适用于费托工艺生产高值液体产品[21]。
2.2 积炭控制的热力学分析
2.2.1 进料比和反应压力对积炭量的影响
在0.10 MPa 下考察了进料比对积炭量的影响(图5(a)),发现进料比显著影响形成非积碳区的温度。控制n(CH4)/n(CO2)为1.0/1.5 或1.0/2.0,反应达到平衡时的积炭生成量接近零,即在800 °C达到非积炭区。当增大原料气中CH4比例,使进料比大于1.00 时,在600~1200 °C 存在严重的积炭。因此,进料比越低,非积炭区的温度越低。考虑最佳的原料转化率和产物选择性,控制进料比为1.00,可在约1000 °C 实现非积炭区,此时产物组成n(H2)/n(CO)接近1.00,具有工业利用价值。
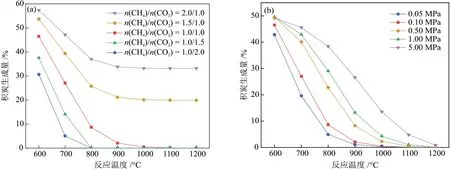
图5 进料比(a)和反应压力(b)对积炭生成量的影响Fig.5 Effect of feed ratio (a) and reaction pressure (b) on carbon deposition
较高的反应压力也将导致更严重的积炭产生(图5(b))。保持进料比为1.00,随着反应压力增加,炭生成曲线向高温区移动,即非积炭区由较低温度向较高温度转移。当反应压力分别为0.05 MPa、0.10 MPa 时,非积炭区的最低温度为1000 °C;当反应压力进一步增加,非积炭区的下限温度也随之升高。由于较高的操作温度需要消耗较高的能量,因此反应压力为0.10 MPa更利于DRM反应在较低的可行温度下进行,并保持体系在低积炭区域运行。
2.2.2 积炭控制的临界操作条件
反应压力为0.10 MPa,计算得到温度和进料比对积炭曲线的影响,见图6(a)。以组分中固态炭的残余量小于0.01%(物质的量分数)的曲线作为积炭区和非积炭区的分界线,曲线下方是积炭区,上方是非积炭区,只有高于特定临界温度才能抑制积炭生成。当进料比保持恒定时,升温有利于消除积炭;同一温度下,增大进料比有利于积炭消除,可见高温、高浓度CO2是消除积炭的关键因素。其中,当进料比为1.00 时,炭生成临界温度为1184 °C;当进料比为1.50时,炭生成临界温度为755 °C。

图6 进料比对积炭曲线的影响(a)、反应温度对各反应积炭生成量的影响(b)和DRM反应在C-H-O体系中的积炭区(c)Fig.6 Effect of feed molar ratio on carbon deposition curves (a), effect of reaction temperature on carbon deposition of each reaction (b) and carbon deposition zone of DRM reaction in C-H-O system (c)
反应压力为0.10 MPa,考察了4 个主要的积炭反应(式(13)~式(16))的积炭生成量随温度的变化趋势(图6(b))。在低于400 °C 的低温区,以3 个放热反应(式(14)~式(16))产生的积炭占主导,体系中的积炭生成量接近1.0 mol;在400~900 °C,4个积炭反应生成的积炭量对温度变化很敏感,式(14)~式(16)所示反应积炭生成量随温度升高逐步减少,而式(13)所示反应积炭量随温度升高逐步增多;在高于900 ℃的高温区,以吸热反应(式(13))甲烷裂解产生的积炭占主导,体系中的积炭生成量接近1.0 mol。因此选择900 °C这一典型温度进行讨论。
绘制C-H-O 元素三角图(图6(c)),首先在C-H和C-O连线上找到CH4(H/C = 0.8)和CO2(O/C ≈ 0.7)物种的组成点,连接表示DRM反应。然后以式(13)所示反应为主要积炭反应,计算得到900 °C下的主要产物为H2(H = 1.0)和CO(O/C = 0.5),绘出积炭线。可以看到,DRM反应与积炭线相交并划分出两个区域,积炭线的上部与DRM 反应构成的闭合区为积炭区,积碳线下部与DRM 反应构成的闭合区为非积炭区。参看三角图中DRM线和积炭线的交点,0.1 MPa、900 °C 下,进料比小于等于0.95 时,反应可进入非积炭区。积炭线越往上走,即O/C减小,此时用于与积炭反应的活性氧占比减少,将导致更严重的积炭,因此O/C越大,非积炭区域面积越大。同理,利用三角图能够计算不同反应温度下,非积炭区的最高进料比,见表1。如表1 所示,进料比越低,非积炭区温度越低,这与图6(a)的分析结果一致。
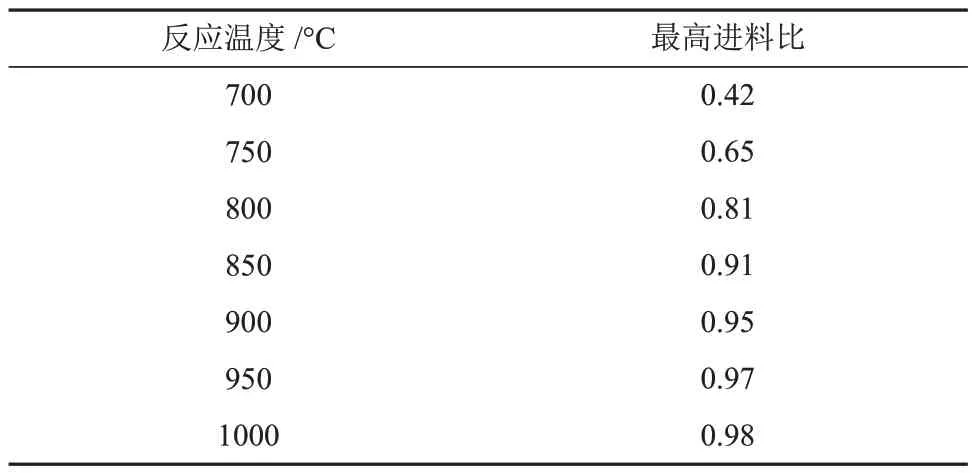
表1 不同反应温度下非积炭区的最高进料比Table 1 Maximum feed ratio in non-carbon deposition zone at different reaction temperatures
3 结论
采用FactSage 热力学软件对DRM 反应以及其积炭控制进行了热力学计算分析,得到如下主要结论。
(1)较低的进料比有利于获得较高的CH4转化率和CO选择性,但抑制了CO2转化率和H2选择性。考虑原子经济性,以及反应速率,进料比为1.00最佳。
(2)反应温度升高对提高CH4、CO2转化率和H2、CO 选择性,以及减少积炭有积极影响;反应压力升高对转化率、选择性不利,积炭增多,同一进料比下非积炭区温度增加,因此选择常压操作。
(3)n(H2)/n(CO)随反应温度的升高而降低,随进料比和反应压力的增加而增加。通过调节进料比和反应温度可优化n(H2)/n(CO),以满足费托工艺的需求。
(4)高温、高进料比和常压操作是抑制DRM反应积炭的关键。本研究从热力学角度提出了控制积炭的临界操作条件,通过调节反应物进料比,使反应落在C-H-O三角图的非积炭区,其中O/C越高,非积炭区域面积越大。虽然高进料比能有效改善积炭情况,但活化CO2所需能量较高。综合考虑原料转化率、产物选择性能,以及实现零积炭,工艺中合适的反应压力为0.10 MPa、反应温度为900 °C、进料比小于等于0.95,此时反应可位于非积炭区。

