活性炭/金属有机骨架复合吸附材料的制备及其CH4/N2吸附分离性能研究
宋志强,王玉高,张宇姝,张迎迎,杨江峰
(太原理工大学 化学工程与技术学院,山西 太原 030024)
为了解决日益突显的能源危机和环境污染问题,使用低碳的清洁能源对实现绿色可持续性发展具有长远意义[1-3]。甲烷(CH4)作为最现实的低碳能源,因燃烧时只产生二氧化碳(CO2)和水(H2O),目前在很多领域正在逐步替代部分煤炭和石油,一次能源占比不断升高[4]。CH4来源广泛,除了来自于常规的天然气资源,也可以从非常规天然气中获得,如煤层气、垃圾填埋气、沼气和页岩气等[5-7]。煤层气又称煤矿瓦斯,可以提供大量的CH4[8],但开采过程中会不可避免地混入空气(主要成分是N2),导致CH4的浓度降低[9-10],直接利用难度大,经常被直接排放到大气中,不仅浪费资源,还会加剧温室效应(CH4对全球变暖的潜在贡献值大约是CO2的21倍[11])。因此,将低浓度煤层气富集并提浓是实现CH4有效利用的重要前提[12-13]。
在煤层气富集过程中,由于CH4和N2的动力学直径相近,在低耗能的情况下实现高效分离仍然具有很大的挑战[14-15]。目前,低温蒸馏、膜分离和变压吸附(PSA)是3 种主要的分离技术[16-18]。其中,PSA具有能耗低、操作简单和目标产品纯度高等优点,是一种可广泛应用的分离技术[19]。PSA分离技术的核心是吸附剂,选择合适的吸附剂高效分离CH4/N2混合物是实现煤层气高效利用的重要方案,常见的吸附剂有分子筛、金属有机骨架(MOFs)和活性炭(AC)[20-21]。MOFs具有丰富的孔隙率和可调控的表面性质,在气体吸附分离方面表现出巨大的应用潜力[22-23]。其中,一些MOFs在分离CH4/N2混合物时表现出高选择性,能够有效富集低浓度CH4,如HU等[24]报道了具有一维微通道的Cu(ⅠNA)2,CH4吸附量为0.8 mmol/g,CH4/N2选择性高达8.34,实现了低浓度CH4的有效分离与富集,但由于存在原材料及生产成本高和产品稳定性差等问题,较难进行工业化应用和推广。AC具有比表面积高、吸附量大、稳定性好且价格低廉等优点,是分离CH4/N2混合物研究最多的吸附材料[25]。如QU 等[26]用生椰壳制备的AC的CH4吸附量高达1.59 mmol/g,但CH4/N2选择性仅为3.20; ZHANG 等[27]利用含氮聚合物制备了多孔碳,其在298 K、100 kPa 条件下,CH4吸附量高达1.57 mmol/g,而CH4/N2选择性仅为4.20。由此可见,AC存在CH4/N2选择性低的缺点,较难实现高效分离。
因此,制备一种兼具高CH4吸附量和高选择性的廉价吸附剂成为实现有效分离纯化CH4的关键所在[15,28-29]。MOFs 与AC 进行复合的方案,有望实现两种材料的优势互补,进一步提升其在气体吸附分离方面的经济性及应用价值。本文选取具有高CH4/N2选择性的Cu(ⅠNA)2和高CH4吸附量的廉价商业AC 进行研究,采用不同于传统“一锅法”的逐步合成法,通过将AC 依次加入一定浓度的Cu2+溶液中作浸渍处理,再放入未添加金属源的MOFs 配体溶液中反应来制备AC/Cu(ⅠNA)2复合材料,利用X射线衍射(XRD)、傅里叶变换红外光谱(FT-ⅠR)、热重分析(TGA)和扫描电子显微镜(SEM)等测试方法对其进行表征,并详细考察AC/Cu(ⅠNA)2复合材料的CH4/N2吸附分离性能。
1 实验部分
1.1 实验试剂与材料
三水硝酸铜(Cu(NO3)2•3H2O),AR,国药集团化学试剂有限公司;异烟酸(HⅠNA),AR,上海阿拉丁生化科技股份有限公司;颗粒状活性炭(AC),上海阿拉丁生化科技股份有限公司;硝酸(HNO3),AR,国药集团化学试剂有限公司;无水乙醇(C2H6O),AR,国药集团化学试剂有限公司;实验用水为去离子水。以上试剂在使用前均未经任何纯化处理。
1.2 样品制备
Cu(ⅠNA)2的制备:参照文献[30]中的合成方法,将Cu(NO3)2•3H2O(0.121 g,0.5 mmol)和HⅠNA(0.123 g,1.0 mmol)加入装有5 mL 去离子水和5 mL 无水乙醇的混合溶液中,在室温下超声30 min,随后将其放入80 °C的烘箱中反应24 h,待反应完成后冷却至室温,用等体积比的去离子水和无水乙醇的混合溶液洗涤3 次,最后放入80 °C 的恒温鼓风烘箱中干燥12 h,得到的蓝色晶体为Cu(ⅠNA)2。
AC/Cu(ⅠNA)2复合材料的制备:将AC用去离子水煮沸30 min,再用去离子水洗涤多次后干燥24 h,然后将AC 和7 mol/L 的HNO3溶液按1.000 g AC 与5 mL HNO3的比例混合后在90 °C下恒温油浴回流6 h,用去离子水洗涤3次,放入烘箱干燥24 h,得到的样品为AC-1。将AC-1 放入一定浓度的Cu(NO3)2•3H2O溶液中,在室温下搅拌浸渍6 h,用去离子水洗涤3次后过滤干燥12 h,得到的样品为AC-2。将AC-2 和HⅠNA(0.123 g,1.0 mmol)放入装有5 mL 去离子水和5 mL 无水乙醇的混合溶液中,在室温下超声30 min,随后将其放入80 °C 的烘箱中反应24 h,待反应完成后冷却至室温,用相同体积去离子水和无水乙醇配制的混合溶液洗涤3次,最后放入80 °C的烘箱中干燥12 h,得到的复合材料为AC/Cu(ⅠNA)2。
1.3 样品结构表征
XRD 表征:采用德国Bruker D8 ADVANCE 型X 射线衍射仪分析样品的晶相结构,以Cu-Kα为靶源(λ= 0.15418 nm),在工作电压和工作电流分别为40 kV 和40 mA 的条件下,选取2θ= 5°~40°的范围用步长0.02°进行测试。
N2吸/脱附曲线和孔径分布表征:采用美国麦克Micromeritics ASAP 2460 型吸附仪在77 K 下测定,样品测试前需要在473 K下抽真空活化8 h,使用比表面积(BET)法和孔径分布(BJH)法测得相关结构参数(比表面积、孔体积和孔径等)。
FT-ⅠR表征:采用德国Bruker ⅠNVENⅠO-R型红外光谱分析仪进行测试,测试前需要将样品和溴化钾充分干燥并混合均匀压片,测试范围为400~4000 cm-1。
TGA 表征:采用德国Netzsch STA449 F5 型热重分析仪在N2气氛下,以10 K/min的升温速率及温度区间为25~800 ℃进行测试。
SEM 表征:采用日本Hitachi SU8010 型场发射扫描电镜进行测试,工作电压为15 kV,样品需在测试前进行喷金处理。
1.4 气体吸附性能测试
CH4和N2的单组分气体吸附等温线采用Micromeritics ASAP 2460 测定,样品测试前需要在473 K下抽真空活化8 h,然后分别在273 K和298 K下进行CH4和N2的单组分气体吸附测试,压力范围为0~100 kPa,称取的样品质量为0.1 g左右。
1.5 选择性和吸附热计算
CH4和N2的选择性计算采用理想吸附溶液理论(ⅠAST)[31],根据单组分气体吸附等温线,采用Dual-Site Langmuir模型(式(1))分别对298 K和273 K下CH4/N2混合气体(V(CH4)/V(N2) = 1)的混合气体进行拟合。
式中,q为气体组分的摩尔吸附量,mol/kg;pv为气体组分压力,kPa;下标1、2为不同组分气体;q1、q2为饱和位点吸附量,mol/kg;b1、b2为Langmuir常数。
根据拟合参数,采用式(2)计算材料对CH4/N2混合气体(V(CH4)/V(N2) = 1)的选择性。
式中,Sads为两组分的选择性;p1、p2为混合气中气体的分压,kPa。
吸附热是衡量吸附剂与吸附质之间相互作用能大小的一个重要参数[32],采用Clausius-Clapeyron方程(式(3))计算材料与CH4和N2之间的相互作用能大小。
式中,Qst为吸附热,kJ/mol;p为气体压力,kPa;T为气体温度,K;R为常数,8.314 J/(mol·K);n为气体吸附量,mmol/g。
2 结果与讨论
2.1 合成策略分析
采用逐步合成法,将AC 在一定浓度的Cu2+溶液中浸渍一段时间,再放入未添加金属源的MOFs配体溶液中进行溶剂热反应来制备AC/Cu(ⅠNA)2复合材料(图1)。此方法尽可能地避免了AC/Cu(ⅠNA)2和Cu(ⅠNA)2物理混合相的存在,便于得到纯AC/Cu(ⅠNA)2复合材料。由图2可知,AC表面有蓝色晶体紧紧附着,也可知AC/Cu(ⅠNA)2复合材料可能存在配位的结合方式。
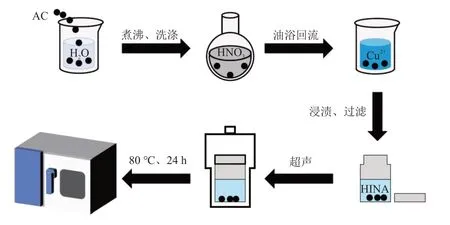
图1 AC/Cu(INA)2复合材料制备过程示意Fig.1 Schematic diagram of preparation process of AC/Cu(INA)2 composite materials
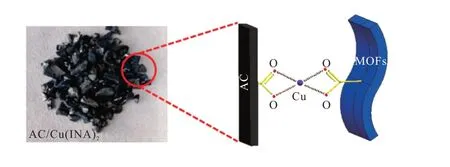
图2 AC/Cu(INA)2复合材料与结构示意Fig.2 AC/Cu(INA)2 composite materials and schematic diagram of its structure
2.2 样品表征分析
2.2.1 XRD分析
对采用逐步合成法制备的AC/Cu(ⅠNA)2复合材料以及原材料AC 和Cu(ⅠNA)2进行了XRD 表征分析,结果如图3所示。
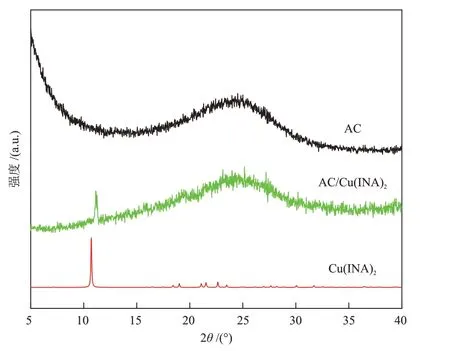
图3 样品的XRD谱图Fig.3 XRD patterns of samples
AC 在20°~30°有一个较宽的衍射峰,Cu(ⅠNA)2在10.7°有一个高强度的衍射峰。当AC与Cu(ⅠNA)2复合后,AC/Cu(ⅠNA)2同时出现两者的衍射峰,并且衍射峰(11.2°)与Cu(ⅠNA)2的衍射峰相比,发生一定程度的右移。通过以上对比分析,初步证明制备得到了AC/Cu(ⅠNA)2复合材料。
2.2.2 N2吸/脱附及孔径分析
样品在77 K下的N2吸/脱附曲线如图4(a)所示(标准温度压力下),所有的N2吸/脱附均为典型的Ⅰ型吸附等温线,在低压阶段,N2吸附量急剧上升,表明材料具有大量微孔,后续随着压力的增大,在等温吸/脱附曲线中有较小的磁滞回线,说明材料存在少量的介孔。在77 K下N2吸/脱附测试得出的样品孔隙结构性质如表1所示, AC/Cu(ⅠNA)2复合材料的比表面积和孔体积分别为519 m2/g和0.18 cm3/g,均介于原材料AC和Cu(ⅠNA)2之间。样品的孔径分布如图4(b)所示,AC的孔径主要分布在0.80 nm、1.06 nm、1.56 nm和1.88 nm处,Cu(ⅠNA)2的孔径主要分布在0.80 nm和1.52 nm处。
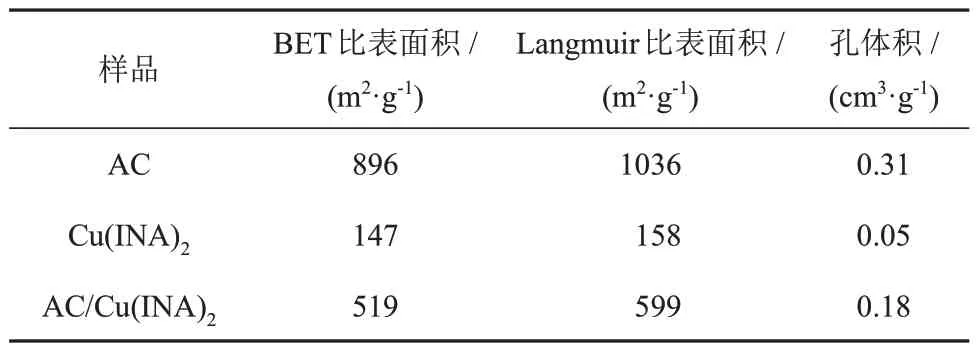
表1 样品的孔隙结构性质Table 1 Pore textural properties of samples
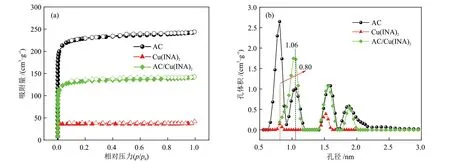
图4 77 K下样品的N2吸/脱附等温线(a)和孔径分布(b)Fig.4 N2 adsorption/desorption isotherms (a) and pore size distribution (b) of samples at 77 K
2.2.3 FT-ⅠR分析
为了探究样品表面的官能团情况,采用红外光谱仪在400~4000 cm-1进行了表征分析,结果如图5所示。
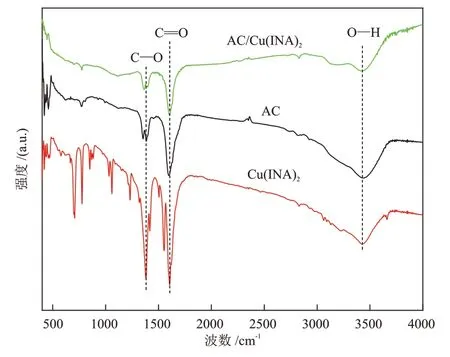
图5 样品的FT-IR谱图Fig.5 FT-IR spectra of samples
在3430 cm-1处有O—H 键吸收峰,与表面吸附水的伸缩振动有关,在1400 cm-1处和1610 cm-1处的特征峰分别为O—C—O 键的对称振动吸收峰和C==O 键的不对称拉伸振动吸收峰,说明Cu(ⅠNA)2中具有配体的羧基官能团存在,同时也证实HNO3处理后的AC 表面具有羧基官能团,这对AC 表面Cu(ⅠNA)2的形成可能起着成核位点的作用[33],有利于AC和Cu(ⅠNA)2的结合。
2.2.4 TGA分析
在N2气氛下对样品的热稳定性进行了热失重分析,样品的TGA曲线如图6所示。
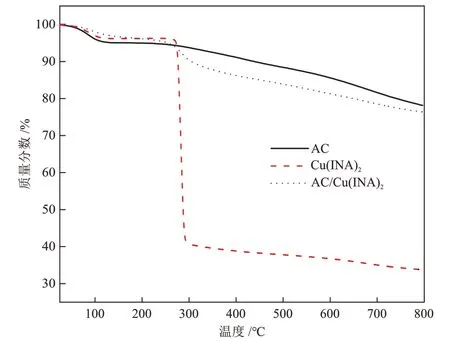
图6 样品的TGA曲线Fig.6 TGA curves of samples
由图6可知,3种样品在120 °C之前均有一次失重,主要是样品中的水分子及孔道中残留的溶剂分子的脱除。Cu(ⅠNA)2和AC/Cu(ⅠNA)2均在270 °C发生第二次失重,主要是Cu(ⅠNA)2骨架结构开始发生分解,AC/Cu(ⅠNA)2与原材料Cu(ⅠNA)2相比,在270 °C附近的失重率随着温度的持续升高而减小,表明AC/Cu(ⅠNA)2复合材料的热稳定性有所改变,推测主要原因是AC负载Cu(ⅠNA)2所致,说明Cu(ⅠNA)2在AC上的负载量对AC/Cu(ⅠNA)2材料的热稳定性有影响。
2.2.5 SEM分析
采用SEM对样品的微观形貌进行了观察,结果如图7所示。

图7 样品的SEM照片Fig.7 SEM images of samples
由图7可知,AC表面光滑,并且有1 μm左右的孔存在(图7(a)),Cu(ⅠNA)2的晶体形貌规整,呈柱状多面体(图7(b))。通过研究AC/Cu(ⅠNA)2复合材料在不同尺度下的微观形貌,发现AC表面变粗糙,生长了大量不规则的晶体(图7(c)和图7(d))。以上结果表明,AC 表面能够负载Cu(ⅠNA)2,并使晶体的形貌发生显著改变。
2.3 气体吸附性能分析
为了研究样品对单组分气体吸附性能,分别测试了AC、Cu(ⅠNA)2和AC/Cu(ⅠNA)2在100 kPa、298 K和100 kPa、273 K 条件下对CH4和N2的吸附等温线,结果如图8 所示。随着压力的增大,3 种样品的CH4和N2吸附量均呈上升趋势,且CH4吸附量均高于N2。其 中,AC/Cu(ⅠNA)2复 合 材 料 的CH4吸 附量相比于原材料AC 和Cu(ⅠNA)2,在不同温度条件下均有一定程度的下降,但仍然维持在较高的水平,在100 kPa、298 K 和100 kPa、273 K 下分别是12.6 cm3/g 和18.1 cm3/g,而AC/Cu(ⅠNA)2的N2吸附量维持在较低水平,甚至在273 K下低于Cu(ⅠNA)2,表明AC/Cu(ⅠNA)2复合 材料 是 一 种 较好 的CH4型 吸附剂。同时,结合AC/Cu(ⅠNA)2的吸/脱附曲线来看,未出现明显的脱附滞后现象,说明AC/Cu(ⅠNA)2复合材料能够较好地实现降压完全脱附。
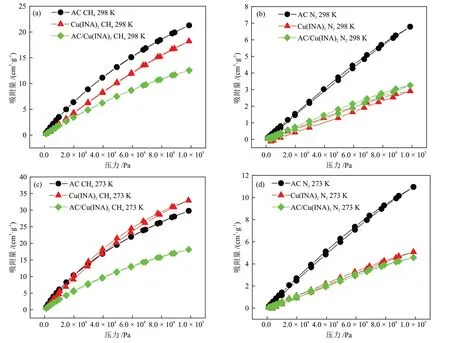
图8 样品的CH4和N2吸附等温线Fig.8 CH4 and N2 adsorption isotherms of samples
2.4 选择性和吸附热计算及分析
通过Dual-Site Langmuir模型拟合计算了298 K和273 K 下CH4/N2混合气体(V(CH4)/V(N2) = 1)的ⅠAST选择性,进一步研究了其在分离方面的性能,结果见图9。从图9(a)中可以看出,在100 kPa、298 K下,AC、Cu(ⅠNA)2和AC/Cu(ⅠNA)2选择性分别为4.7、8.2和5.5,说明AC/Cu(ⅠNA)2具有较高水平的CH4/N2选择性,并且与AC的选择性相比,其选择性增大了17.3%。从图9(b)中可以看出,在100 kPa、273 K下,AC、Cu(ⅠNA)2和AC/Cu(ⅠNA)2的 选 择 性 分 别 为4.8、10.6 和6.6,与100 kPa、298 K 下的选择性相比,Cu(ⅠNA)2和AC/Cu(ⅠNA)2的选择性显著提升。此外,对相关材料在不同温度下的选择性进行了总结(表2)。以上分析说明,高容量的AC 与高CH4/N2选择性的Cu(ⅠNA)2复合,能够实现两种材料的优势互补,在保持吸附剂低成本、较高吸附量的前提下,较大幅度地提升其在CH4/N2分离方面的选择性。
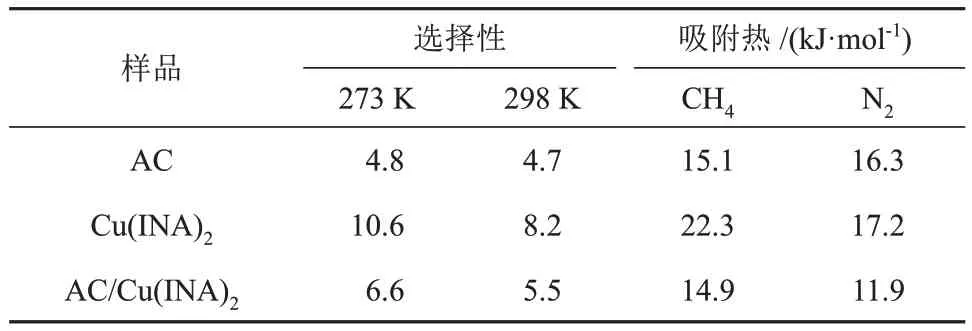
表2 样品在100 kPa下的CH4/N2 IAST选择性及对CH4、N2的吸附热Table 2 IAST selectivity of CH4/N2 and adsorption heat on CH4 and N2 of samples at 100 kPa
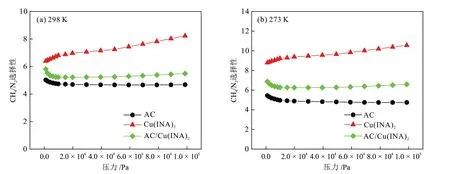
图9 样品在298 K (a)和273 K (b)下的CH4/N2 IAST选择性Fig.9 IAST selectivity of CH4/N2 of samples at 298 K (a) and 273 K (b)
研究吸附剂与吸附质之间相互作用力的大小,对于评估吸附剂在气体分离过程中吸附选择性的趋势变化至关重要,根据上述吸附等温线,采用Clausius-Clapeyron 方程(式(3))计算了样品对CH4和N2的吸附热,结果如图10 所示,对CH4的吸附热顺序由大到小为Cu(ⅠNA)2(22.3 kJ/mol)、AC(15.1 kJ/mol)、AC/Cu(ⅠNA)2(14.9 kJ/mol),对N2的吸附热顺序由大到小为Cu(ⅠNA)2(17.2 kJ/mol)、AC(16.3 kJ/mol)、AC/Cu(ⅠNA)2(11.9 kJ/mol)。上述材料的吸附热数据总结如表2 所示,AC/Cu(ⅠNA)2对CH4和N2的吸附热均分别低于AC 和Cu(ⅠNA)2,说明其能够更好地实现完全脱附,而且其对CH4的吸附热变化趋势与AC 保持一致,吸附热随着吸附量的增加而降低,表明活性高的位点会被CH4优先吸附占据,而其N2的吸附热与Cu(ⅠNA)2的变化趋势一致,这个特点正好与AC/Cu(ⅠNA)2的N2吸附量接近于Cu(ⅠNA)2的 特 点 相 同。此 外,AC/Cu(ⅠNA)2的CH4吸附热高于N2,表明其对CH4的作用力更强,是CH4型的复合吸附材料。
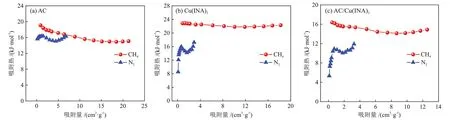
图10 样品在298 K下的CH4和N2吸附热Fig.10 Adsorption heats of CH4 and N2 of samples at 298 K
3 结论
本文利用逐步合成法制备了AC/Cu(ⅠNA)2复合材料,并研究了AC/Cu(ⅠNA)2复合材料的结构特征以及在CH4/N2吸附分离方面的性能,得出以下结论。
(1)制备的Cu(ⅠNA)2已负载在AC上的AC/Cu(ⅠNA)2复合材料实现了MOFs和AC结合。相比原材料AC和Cu(ⅠNA)2,AC/Cu(ⅠNA)2复合材料的孔隙结构性质、热稳定性和微观形貌均有明显变化。
(2)在100 kPa、298 K下,AC/Cu(ⅠNA)2复合材料的CH4/N2选择性达到5.5,与AC的选择性相比,提升了17.3%,并且保持了良好的CH4吸附量(12.6 cm3/g)和CH4吸附热(14.9 kJ/mol),能够高效分离CH4/N2。
AC/Cu(ⅠNA)2复合材料在保持低成本和较高吸附量的前提下,能够较大幅度地提升其在CH4/N2分离方面的选择性,具有进一步工业化应用前景,并为创制具有良好经济性、吸附分离性能的新型CH4/N2吸附剂提供了新的研究思路。

