汗液中葡萄糖的SERS快检
冯 笛,张凡利,金尚忠
(中国计量大学 光学与电子科技学院,浙江 杭州 310018)
葡萄糖是自然界分布最广且最重要的一种单糖,也是活细胞的直接能量来源。人体中葡萄糖含量不足会导致低血糖,严重时或致记忆力衰退、诱发癫痫、影响大脑活动致使昏迷等,但可通过改善饮食条件在短期内获得补充。而葡萄糖含量过多则会引发糖尿病及其并发症等。据国际糖尿病联盟(IDF)统计,2021年全球糖尿病人数约为5.37亿(20~79岁),其中中国就有约1.4亿。糖尿病可引起约100多种并发症,如心肌梗死、视网膜病变、糖尿病足等。据统计,近年来死于糖尿病及其并发症的人数已超过死于艾滋病、结核病和疟疾等人数的总和。而治疗糖尿病最重要的也是第一步便是监测血糖水平,这将极大地提高患者的生活质量,并有助于患者了解自身状况及预防并发症。
1 葡萄糖检测方法概述
1.1 酶促方法
目前检测葡萄糖的临床方法是血糖检测,血液样本被提供在含有氧化酶的条带或底物上,一般是血糖试纸,然后通过测量酶底物的电学或光学变化来监测反应通量。这种方法是侵入性的,其不仅造成了生理上的损伤和心理负担,而且血检可能造成疾病传播、保存追溯时效短、需要专业的医护人员操作等。尿糖检测虽然无损,但可能会造成假阳性和假阴性的结果。目前家用式自测血糖仪的成熟使得血糖监测更加方便,但也存在一些缺点,如修饰有氧化酶的试纸寿命一般为两年,环境压力、温度、氧化等会导致其寿命进一步缩短,且不洗手操作会进一步降低测量准确性。另外,在自行测试规范且试纸质量没问题的情况下,大量不符合标准的血糖仪被生产出来并投入使用导致检测结果的精度很差。
1.2 非酶促方法
基于酶促反应的葡萄糖检测虽然对葡萄糖是特异性的,但是需要定期更换底物和酶等原料。非酶促葡萄糖检测也是研究的焦点,因为它们增加了检测的稳定性和检测精度并降低了维护成本[1-3],并有可能无创地检测葡萄糖[4]。非酶促葡萄糖检测可分为两种:基于人工酶的电化学检测和物理检测。人工酶与电化学检测相结合类似于酶促方法,但使用专门的电极表面来代替酶,主要是通过葡萄糖分子和电极之间的电子转移的直流电测量来检测葡萄糖浓度[4-6]。物理检测葡萄糖是基于检测葡萄糖分子的特定性质,通常是用频率分辨技术和光谱学来完成的。频率分辨技术如阻抗和太赫兹光谱等,这些技术监测样品对调制电场的响应[7]。光谱学方法包括红外、荧光和拉曼光谱。光谱学检测是由于光与分子的相互作用对其化学结构非常特定,入射到样品上的光可能被吸收、透射、反射或散射。
1.3 光谱学方法
荧光光谱是通过光激发分子来监测可见光的发射,然而葡萄糖分子不具有荧光特性,因此须和荧光分子结合来检测。在和葡萄糖的相互作用下荧光分子的发射波长会改变,通过信号的变化检测葡萄糖的浓度[8-10]。红外光谱研究分子振动对红外波段范围内辐射的吸收,分子吸收的波长对应于分子化学键特定振动和旋转的能量。葡萄糖的红外光谱检测具有一些困难和挑战,因为水的吸收峰掩盖了葡萄糖分子的信号[7,11-12]。拉曼光谱是通过用激光激发样品并检测拉曼散射光来完成的。虽然拉曼信号比红外弱,但水在拉曼光谱中没有突出的特征,红外是在透射中进行的,需要在红外波长范围内透明的基底,而拉曼光谱测量散射光,因此可以在任何表面上进行,这就使得可以使用增强拉曼信号的专用基底,也就是表面增强拉曼光谱(surface-enhanced Raman spectroscopy, SERS)技术。SERS在此所用到的增强机理主要是表面等离激元共振(SPR)[13],它的解释是处于贵金属纳米粒子之间的局域光电场中(即“热点”)的物质,其拉曼信号会被增强约105~106倍。
1.4 SERS检测葡萄糖的方案
SERS由于其高灵敏和指纹识别的特点,在克服了拉曼光谱缺陷的基础上已被广泛应用在生物医学[14-15]、食品安全[16-17]、环境监测[18-19]等领域。基于SERS检测葡萄糖总体来说有四种方案,已有众多科研工作者做出了努力。第一,制备增强因子很高的基底,使得葡萄糖分子的振动信息可直接被极大增强,所测信号也是葡萄糖分子本身的SERS信号[20]。第二,增加葡萄糖分子与基底结合的亲和力[21]。这两种方案都是针对葡萄糖分子拉曼散射截面小而做出的应对方法,虽然也取得了一定的成果,但在实际应用中依然存在局限性。第三,应用基于硼酸的识别分子功能化表面,葡萄糖可逆地形成硼酸酯,并被捕获在表面上。这样,硼酸分子既可以用作葡萄糖识别结构,也可以用作拉曼活性分子[22]。第四,基于信号分子的酶促反应[23-25],葡萄糖与葡萄糖氧化酶(GOx)反应产生的H2O2会刻蚀修饰有信号分子的银纳米粒子,进而导致信号分子的SERS信号降低,葡萄糖的摩尔浓度与信号分子的SERS信号呈现反比。这种方案也是目前基于SERS检测葡萄糖的主流方案,本文也基于此开发了一种银立方体(Ag cube)基底和酶促反应相结合的汗液中葡萄糖快检的方法,检测时间约为7 min,检测限为0.5 mmol/L。
2 材料与方法
2.1 材料
人工汗液购自上海源叶生物科技有限公司;GOx购自北京索莱宝科技有限公司;葡萄糖、PVP(55 000)、1,5-戊二醇、CuCl2、AgNO3购自中国国药集团化学试剂有限公司;去离子水(18.25 MΩ·cm)。
2.2 Ag cube的合成
溶液a:CuCl2溶液,称取18 mg的CuCl2溶于50 mL的1,5-戊二醇;溶液b:AgNO3溶液,称取0.4 g的AgNO3溶于含1 mL溶液a和9 mL的1,5-戊二醇中;溶液c:PVP溶液,称取0.2 g的PVP(Mw=55 000)溶于10 mL的戊二醇中。溶液b和溶液c需要在冰浴中超声溶解4 h以上,直至完全溶解,超声过程中保持冰浴,每隔15 min取出搅拌一下。其中溶液a可配于离心管中,溶液b和c用25 mL锥形瓶配制。
Ag cube制备:首先取干净烘干的圆底烧瓶加入20 mL的1,5-戊二醇,在193 ℃中恒温10 min;然后取两只10 mL注射器,吸入适量的溶液b和溶液c,套上200 μL枪头和聚四氟管,放在双通道注射泵上;以500 μL/min的速率开始向恒温好的戊二醇中滴加溶液b和c;观察到溶液颜色由无色→淡黄→深黄→暗红→红色上面出现灰绿色,根据灰绿色占液面总面积来判断粒径大小(本文平均粒径为98 nm左右),到所需粒径大小后,取出反应瓶,冰浴使反应迅速停止,整个滴加过程需要计时。
2.3 Ag cube上修饰信号分子4-MBA
取200 μL Ag cube胶体并加入800 μL无水乙醇,超声使其分散均匀,然后6 000 r/min离心8 min;吸取上层清液,并加入1 000 μL无水乙醇如此离心清洗2次,然后用无水乙醇重新定容至1 000 μL;加入100 μL浓度为1 mmol/L的4-MBA(4-MBA配制在无水乙醇中),放置在金属轮盘上旋转孵育12 h;孵育结束后,6 000 r/min离心8 min,吸取上层清液,然后用1 000 μL去离子水清洗一次,并再次用水定容至1 000 μL,放置到4 ℃备用。
2.4 仪器
使用了日立电子扫描显微镜(SEM, HITACHI S-4800, Japan)和便携式拉曼光谱仪(NTR 785 RP2)。
2.5 葡萄糖检测原理
基于SERS结合酶促反应检测葡萄糖的原理见图1,图中立方体代表Ag cube,其上修饰有信号分子4-MBA(4-巯基苯甲酸,C7H6O2S)。Ag cube的棱角较多,粒子之间产生的热点多,当Ag cube胶体与含有葡萄糖的溶液混合并有GOx加入时,会有式(1)所示的反应发生,葡萄糖在GOx的作用下产生葡萄糖酸和H2O2,随后会发生式(2)所示的反应,H2O2刻蚀Ag cube产生Ag+。使得棱角分明的Ag cube会在H2O2的刻蚀下变得相对圆滑甚至H2O2足够多的情况下,Ag cube会完全消失。这意味着Ag cube上修饰的4-MBA的SERS信号也会因为热点变少而减弱。也即当GOx足量时,葡萄糖越多,4-MBA的SERS信号越低,二者呈反比,可通过4-MBA的信号间接反映葡萄糖的含量。4-MBA的SERS特征峰为1 077 cm-1(与芳香环呼吸、对称C—H面内弯曲和C—S拉伸有关)和1 587 cm-1(由环C—C拉伸和不对称C—H面内弯曲引起)[26]。

图1 基于SERS快速检测葡萄糖的示意图Figure 1 Schematic diagram of rapid glucose detection based on SERS
(1)

(2)
2.6 葡萄糖溶液的配制
首先配制100 mmol/L的葡萄糖水溶液,然后继续用水逐级稀释至10、5、2.5、1、0.5、0.25、0.1、0.05 mmol/L备用。用人工汗液稀释100 mmol/L的葡萄糖水溶液得到10 mmol/L的葡萄糖溶液,然后继续用人工汗液逐级稀释至5、2.5、1、0.5、0.25、0.1、0.05 mmol/L备用。
3 结果和讨论
3.1 预实验
基于检测葡萄糖的原理,需证明上述等式的成立,即4-MBA的SERS信号的降低是由葡萄糖和GOx之间反应而产生H2O2刻蚀Ag cube所引起的。设计了对照实验:空白1是200 μL水加入30 μL的Ag cube胶体和50 μL的1 mg/mL的GOx,空白2是200 μL的10 mmol/L的葡萄糖溶液加入30 μL的Ag cube胶体和50 μL的水。而对照实验是200 μL的10 mmol/L的葡萄糖溶液加入30 μL的Ag cube胶体和50 μL的1 mg/mL的GOx。分别在40 min内每隔10 min观察4-MBA的1 587 cm-1处峰面积的变化,如图2(所有峰面积均通过积分获得)。空白1和2在40 min内没有发生较大变化,而对照实验其SERS信号在不断降低。说明4-MBA的SERS信号的降低是由葡萄糖和GOx的同时存在并发生反应产生H2O2刻蚀Ag cube引起的。另外,对被刻蚀前后的Ag cube的形貌进行了SEM表征,如图3,反应后的Ag cube确实有被明显刻蚀的现象。

图2 葡萄糖和GOx是否发生反应的验证实验Figure 2 Validation experiment for glucose and GOx reaction

图3 Ag cube被刻蚀前后的SEM图Figure 3 SEM diagram of the Ag cube before and after it is etched
3.2 检测条件优化
在预实验中,葡萄糖和GOx之间反应的持续时间较长,因为这是一种需要酶参与的酶促反应,所以考虑加快此反应,使其在短时间内反应完全。加快式(1)所示的反应可从GOx的作用条件出发,因为GOx的氧化能力是通过活性单位U来定义的,1 U代表在37 ℃,pH=5.7的条件下,1 min形成1 μmol H2O2所需的酶量。首先考虑高浓度GOx是否可加快反应。其次,从GOx的作用条件出发,如温度,pH等。最后,Ag cube胶体的体积也很重要,体积太大,式(1)产生的H2O2不足以引起4-MBA信号的明显变化,体积太小,采集光谱时又需增加过多的积分时间。
首先,探究了GOx浓度增加时体系反应至稳定所需的时间,因为减少其浓度时必定需要更多的时间。在预实验中,所用GOx的浓度为1 mg/mL,反应至40 min时4-MBA的SERS信号基本稳定不变。而GOx的浓度增加至5 mg/mL时,反应稳定的时间减少至10 min,如图4(a)(所有与图4对应的光谱图如图5),表明增加浓度可以加快反应,但在考虑成本的情况下并没有继续探究更高浓度GOx的情况。
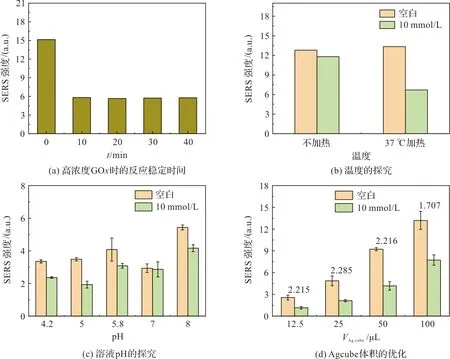
图4 优化检测条件Figure 4 Optimize detection conditions
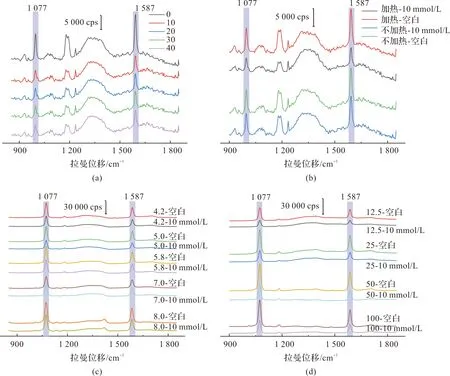
图5 与图4相对应的SERS光谱图Figure 5 SERS spectrum corresponding to Figure 4
其次,验证了将温度加热至37 ℃时和不加热时的区别。虽然GOx在37~50 ℃时都具有热稳定性,但最佳温度是37 ℃,且此温度与人体的体温最接近,所以没有探究其他温度。如图4(b),设计了空白和10 mmol/L葡萄糖溶液分别在室温和37 ℃加热3 min下的实验。可以看出,37 ℃加热情况下,4-MBA的SERS信号在3 min后明显下降了很多,而不加热的情况下仅有相对较弱的下降,所以后续实验都将采取37 ℃加热。然后探究了体系pH的影响,通过添加缓冲液(柠檬酸-磷酸氢二钠缓冲液)调节pH,发现添加缓冲液会造成Ag cube团聚,以致4-MBA的SERS信号不稳定。因为缓冲液中存在很多盐离子,使Ag cube的团聚不可控,引起了4-MBA的SERS信号忽高忽低,毫无规律,如图4(c)。经调研,GOx在pH为4.5~6.5时均可保持相对稳定,所以后续实验不再加入缓冲液调节pH,因为水的pH在6.5左右,也可维持GOx的稳定。
最后探究了Ag cube的体积。根据以上条件优化中的经验,探索了Ag cube的体积分别为12.5、25、50、100 μL的情况。如图4(d),随着Ag cube的体积的增加,4-MBA的信号无论是空白还是浓度为10 mmol/L的葡萄糖溶液都是增加的,这是符合规律的,计算空白光谱和10 mmol/L葡萄糖溶液的特征峰面积的比值,比值越大,说明葡萄糖和GOx产生的H2O2取得了最佳的刻蚀效果(因为产生的H2O2量是固定的)。所以,最佳的Ag cube体积为25 μL。
3.3 葡糖糖水溶液的检测限
上述优化过程中均采用溶胶法,即直接采集整个反应溶液的SERS光谱,但检测限(LOD)却并不理想。后尝试芯片法进行测试,吸取3 μL溶胶反应液滴到渡有金膜的硅片(简称芯片)上,但直接采集液滴的SERS光谱与溶胶法一样效果不佳。所以,考虑将3 μL的液滴烘干,以此规避掉液体的影响。实验证明LOD大大降低,同时也对优化条件进行了微调,微调后的条件及顺序如下:200 μL不同浓度的葡糖糖水溶液、20 μL的Ag cube、30 μL的GOx(5 mg/mL),充分混匀后在金属加热平台中38 ℃加热3 min,然后吸取3 μL反应溶液滴加到芯片上,将芯片放置到50 ℃加热台上烘干,需要6 min。最后,积分2 s采集已烘干芯片的SERS光谱。加上操作步骤需9~10 min,为节省时间,尝试不用金属加热平台加热3 min,直接混匀便吸取3 μL滴加到50 ℃加热台上烘干,取得了相同的实验效果,7 min即可完成检测。如图6,误差棒由3次平行实验获得,光谱图右侧为与之相对应的葡萄糖的摩尔浓度,葡萄糖水溶液的LOD为0.1 mmol/L。对葡萄糖的对数浓度和1 077 cm-1的峰面积做了线性拟合,如图7(小图为葡萄糖原始浓度与1 077 cm-1峰面积的浓度曲线),R2为0.95,线性效果良好。
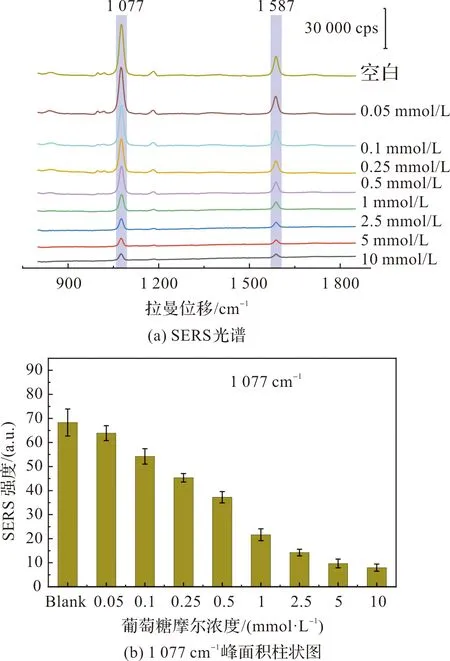
图6 葡萄糖水溶液的检测限Figure 6 LOD for aqueous glucose solutions
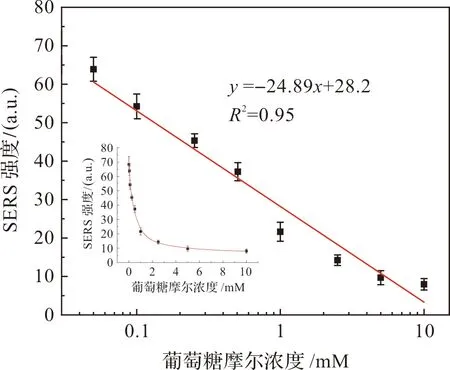
图7 葡萄糖水溶液的对数浓度与4-MBA 1 077 cm-1处SERS峰面积的拟合曲线Figure 7 Fitting curve of the logarithmic concentration of glucose aqueous solution to the SERS peak area at 1 077 cm-1 of 4-MBA
3.4 葡萄糖在人工汗液中的检测限
在关于pH优化中便提到,盐类物质会引起Ag cube的团聚不可控,汗液中同样存在大量盐类物质,若不对汗液进行前处理,则无法得到理想的结果。在加热烘干后,金膜上会出现白色析出物,这正是汗液中存在的大量盐类物质。从快速检测的目标出发,汗液的前处理不能是复杂且耗时的,首先想到也是最简单的方法是稀释汗液。
在此,把加标后葡萄糖浓度为10 mmol/L的汗液和水分别按照1∶1、1∶2、1∶3和1∶4的比例进行稀释,按照优化的条件和步骤进行测试,结果如图8,当汗液和水的比例为1∶3和1∶4时获得了良好效果,不仅误差较小,而且空白光谱和10 mmol/L葡萄糖的汗液有较好的区分。但汗液与水的比例为1∶3时是最优的,因为稀释倍数越多,原始汗液中的葡萄糖也被稀释越多,产生的H2O2就越少,空白光谱和汗液光谱就越难区分。
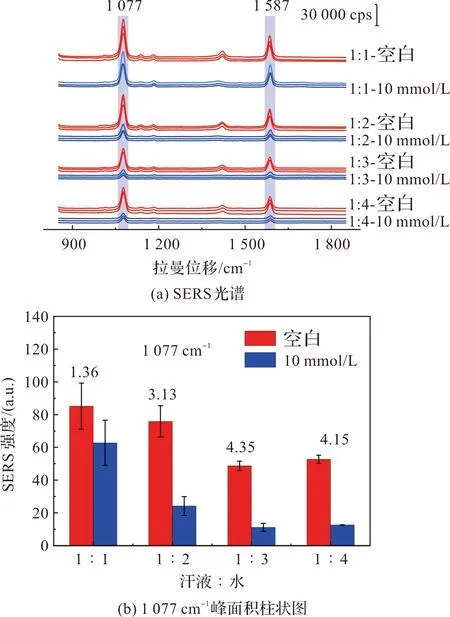
图8 人工汗液的稀释倍数探究Figure 8 Exploration of dilution factor of artificial sweat
在此基础上,葡萄糖浓度则相应被稀释了4倍,但只关注葡萄糖原始浓度。如图9,汗液中葡萄糖的LOD为0.5 mmol/L,而葡萄糖水溶液的LOD为0.1 mmol/L,因为汗液中的葡萄糖被稀释至原来的4倍。人体正常的血糖浓度空腹时为3.9~6.1 mmol/L,餐后2 h为4.4~7.8 mmol/L,而糖尿病患者的这一数值要高得多,一般空腹时大于7.1 mmol/L,餐后2 h大于11.1 mmol/L。而人体汗液中的葡萄糖含量很低,约为血糖浓度的1%~2%(对于糖尿病患者,空腹时则大于0.071 mmol/L,餐后2 h大于0.11 mmol/L),或为0.06~0.2 mmol/L,两者的差距不大[27]。本文的方法仅能检测到0.5 mmol/L,相差约2.5~8.3倍,距离汗液中葡萄糖的浓度范围相差不到1个数量级,原因是还有很多条件未优化,如信号分子4-MBA与Ag cube的孵育时间、Ag cube的粒径大小、汗液稀释倍数的详细优化等。

图9 葡萄糖在人工汗液中的检测限Figure 9 LOD of glucose detection in artificial sweat
4 结 语
本文基于SERS并利用葡萄糖和GOx之间的反应产生H2O2刻蚀Ag cube引起4-MBA SERS信号的变化来间接检测汗液中的葡萄糖。首先验证了葡萄糖和GOx之间反应的可靠性。其次优化了GOx的浓度、环境温度、体系pH以及Ag cube胶体的体积对测试灵敏度的影响。得到了葡萄糖水溶液的LOD为0.1 mmol/L,检测时间为7 min。最后,对汗液进行了稀释操作,汗液中葡萄糖的LOD为0.5 mmol/L,距离汗液中葡萄糖浓度还相差不到1个数量级,但糖尿病患者往往汗液中葡萄糖浓度较高,所以此方法是初步成功的。这为糖尿病患者提供了一种快速无损的葡萄糖检测方式。

