首次疗效评估中肿瘤最长径之和变化对晚期肝内胆管癌化疗患者生存预后的预测价值
董雨龙, 陶晨洁, 娄 成, 陈熙昀, 魏 炜, 韩 琴, 袁振刚
(海军军医大学附属东方肝胆外科医院肿瘤科,上海 200438)
肝内胆管癌是一种复杂的上皮恶性肿瘤[1],肝内第二常见的恶性肿瘤,仅次于原发性肝癌[2-3],其发病率占原发性肝恶性肿瘤的10%-15%[4-5]。近些年肝内胆管癌的发病率逐年上升[6-7]。相比肝细胞癌,肝内胆管癌的恶性程度更高,预后更差[1,8]。根治性手术切除仍然是目前是肝内胆管癌唯一可能治愈的方法[9-10]。但早期肝内胆管癌往往缺乏明显症状,大多数患者一经发现已进入晚期,失去了手术根治的机会。即使可手术的患者,术后的复发率也很高,达到50-60%[11],总体5年的生存率也只有25%-31%[12]。对于不可切除的局晚期或晚期肝内胆管癌患者,目前NCCN和CSCO等指南推荐一线治疗方案是以含吉西他滨的化疗方案为主[13-14]。晚期肝内胆管癌整体的治疗过程持续时间长,时间跨度大。因此,临床上在治疗过程中迫切需要相关的指标准确判断患者预后。
相关文献报道晚期肝内胆管预后的指标,常见的如肿瘤标志物CA199等[15-16]。但CA199本身是一种分布于肝、胆道、胰腺、胃肠等多种器官组织细胞表面的糖脂质。同时也受黄疸、炎症等多种因素的影响[17],对肝内胆管癌预后价值存在一定的偏差。而肿瘤最大径之和(sum of the largest tumor diameters, SLD)的变化能客观反映肿瘤浸润范围和生长速度的重要依据[18]。因此,实体瘤疗效评价标准1.1被制定和应用于评估实体瘤的疗效标准。根据标准,将疗效分为4种,即完全缓解(complete response, CR)、部分缓解(partial response, PR)、病情稳定(stable response, SD)和病情进展(progressive response, PD)。首次疗效评估在晚期肝内胆管癌一线治疗过程中非常重要,不同的疗效结果直接影响到患者后续的治疗策略以及对治疗的信心和依从性等。但目前关于晚期肝内胆管癌化疗后疗效与生存的预后相关性研究较少。本研究旨在探讨晚期肝内胆管癌接受一线化疗后首次疗效结果对患者生存预后的价值,为肝内胆管癌的治疗提供临床依据。
1 资料与方法
1.1 一般资料
回顾性收集了2018年10月—2022年12月海军军医大学附属东方肝胆外科医院107例晚期肝内胆管癌患者的数据。纳入标准如下: (1) 结合病理组织学及影像学检查明确诊断为晚期肝内胆管癌(基本上所有患者存在淋巴结或远处器官转移);(2) 接受不同的姑息性一线化疗方案,主要以吉西他滨为主;(3) 基于增强CT或增强MRI等检查,有可测量肿瘤大小;(4) ECOG评分≤2分;(5) 有完整与肿瘤相关性的OS,排除车祸等意外死亡。最终分析的排除标准如下: (1) 同时合并其他的恶性肿瘤;(2) 影像学上不可测量的病灶;(3) 一线化疗前和化疗过程中出现感染、黄疸、血栓形成、外伤、严重心、肝、肾等功能不全等;(4) 同时联合放疗、介入等局部治疗;(5) 除外联合免疫治疗的患者;(6) ECOG评分≥3分。
1.2 肿瘤大小测量
(1) 基于胸部CT、腹部增强CT或MRI等影像学检查,患者基线采用增强CT或MRI检查,一线评估疗效时对应的采用增强CT或增强MRI进行对比肿瘤大小;(2) 本研究纳入的病例均有可测量的病灶,每个器官选取不超过2个靶病灶,最多不超过5个靶病灶(双器官被认为是同一器官,如肺、肾、肾上腺),转移性淋巴结大小至少15 mm以上为靶病灶;(3) 基于实体瘤疗效评价标准1.1,本研究中将首次疗效评估中对比前后肿瘤大小,将肿瘤SLD缩小至少超过30%为SLD(1)组;SLD增加至少超过20%纳入SLD(3)组;介于两者之间的为SLD(2)组。
1.3 化疗方案
主要的治疗方案如下。(1) GP方案: 吉西他滨1 000 mg/m2,第1、8天静滴;顺铂40 mg/m2,第1、8天静滴,21 d为1个周期。(2) Gemox方案: 吉西他滨1 000 mg/m2,第1、8天静滴;奥沙利铂130 mg/m2,第1天静滴,21 d为1个周期。(3) GS方案: 吉西他滨1 000 mg/m2,第1、8天静滴;替吉奥根据体表面积给药,<1.25 m2,每次40 mg口服,2次/日;1.25-1.5 m2,每次50 mg口服,2次/日;>1.5 m2,每次60 mg口服,2次/日,连续服用14 d,停用7 d,21 d为1个周期。
1.4 观察内容
年龄、性别、乙肝病毒感染、血管侵犯、肿瘤分化、丙氨酸转氨酶(alanine transaminase, ALT)、天冬氨酸转氨酶(aspartate aminotransferase, AST)、总胆红素(total bilirubin, TBIL)、白蛋白(albumin, ALB)、SLD、CA199、D-二聚体(D-dimer)、总生存时间(overall survival, OS)等数据。平均在化疗后2个月左右进行首次疗效评估。主要基于增强CT或增强磁共振等影像检查结果和Recist1.1版实体瘤疗效评价标准。我们将化疗前后疗效分为3组即SLD(1)、SLD(2)和SLD(3)组。同时,为了进一步分析疗效与生存预后的影响,依据化疗前后SLD(2)的变化,将SLD(2)组分为2部分,其中SLD(2+)表示对比基线SLD从0增加至20%;SLD(2-)表示SLD从0缩小至30%。
1.5 统计学处理
采用SPSS 23.0进行统计分析,分类变量的频率分布采用χ2检验或Fisher精确检验进行比较。使用Kaplan-Meier法绘制OS生存曲线,log-rank检验评估各组间曲线的显著性差异。采用使用单因素和多因素分析Cox比例风险模型对OS进行分析,两侧P<0.05为差异有统计学意义。
2 结 果
2.1 患者的基本特征
回顾性纳入107例晚期肝内胆管癌患者进入本研究。其中女性39例(36.4%),男性68例(73.6%)。年龄范围为29-77岁,患者中位年龄为55岁。根据RECIST1.1版实体瘤评估标准,平均2个月左右评估SLD变化,其中PR患者18例,SD患者54例,PD患者35例,尚无CR患者。根据受试者工作特征(ROC)曲线分析CA199和D-二聚体,CA199和D-二聚体最佳截断值分别为380 U/mL和1.29 mg/L,其他一般情况及临床指标详见表1。

表1 不同化疗疗效组与临床基本特征指标比较
2.2 不同疗效组的患者与生存分析
SLD(1)组的中位OS为16.3个月,SLD(2)组的为13.2个月,SLD(3)组的为7.4个月,差异有统计学意义(P<0.001)。SLD(1)组中6、12、24个月的生存率分别为100%、72.2%和16.7%;SLD(2)中6、12、24个月的生存率分别为90.7%、53.7%和7.4%;SLD(3)组中6、12、24个月的生存率分别为57.1%、20%和0%(图1)。为进一步分析疗效与生存预后的关系,我们依据化疗前后SLD的变化,将SLD(2)组分成2组。化疗后SLD从0%减小至30%的这部分患者纳入到SLD(2-)组,而将化疗后SLD从0%增大至20%的这部分患者纳入到SLD(2+)组。对于SLD缩小的这部分患者,SLD(2-)和SLD(1)组的中位OS分别为13.9个月和16.4个月,差异无统计学意义(P=0.053)。然而,对于SLD(2+)和SLD(3)组的中位OS分别为11.3个月和7.4个月,差异存在显著统计学意义(P=0.012),见图2。
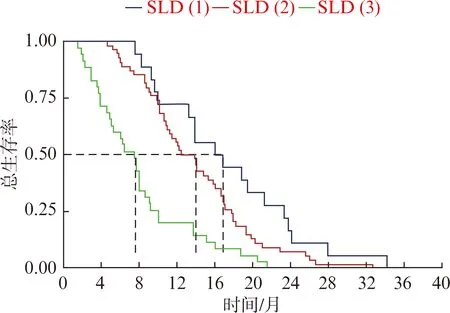
图1 不同化疗疗效分组的生存曲线
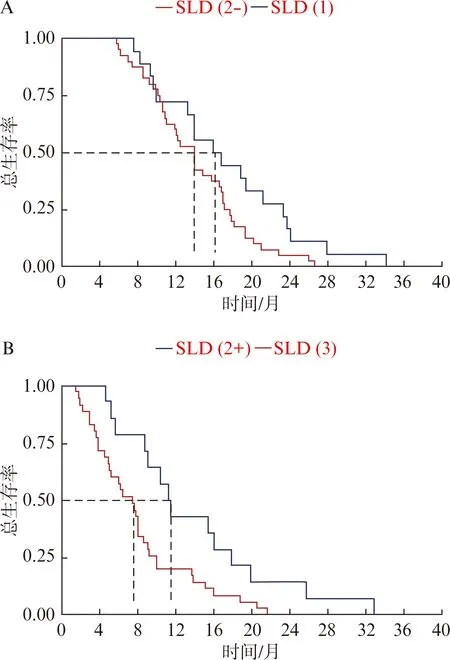
图2 SLD(2)增大和缩小组化疗疗效分组的生存曲线
2.3 单因素和多因素Cox分析
对接受化疗的患者的生存情况进行随访,最长时间36个月。Cox回归模型显示,单因素分析结果表明血管侵犯(HR=1.519,95%CI: 1.035-2.231,P=0.033)、丙氨酸转氨酶(HR=1.696,95%CI: 1.086-2.649,P=0.020)、天冬氨酸转氨酶(HR=1.763,95%CI: 1.160-2.678,P=0.008)、总胆红素(HR=2.374,95%CI: 1.366-4.127,P=0.002)、CA199(HR=1.703,95%CI: 1.112-2.608,P=0.014)、D-二聚体(HR=1.826,95%CI: 1.225-2.723,P=0.003)、SLD(1)组(HR=0.488,95%CI: 0.287-0.828,P=0.008)、SLD(3)组(HR=2.924,95%CI: 1.914-4.465,P<0.001)与患者OS相关,见表2。多因素分析显示CA199(HR=2.084,95%CI: 1.359-3.194,P=0.001)、D-二聚体(HR=1.822,95%CI: 1.140-2.911,P=0.012)、SLD(1)组(HR=0.564,95%CI: 0.321-0.991,P=0.046)、SLD(3)组(HR=3.012,95%CI: 1.873-4.842,P<0.001)是OS的独立预后影响因素,见表3。
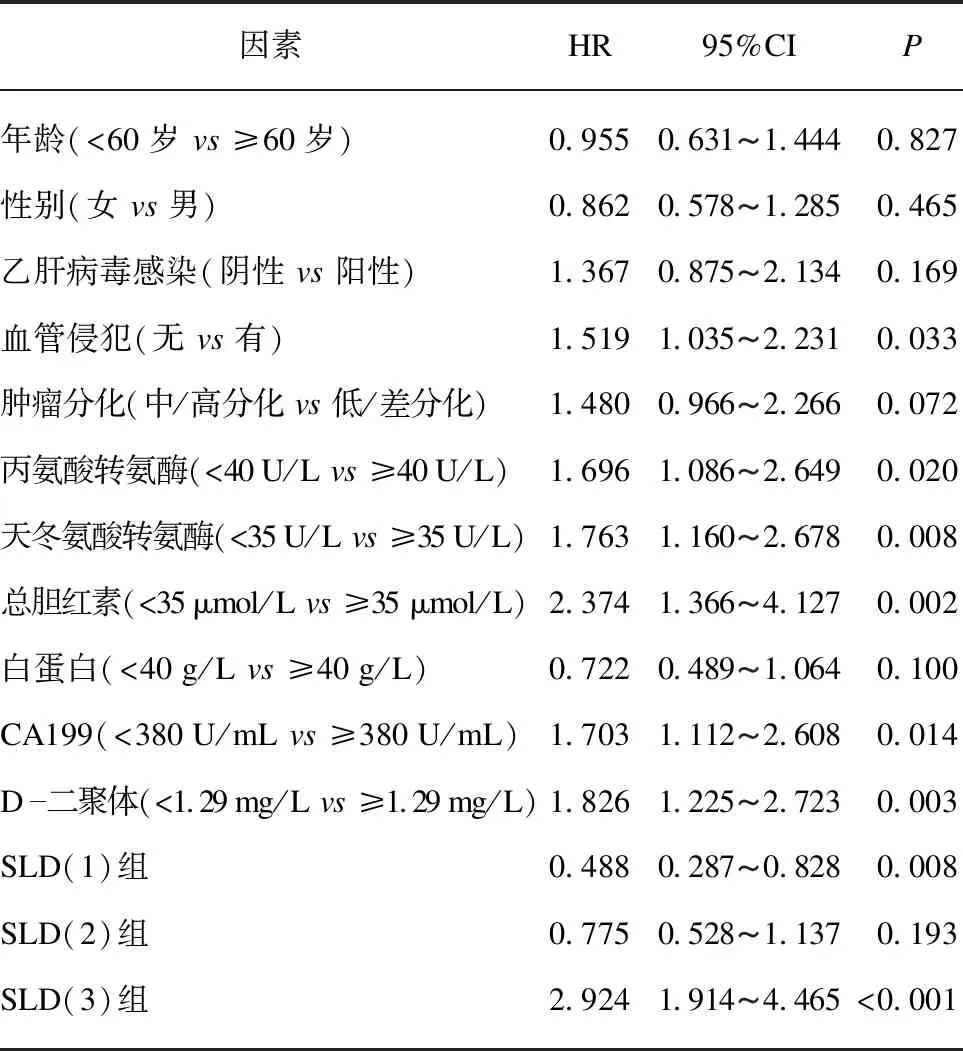
表2 单因素Cox分析临床特征与化疗后患者生存之间的关系

表3 多因素Cox分析临床特征与化疗后患者生存之间的关系
3 讨 论
近些年来,肿瘤大小在多种恶性肿瘤中作为判断患者的预后的重要因素之一。WHO及RECIST1.1等肿瘤评价标准将T分期纳入其中,也体现了肿瘤大小对评估患者的病情及预后的重要性。肿瘤体积的大小表现在肿瘤细胞浸润的范围,在一定程度上体现了肿瘤的生物学性质,也是肝内胆管癌治疗后疗效评估的重要客观依据[18]。治疗前后SLD的增大或缩小直接影响到肿瘤侵犯的广度和深度,从理论上说肿瘤体积越大,侵犯正常组织的范围也越大,对患者的预后也越差[19-21]。反之预后则越好。相关研究表明在结直肠癌等恶性肿瘤中,肿瘤的长径大小与组织学分期正相关,而与预后呈负相关[22-23]。这与本研究结果类似。但这些研究是以基线肿瘤大小来预测患者预后,缺乏动态观察肿瘤大小的变化对患者预后的影响。然而,动态评估肿瘤大小对患者预后影响的这一类的文章非常少,尤其是胆道肿瘤中。因此,本研究进一步探究化疗前后SLD的变化对晚期肝内胆管癌预后生存的影响。
在本研究中,共纳入了107例晚期一线肝内胆管癌患者,接受了不同化疗方案进行治疗。通过首次化疗后疗效评估结果,发现SLD(1)组的晚期肝内胆管癌患者的中位生存时间明显较前SLD(2)和SLD(3)组延长,同时也发现患者6、12、24个月的OS率也明显优于SLD(2)组和SLD(3)组。在单因素和多因素Cox分析结果中,SLD(2)组和SLD(3)组差异都显示出明显的统计学意义,提示为独立的预后因素。而SLD(2)组并没有显示明显的差异。为进一步观察化疗前后SLD的变化与OS预后的影响,本研究将SLD(2)组分为SLD(2-)和SLD(2+)两组。在SLD增大范围内,SLD(2+)组和SLD(3)组的中位OS差异有统计学意义,提示肿瘤侵犯的范围越大,患者的生存预后越差。而在SLD缩小的范围内,SLD(2-)组和SLD(1)组没有明显地显示肿瘤缩小的程度与患者的生存预后相关。对于SLD(3)组和SLD(2+)组患者存在明显的差异,笔者推测可能由于肿瘤体积增大或数量增多,增加了梗阻性黄疸、肝功能不全、肠梗阻等并发症的发生概率,一定程度上阻碍了后续的治疗进程。同时病情恶化的程度也可能加重了患者的心理负担,影响到后续治疗的信心。而对SLD(2-)组和SLD(1)组这部分患者,笔者分析是可能是较好的治疗效果使肿瘤侵犯的范围缩小,减少或延缓了对重要组织器官的压迫,降低了出现严重的并发症的概率,对后续的治疗影响较小,导致SLD(2-)组和SLD(1)组患者生存时间不是很明显。总体来看,首次疗效评估对肝内胆管癌患者意义重大,SLD(1)组的患者预后较好,SLD(3)组的患者预后明显较差。而对SLD(2)组的这部分患者要区分对待,SLD增大组的患者整体生存预后比SLD缩小组的预后要差,但是明显比SLD(3)组患者的预后明显改善。
本研究也存在一些局限性。虽然存在明确纳入和排除标准,但首先这是一个可能涉及混杂的因素的单中心回顾性研究。此外,因为严格的纳排标准,尽量减少干扰因素,但同时也限制了总体的样本量;另外,不同的化疗药物可能会影响到疗效,引起结果的偏倚。但综合不同的化疗方案导致的首次疗效变化更能体现出它对晚期胆管癌预后的意义。笔者观测到首次疗效评估中的SLD缩小>30%和SLD增加>20%是晚期肝内胆管癌患者预后的独立因素。因此,对于晚期肝内胆管癌患者的治疗,尤其是一线治疗,要重视化疗的方案的制定及首次化疗后疗效评估后的结果。对于SLD增加的患者,需要差别对待,应尽早调整后续的治疗方案。可见,这一指标为晚期肝内胆管癌患者的治疗和预后提供了一个新的方向,帮助临床医生预判病情发展趋势,制定相应的治疗方案及随访计划。

