卡瑞利珠单抗联合化疗对中晚期食管癌的疗效、安全性分析及NLR对疗效的预测价值
阿卜拉·太外库力, 安尼瓦尔·买买提, 努尔比亚·买买提,陈海林, 周 蕾, 卜 素, 梅运清
(1. 同济大学医学院,上海 200092; 2. 同济大学附属同济医院心胸外科,上海 200065; 3. 喀什地区第一人民医院胸外科,新疆 喀什 844000; 4. 喀什地区第一人民医院综合心理科,新疆 喀什 844000; 5. 湖北医药学院附属襄阳市第一人民医院心胸外科,湖北 襄阳 441000)
目前资料表明食管癌(esophageal cancer, EC)的5年生存率较低,为15%- 25%[1]。按照组织病理学类型分类,EC主要分为食管鳞癌(esophageal squamous cell carcinoma, ESCC)和食管腺癌(esophageal adeno-carcinoma, EAC)[2]。EC在临床上主要治疗策略以手术、化疗及放疗为主[3]。化疗及放疗容易产生副作用,因此亟须开发新的治疗策略。近年来有研究证明,激活后的机体免疫系统能够发现、识别并清除肿瘤细胞[4]。程序性死亡受体1(programmed death-1, PD-1)与程序性死亡配体-1(programmed death ligand-1, PD-L1)抑制剂为代表的肿瘤免疫疗法给EC患者带来新的希望。PD-1/PD-L1抑制剂可以特异性阻断PD-1与PD-L1之间结合,激活T细胞活性,对肿瘤细胞产生杀伤力[5]。
目前PD-1/PD-L1抑制剂免疫治疗现阶段其应用模式仍以联合治疗为主,治疗方式包括后线治疗、维持治疗、二线治疗、一线治疗、新辅助治疗等,治疗模式包括免疫联合放化疗、免疫联合新辅助放化疗、术后免疫巩固、免疫联合转移灶放疗等,多种临床研究结果表明,帕博利珠单抗、纳武利尤单抗、卡瑞利珠单抗、特瑞普利单抗等PD-1抑制剂被中国临床肿瘤学会推荐用于食管癌患者的一线、二线治疗[6]。尽管目前免疫治疗扩大了患者的获益,但仍有一部分患者要面对治疗无应答的窘境,因此需要探索疗效预测标志物,以便开展精准化治疗。此外,原发性耐药、严重不良反应也对临床治疗造成了极大挑战。
卡瑞利珠单抗为PD-1特异性抑制剂,在食管癌治疗的初步研究结果中显示出良好的治疗效果[7-8]。然而在食管癌中免疫治疗还处于不断的探索之中,其疗效及安全性需要大量的临床研究数据支持。
另外,目前还没有预测卡瑞利珠单抗联合化疗治疗ESCC患者疗效的标志物。据报道,外周血炎症相关参数能够代表患者的基础免疫力[9],外周血中性粒细胞-淋巴细胞比值(neutrophil lymphocyte ratio, NLR)作为重要的炎症参数标志物已被证实能够预测PD-1/PD-L1抑制剂治疗肺癌、胃癌、大肠癌的疗效[10-12]。到目前为止,尚无评价NLR在接受卡瑞利珠单抗免疫治疗的EC患者中预测疗效的相关研究。
本研究旨在评估卡瑞利珠单抗联合化疗治疗食管癌的疗效及安全性,通过评估NLR对卡瑞利珠单抗联合化疗疗效的预测价值,为卡瑞利珠单抗在中晚期食管癌中合理应用提供一定理论基础。
1 资料与方法
1.1 一般资料
回顾性分析在新疆喀什地区第一人民医院接受卡瑞利珠单抗联合化疗(2021年6月—2022年4月)或化疗治疗(2018年1月—2022年4月)的中晚期ESCC患者168例。研究组: 接受卡瑞利珠单抗联合化疗的患者(92例);对照组: 单纯化疗治疗(76例)。
本研究共纳入168例患者,其中男性113例,女性55例。本研究中患者年龄为43-84岁,中位年龄为65岁。其中53名为吸烟者(31.5%),115名为不吸烟者(68.5%)。此研究中,大多数患者被诊断为TNM晚期或局部晚期。两组相关数据均P>0.05,表明两组数据差异无统计学意义,有可比性,见表1。

表1 两组间各指标差异比较
纳入标准: (1) 病理学证实的ESCC患者;(2) 接受卡瑞利珠单抗联合化疗或单纯化疗的,既往未行系统治疗的不可切除晚期、复发(包括术后复发)或转移性ESCC患者;(3) 卡式评分量表(Karnofsky performance status, KPS)评分≥70分;(4) 至少一个可测量病灶可按实体肿瘤反应评估标准(response evaluation criteria in solid tumours1.1, RECIST1.1)衡量的病变[13];(5) 年龄≥18岁且<85岁;(6) 具有完整的临床资料和随访资料。
排除标准: (1) 年龄≥85 岁;(2) 存在严重自身免疫性疾病;(3) 接受卡瑞利珠单抗联合化疗或单纯化疗<3周期;(4) 患有严重肝、肾、心、肺、脑等重要脏器功能不全,基础状态不良者;(5) 有严重内分泌系统疾病,内分泌功能紊乱患者;(6) 患有严重血液系统疾病和感染性疾病;(7) 有高血压且血压控制不佳者或有消化道出血风险者;(8) 哺乳期或怀孕妇女。
治疗方案: 研究组患者至少接受3周期的卡瑞利珠单抗联合化疗治疗,治疗方案为: 卡瑞利珠单抗(200 mg,每3周给药1次)联合化疗;化疗方案: 多西他赛(75 mg/m2,每3周给药1次)、奈达铂(80 mg/m2,每3周给药1次),共50例患者采用此方案;或白蛋白紫杉醇(260 mg/m2,每3周给药1次)+顺铂(75 mg/m2,每3周给药1次),共42例患者采用此方案;在每次治疗开始时、治疗结束时(治疗前3 d内、治疗结束后3 d内)测量全血计数。
对照组患者至少接受3周期的化疗治疗,治疗方案为: 多西他赛(75 mg/m2,每3周给药1次)、奈达铂(80 mg/m2,每3周给药1次),对照组共50例患者采用此方案;或白蛋白紫杉醇(260 mg/m2,每3周给药1次)顺铂(75 mg/m2,每3周给药1次),对照组共26例患者采用此方案;所有患者均签署知情同意书。
1.2 方法
1.2.1 研究组、对照组疗效、安全性评估,研究组NLR疗效预测相关性分析 研究组、对照组患者进行计算机断层扫描(增强CT)评估治疗效果,肿瘤疗效评估的频率为治疗开始时评估1次,结束第2周期治疗后进行1次评估,结束第3周期治疗后1个月内进行1次评估,结束治疗后每12周评估1次。参照RECIST1.1疗效评价标准判定完全缓解(complete response, CR)、部分缓解(partial response, PR)、疾病稳定(stable disease, SD)、疾病进展(progressive disease, PD)等疗效指标[14]。客观缓解率(objective remission rate, ORR)=(CR例数+PR例数)/总例数×100%,疾病控制率(disease control rate, DCR)=(CR例数+PR例数+SD例数)/总例数×100%。两组对患者无进展生存期(progression free survival, PFS)、总生存期(overall survival, OS)进行统计学分析。利用不良事件通用术语标准(common terminology criteria for adverse events, CTCAE5.0)记录两组不良事件并对其进行分级[15]。
研究组患者每个治疗周期接受治疗前、接受治疗后收集外周血中性粒细胞、淋巴细胞等外周血检测结果(本研究所记录的中性粒细胞及淋巴细胞计数在内的所有实验室检查结果均为未使用升白细胞干预或其他干预情况下的值)。为评价ESCC患者的NLR信息,按以下规则计算: NLR为中性粒细胞除以淋巴细胞,即NLR=中性粒细胞计数/淋巴细胞计数。记录接受一线卡瑞利珠单抗联合化疗后NLR及PFS、OS,分别记录基线NLR0(接受第1次治疗后的NLR值),NLR1(接受第2次治疗后的NLR值),NLR2(接受第3次治疗后的NLR值)。
1.2.2 随访 入选患者的临床资料、病情、不良反应等通过查阅电子病历获得,生存时间主要通过电话随访确定,随访截止日期2023年1月10日。
1.2.3 统计学处理 采用SPSS 22.0对数据进行统计学分析,计数资料以n(%)表示,组间比较采用χ2检验或Fisher检验;采用Kaplan-Meier法估计PFS和OS,生存差异比较采用log-rank检验,P<0.05为差异有统计学意义。
2 结 果
2.1 治疗效果分析
随访截止至2023年1月10日,中位随访时间为16.8个月。研究组CR、PR、SD、ORR、DCR、新辅助化疗后手术等指标均高于对照组,对照组PD、疗效欠佳接受放疗等指标较研究组高,差异有统计学意义(P<0.05),研究结果显示研究组相比对照组疗效获益显著。部分患者治疗后其肿瘤明显缩小接受手术,部分患者出现肿瘤进展,治疗效果较差,出现肿瘤进展时患者一般情况尚可,建议接受进一步放疗,以便防止疾病进一步发展。两组ORR、DCR、后续治疗情况,见表2。接受新辅助治疗后手术及无法手术情况见表3。

表2 两组患者的临床疗效及后续治疗情况

表3 两组患者接受新辅助治疗及后续治疗情况
2.2 生存分析
两组分层比较,研究组及对照组患者的中位PFS分别为(8.7个月vs4.6个月),研究组中位PFS明显优于对照组,log-rank检验分析显示差异有统计学意义(HR=6.787,95%CI: 4.479-10.282,P<0.001)。研究组及对照组患者中位OS分别为(14.8个月vs11.2个月);研究组OS明显优于对照组,差异有统计学意义(HR=2.291,95%CI: 1.614-3.251,P<0.001),见图1、2。

图1 研究组与对照组患者PFS比较

图2 研究组与对照组患者OS比较
2.3 治疗安全性分析
两组大部分患者不良反应为1-2级,3级以上不良反应较少见,治疗过程中未出现因不良反应死亡病例,不良反应在可以控制的范围之内,见表4。研究组和对照组比较淋巴细胞减少症、中性粒细胞减少症、白细胞减少症、贫血、甲状腺功能减退、肺部感染、毛细血管增生症、皮疹、骨髓抑制、食欲减退、乏力、发热等不良反应发生率比较高,差异有统计学意义(P<0.05),表明研究组上述不良反应发生率较对照组高,考虑卡瑞利珠单抗联合化疗提高这些不良反应的发生率,研究组及对照组比较严重的不良反应为贫血、骨髓抑制、白细胞减少症。值得注意的是研究组出现18例次(18/310,5.9%)危及患者生命安全的严重不良反应事件,对照组出现5例次(5/271,1.8%)危及患者生命安全的严重不良反应事件(两组上述严重不良反应通过积极对症治疗得以纠正),与对照组相比,研究组出现严重不良反应的发生率高(P<0.001),差异有统计学意义,需要在治疗期间及时发现及处理。

表4 两组患者的不良反应比较
两组患者化疗采用多西他赛+奈达铂、紫杉醇白蛋白+顺铂方案,该方案较卡瑞利珠单抗联合紫杉醇+顺铂(ESCORT-1st研究[8])方案存在少许血液系统毒性,两组治疗后出现白细胞减少症血液毒性,两组经过升白细胞处理的患者分别49例次(15.8%)及23(8.4%)例次,两组差异有统计学意义(P<0.05),表明研究组较对照组出现上述不良反应风险较大,治疗中需要注意观察并及时处理。两组其他不良反应发生率比较,差异无统计学意义(P>0.05),见表4。
2.4 卡瑞利珠单抗联合化疗NLR疗效预测相关性分析
研究组患者根据患者NLR0、NLR1和NLR2(均为接受治疗后检测的值)的中位数为阈值,将患者分别分为低NLR组和高NLR组。在治疗开始时,低NLR0组和高NLR0组的PFS率(HR=1.114,95%CI: 0.734-1.692,P=0.613)及OS率(HR=1.143,95%CI: 0.756-1.730,P=0.526)差异无统计学意义,见图3、4。log-rank检验显示接受第2次治疗低NLR1组和高NLR1组的PFS率(HR=0.866,95%CI: 0.571-1.314,P=0.499)及OS率(HR=0.964,95%CI: 0.637-1.459,P=0.862)差异无统计学意义,见图5、6。接受第3次治疗时低NLR2组和高NLR2组的PFS率(HR=4.339,95%CI: 2.689-7.003,P<0.001)及OS率(HR=3.147,95%CI: 2.018-4.907,P<0.001)差异有统计学意义,见图7、8。

图3 第1次治疗后的两组患者PFS情况比较
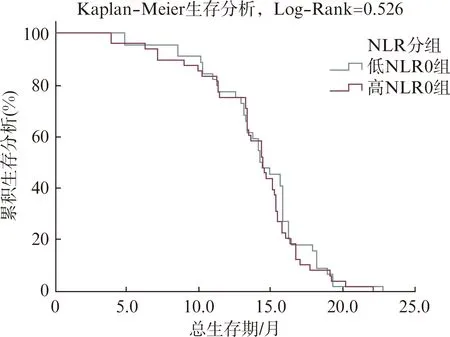
图4 第1次治疗后的两组患者OS情况比较

图5 第2次治疗后的两组患者PFS情况比较

图6 第2次治疗后的两组患者OS情况比较

图7 第3次治疗后的两组患者PFS情况比较

图8 第3次治疗后的两组患者OS情况比较
研究组及对照组治疗入组患者分别为92例和76例,但每个组每个患者至少接受3次免疫+化疗或化疗,故研究组310人次接受治疗,对照组271人次接受治疗;研究组出现比较多的不良反应为食欲减退、恶心、乏力、白细胞减少症、淋巴细胞减少症、中性粒细胞减少症、轻度贫血、皮疹、毛细血管增生症、甲状腺功能减退等,研究期间未出现因不良反应致死病例,安全性在可接受范围之内由此可见,接受第1次及第2次治疗后的低、高NLR0、NLR1组患者PFS及OS率无明显差异,两组PFS率及OS率对比差异无统计学意义(P>0.05),该阶段的NLR0、NLR1无法预测患者PFS及OS。第3次治疗后的NLR2与患者PFS及OS有明显的关联性,且低NLR2组患者的PFS及OS明显优于高NLR2组,两组对比差异有统计学意义(P<0.001)。初步得出第3次治疗后的NLR2可能是预测患者PFS及OS的指标,为论证该推论需要进一步做NLR2与PFS及OS的ROC曲线,以便了解NLR2预测PFS及OS的特异度及灵敏度。
本研究患者共纳入92例(均为研究组患者),NLR2的中位数为3.08,根据NLR2基线中位数分为低、高NLR2组,其中男性63例,女性29例。本研究中患者年龄为44-84岁,入组患者的中位年龄为65岁。其中30名为吸烟者(32.6%),62名为不吸烟者(67.4%)。在所有患者中,77例(83.7%,77/92)患者进行了PD-L1检测,15例患者无法评估PD-L1表达状态。此研究中,大多数患者被诊断为TNM晚期或局部晚期。两组数据差异无统计学意义(P>0.05),分组及进一步研究有意义,见表5。

表5 低、高NLR组患者基线资料
低、高NLR2组根据患者中位PFS绘制ROC曲线,低、高NLR2组患者的中位PFS为8.5个月,两组以8.5个月为阈值进一步统计ROC工作曲线分析,以便了解NLR2变量预测食管癌卡瑞利珠单抗联合化疗效果的价值,ROC曲线NLR2曲线下面积为AUC=0.91(95%CI: 0.762-0.978,P<0.001),最佳截断值为3.12(图9)。生存分析显示,低NLR2组人群较高NLR2组的人群有更长的PFS及OS获益优势,低、高NLR2组的中位PFS分别为(9.8个月vs6.3个月,HR=5.064,95%CI: 3.048-8.414,P<0.001)、中位OS分别为(15.8个月vs13.2个月,HR=3.205,95%CI: 2.053-5.005,P<0.001),且低NLR2组较高NLR2组获得更高的ORR,两组ORR分别为(65.8%vs37%,P<0.001)。
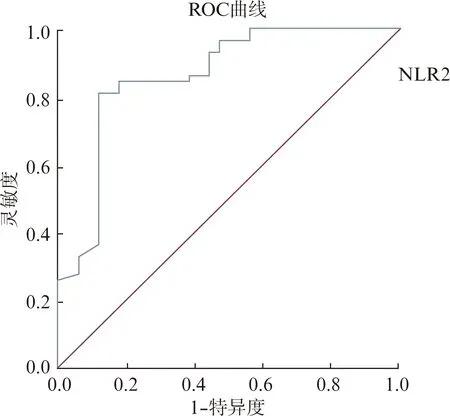
图9 低、高NLR2组NLR2 ROC曲线用于预测食管癌卡瑞利珠单抗联合化疗治疗效果的概率情况
两组患者通过log-rank检验分析发现,NLR2≥3.12是ESCC患者预期PFS及OS疗效的危险因素(P<0.001)。
分析结果显示,高NLR2组患者PFS率及OS率比低NLR2组患者低(P<0.001),低NLR2患者的PFS率及OS率明显高于高NLR2患者,且通过ROC曲线来验证NLR2指标的灵敏度及特异度,结果显示NLR2与食管癌卡瑞利珠单抗联合化疗的PFS率及OS率有明显的预测关联性,因此,NLR2是卡瑞利珠单抗联合化疗治疗ESCC的一个疗效预测因子。
本研究针对PD-L1 TPS表达的生存与疗效分析显示,TPS<1%组和1%≤TPS<10%组患者相比较,无论在PFS及OS还是疗效(ORR)上两组差异均无统计学意义(P>0.05)。而TPS≥10%组(高TPS组)患者与TPS<10%组(低TPS组)患者相比较,前者疗效获益优于后者,两组ORR分别为(56%vs42%,P=0.015)、中位PFS分别为(9.3个月vs8.7个月,P=0.078)、中位OS分别为(14.7个月vs14.3个月,P=0.082)。两组进一步根据中位PFS绘制ROC曲线,ROC曲线下面积AUC=0.58(95%CI: 0.762-0.978,P=0.078),表明其疗效预测灵敏度较低,故TPS不能作为疗效预测指标,见图10。

图10 低TPS组、高TPS组ROC曲线用于预测食管癌卡瑞利珠单抗联合化疗治疗效果的概率情况
因此,研究结果表明NLR2较TPS可以更好地预测卡瑞利珠单抗联合化疗治疗ESCC的效果及预后。
3 讨 论
EC是常见的消化道肿瘤,我国是全球EC高发国家,占全球的EC患者的一半,我国患病人群病理类型主要以ESCC为主(90%)[16]。手术、放化疗等传统治疗策略无法满足EC患者的需求。近年来,抗PD-1/PD-L1免疫治疗在EC患者中显示出了良好的治疗效果。本研究对卡瑞利珠单抗联合化疗治疗ESCC的临床疗效、安全性及其疗效预测等问题进行研究和探讨。
本研究中,研究组ORR、DCR、PFS、OS及新辅助治疗后手术等指标较对照组明显提高,表明卡瑞利珠单抗联合化疗相比单纯化疗治疗中晚期ESCC的疗效及生存获益更明显,能有效激发患者免疫抗肿瘤功能。本研究与其他相关研究相比,卡瑞利珠单抗联合化疗显示出相似的疗效及生存获益,例如KEYNOTE-590[17],该研究显示两组的中位OS分别为(12.4个月vs9.8个月)、中位PFS分别为(6.2个月vs4.6个月)、ORR分别为(37.3%vs20.0%);CheckMate-648研究[18]结果显示,两组中位OS分别为(13.2个月vs10.7个月)、ORR分别为(47%vs27%)。而同样采用卡瑞利珠单抗的ESCORT-1st研究结果显示,两组中位OS分别为(15.3个月vs12.0个月)、中位PFS分别为(6.9个月vs5.6个月)、ORR分别为(72.1%vs62.1%)[8],本研究结果与ESCORT-1st研究相比,本研究中研究组中位PFS与ESCORT-1st接近,但中位OS较ESCORT-1st较差,这可能与本研究为单中心回顾性研究、且入组部分患者到研究截止日期仍存活等因素有关(截至最后1次随访日研究组中34例患者存活,对照组3例患者存活)。
本研究中,虽然研究组部分不良反应与对照组相比发生率较高(P<0.05),但中晚期ESCC患者使用卡瑞利珠单抗联合化疗的不良反应在可控可接受范围之内,安全性尚可。但值得注意的是研究组出现18例次(18/310,5.9%)危及患者生命安全的严重不良反应事件,对照组出现5例次(5/271,1.8%)危及患者生命安全的严重不良反应事件,故治疗期间需要及时发现及处理。
研究发现,NLR是一种可以预测不同类型癌症的OS和抗PD-1/PD-L1治疗效果的生物标志物[19-20]。例如,NLR在预测进展期胃癌、结肠、直肠癌患者的生存方面具有临床应用价值[21]。因此,本研究假设上述能够影响多种恶性肿瘤的代表外周血细胞免疫反应的参数NLR也可能是ESCC患者对卡瑞利珠单抗联合化疗治疗反应的良好预测因子[22-23]。肿瘤患者处于高炎症状态[24],中性粒细胞和淋巴细胞是肿瘤免疫微环境的重要组成部分,在肿瘤相关免疫中发挥作用[25-26]。
在本研究中评估了NLR是否能够作为预测ESCC患者卡瑞利珠单抗联合化疗治疗反应的生物标志物。这是对92例ESCC患者外周血参数NLR与卡瑞利珠单抗联合化疗反应之间关系的研究。基于统计数据,发现第3次治疗后的NLR2与卡瑞利珠单抗联合化疗治疗的反应相关。根据既往研究[20,27],第3周期治疗后的NLR(本研究中的NLR2)可能是评估ESCC患者中NLR与抗PD-1抗体治疗反应之间相关性的合适时间,这可能与PD-1/PD-L1免疫检查点抑制剂与T细胞膜上表达的PD-1抗原结合后激活患者的抗肿瘤细胞免疫[5]、在此过程中机体抗肿瘤免疫系统重建并伴有NLR的改变有关[20]。NLR0、NLR1是本研究中接受第1次及第2次治疗后的NLR值,本研究中NLR0的中位阈值为5.84,NLR1的中位阈值数为4.52,而NLR2的中位阈值数为3.08,在治疗过程中随着治疗次数的增多出现NLR的中位数逐渐下降。这可能与随着免疫治疗次数的增多机体抗肿瘤免疫系统出现重建有关,即淋巴细胞逐渐增多、中性粒细胞逐渐减少。NLR升高表示淋巴细胞减少、中性粒细胞增多,从而抑制宿主免疫反应,血液NLR升高可能暗示炎症细胞存在于肿瘤微环境中,导致免疫逃逸或免疫干预[28]。
本研究发现,卡瑞利珠单抗联合化疗治疗后的低NLR2是ESCC患者卡瑞利珠单抗联合化疗效果的有利因素。本研究结果表明NLR2较TPS可以更好地预测卡瑞利珠单抗联合化疗治疗效果及预后,且NLR与TPS相比具有简便、易得的优点。
本研究中仍存在一些局限性。首先,本研究仅为单中心回顾性分析,样本量小,同时不可避免地存在一些偏倚和混杂因素。因此所得结论需进一步随机的、大样本量的前瞻性临床研究来证实。虽然有些不足,但本研究得出了卡瑞利珠单抗联合化疗ESCC治疗效果优于单纯化疗、安全性良好的结论,另外提供了一种简单、方便、无创的生物标志物(NLR2)来预测ESCC患者对卡瑞利珠单抗联合化疗治疗的反应,这可能有助于发展个体化治疗。
卡瑞利珠单抗联合化疗治疗中晚期ESCC患者的ORR、DCR、PFS、OS等指标相比单纯化疗患者均有所提高,患者生存时间进一步延长,且安全性在可接受范围之内。另外,本研究探索NLR与卡瑞利珠单抗联合化疗疗效之间的关系,确定NLR2是卡瑞利珠单抗联合化疗治疗ESCC的疗效预测因子。

