Polo 样激酶1 在肝细胞肝癌中的作用及临床意义
周 杰 李敬东 张立鑫 唐 涛
据2018 年全球癌症统计数据[1]显示,原发性肝癌发病率占所有癌症发病率的第六位,由于其复杂性、异质性,转移快,手术切除后易复发等特点占据癌症死因的第四位。原发性肝癌包括肝细胞癌(hepatocellular carcinoma ,HCC)、肝内胆管癌以及其他罕见类型,其中HCC 占75%~85%。目前,FDA 批准的治疗HCC 的小分子多靶点药物主要有索拉非尼和仑伐替尼[2],但两种靶向药物在临床应用过程中均会出现耐药现象,亟须找到新的治疗靶点,为HCC 的序贯治疗提供更多的选择,延长患者生存期。Polo 样激酶1(Polo-like kinase 1, PLK1)属于Polo 样激酶家族,多项研究证明,PLK1 在肝细胞肝癌的恶性转化、进展中起重要作用,并提出将其作为有潜力的治疗靶点[3-5]。本研究旨在探讨PLK1 在肝癌细胞中的表达及其影响肝癌进展的作用途径,并验证其小分子抑制剂GSK461364 对肝细胞肝癌的有效性,以期找到有效的肝细胞肝癌的诊疗靶点。
1 材料与方法
1.1 材料
1.1.1 细胞 HepG2 细胞购买自美国模式培养物集存库(American type culture collection,ATCC),且已进行短串联重复序列(Short Tandem Repeat,STR) 鉴定,传代次数20 代以内。使用癌症基因组图谱(The Cancer Genome Atlas)数据库分析PLK1 在中mRNA 的表达,从癌症基因组图谱(the Cancer genome atlas,TCGA)数据集(https://portal.gdc.com)获得的RNAseq 数据和相应的临床病理信息,包括肝癌患者肿瘤组织数据(369例)及肝癌患者癌旁组织数据(160 例),分析PLK1 在癌及癌旁组织样本的基因表达差异及PLK1 表达对肝癌患者生存的影响。
1.1.2 组织 随机选取2019 年1~6 月在川北医学院附属医院肝胆外一科接受手术治疗的肝癌患者30例为研究对象,包括男性21 例,女性9 例,年龄23~82岁,平均(53.1±17.0)岁。纳入标准:肿瘤最大直径>2 cm,术后石蜡病理结果确诊为肝细胞肝癌。排除标准:术前接受过抗肿瘤药物新辅助治疗者;存在活动性自身免疫病者;严重肝肾功能障碍者(包括肝肾功能衰竭、感染者)。术中留取大小约 0.5 cm3的肿瘤及癌旁组织,储存于液氮中。新鲜组织标本的获取经过川北医学院附属医院伦理委员会批准[伦理号:2019ER(A)067],且于术前获得患者知情同意并签字。
1.1.3 试剂及抑制剂 RPMI 1640 培养基、1%左旋-谷氨酰胺(L-glutamine,L-Gln)、1% 非必需氨基酸 (non-essential amino acids,NEAA) 、1% 双抗(链霉素 -青霉素,Penicillin-Streptomycin Solution,P-S)购自美国美国Gibco,逆转录-聚合酶链反应(reverse transcription polymerase chain reaction, RT-PCR)及实时定量聚合酶链反应(real-time quantitative polymerase chain reaction,qRT-PCR)试剂盒购自Takara,GSK461364 购自美国Selleck,PLK1 抗体、GAPDH 抗体、Ki-67 抗体购自CST,二抗、细胞裂解液、DAB 染色液、苏木素、过氧化氢、山羊血清购自碧云天,小干扰RNA 购自美国sigma,CCK8 试剂盒购自日本同仁,细胞周期试剂盒购自美国BD,Trizol 购自美国Invitrogen。
1.2 方法
1.2.1 细胞及培养人肝癌细胞 HepG2 购自ATCC细胞库,并经过了短串联重复序列(short tandem repeat,STR)鉴定。培养基配制:90% RPMI 1640 培养基、10%胎牛血清、1% L-Gln、1% NEAA、1% P-S,将HepG2 细胞置于含有5%CO2的37°C 培养箱中。
1.2.2 组织及细胞RNA 的提取 购买的HepG2 细胞使用0.25%EDTA 胰酶消化贴壁细胞,1 000 r/min 离心5 min,使用预冷PBS 清洗3 遍后,加入1 mL Trizol/106个细胞,室温静置10 min,加入1/5 体积氯仿,充分震荡后静置5 min 分层,12 000 r/min 离心10 min,小心吸取上层水相后加入等体积预冷异丙醇,温和混匀室温静置10 min,12 000 r/min 离心10 min ,弃上清,加入1 mL 75%乙醇清洗沉淀,12 000 r/min 离心10 min ,弃上清,生物安全柜中晾干,加入20~30 μL RNsase-free水,充分溶解后于-20°C 冰箱储存。分别取100 mg 癌及癌旁组织使用预冷PBS 反复清洗,去除组织中的血细胞,吸水纸吸干后置于研钵中,加入液氮,充分研磨至无小块,加入1 mL Trizol 静置10 min,后续步骤同细胞RNA 提取。
1.2.3 细胞蛋白的提取 使用0.25%EDTA 胰酶消化HepG2 细胞,1 000 r/min 离心5 min,使用预冷PBS 清洗3 遍后,加入300 μL 细胞中度裂解液/106个细胞,冰上裂解30 min 后,12 000 r/min 离心15 min 取上清,使用BCA 法测定蛋白浓度后,加入蛋白loading 于金属浴95°C 变性10 min 后,置于-20°C 冰箱待用。
1.2.4 RT-PCR 冰上配置RT-PCR 体系:5×Prime Script RT mix 2 μL、total RNA 500 ng、RNsase-free 水定容至10 μL。反应条件:37°C 15 min、85°C 5 s、4°C保存。
1.2.5 qRT-PCR 冰上配置qRT-PCR 体系:Super-Real PreMix Plus(2X)10 μL、上/下游引物(10μM)0.6 μL、cDNA 200 ng、RNsase-free 水定容至20 μL。反应条件:95°C 5 min、(95°C 10 s、63°C 5 s、72°C 1 min)39 cycles、4°C 保存。见表1。

表1 PLK1和β-Actin引物序列
1.2.6 小干扰RNA(small interfering RNA,siRNA)瞬时转染 将贴壁培养的HepG2 细胞消化离心后接种到6 孔板中,每组接种105个细胞,待细胞贴壁后,更换无血清培养基饥饿2 h,配置转染试剂:①5 μLsiRNA(20 μM)+125 μL 无血清培养基;②5 μL Lipofectamine 2000+125 μL 无血清培养基,静置5 min 后将①②体系柔和混匀,静置20 min 后加入6 孔板中,4~6 h 更换为完全培养基。
siRNA 序 列 , siPLK1-1 正 义 链 5’-GAAGAAGAUCACCCUCCUUA-3’,反 义 链 5’-UAAGGAGGGUGAUCUUCUUC-3’; siPLK1-2:正义链5'-UGAAGAAGAUCACCCUCCUUA-3' ,反义链 5'-UAAGGAGGGUGAUCUUCUUCA-3'。
1.2.7 Western blot 检测蛋白表达 将提取并变性的细胞裂解液样品加到10%电泳预制胶上样孔中,定压70 V,电泳30 min 后将电压调至120 V,电泳1 h。然后将蛋白定流300 mA 1 h 转移聚偏二氟乙烯膜(polyvinylidene fluoride,PVDF)上。将膜在室温下用5%脱脂奶粉封闭1 h。封闭后,分别将裁剪后的膜与兔抗人PLK1 抗体(1∶1 000)及兔抗人GAPDH 抗体(1∶1 000)在4°C 下孵育12 h,然后与山羊兔IgG 抗体(1∶4 000)在室温下孵育1 h。使用ECL plus 系统检测反应,用Quantity One 软件(Bio-Rad)分析印迹。
1.2.8 CCK8 实验及药物半数抑制浓度(half maximal inhibitory concentration,IC50)检测 将siRNA 或药物预处理的HepG2 细胞接种到96 孔板中,每组设置三个复孔,孵育6 h 以允许表面粘附。 每孔加入10 μL CCK8 孵育2 h 后检测0 h、24 h、48 h、72 h、96 h 吸光度评估生存力。测定IC50 每孔接种5 000 个细胞,细胞增殖实验,每孔接种1 000 个细胞。
1.2.9 平板克隆实验检测细胞增殖 将siRNA 或药物预处理的HepG2 细胞接种到6 孔板中,每组接种1 000 个细胞,设置3 个复孔,14 d 后收获细胞,使用预冷PBS 清洗,4% 多聚甲醛固定,结晶紫染色后拍照并计数。
1.2.10 细胞周期检测 将siRNA 或药物预处理的HepG2 细胞接种到6 孔板中,24 h 后用胰酶收获细胞至流式管,预冷PBS 清洗细胞三遍,在每个流式管中加入 500 μL PBS 含 5 μg/mL 碘化丙啶、100 μg/mL RNAseA、0.2%TritonX-100, 4℃避光孵育30 min,24 h 内上流式机检测。
1.2.11 动物模型的构建 使用HepG2 细胞构建裸鼠皮下成瘤模型,每只裸鼠注射5×105个细胞,于SPF 级环境下喂养2 周后,肿瘤体积生长至为0.5×0.5 cm2时,按照裸鼠体质量大小进行编号排序分为3 组,每组采取随机分配法分别纳入生理盐水注射组及GSK461364 注射组,每组3 只,分别给予生理盐水腹腔注射,及50 mg/kg GSK461364 腹腔注射,注射频率为4天一次,同时每隔4 天测量一次肿瘤大小及小鼠体质量,20 d 后收获皮下肿瘤。
1.2.12 免疫组织化学染色 解剖动物肿瘤组织使用生理盐水反复清洗,浸入10%的福尔马林固定12~24 h 后进行包埋切片。组织切片于70℃烤箱中融蜡2 h,分别在二甲苯Ⅰ、Ⅱ、Ⅲ溶液中浸泡30 min,无水乙醇、95% 乙醇、85% 乙醇、75% 乙醇中浸泡5 min 脱蜡,使用枸橼酸盐进行高压修复后,山羊血清10 min 及3%的过氧化氢30 min 封闭后,孵育Ki-67 一抗,4℃过夜。转天孵育二抗后进行DAB 染色、苏木素复染及梯度乙醇和二甲苯脱水处理后,晾干封片,于显微镜下观察、拍照。
1.3 分组情况 ①小干扰处理HepG2 细胞分为siCtrl组、siPLK1-1 组、siPLKI-2 组;②小分子抑制剂处理HepG2 细胞分为DMSO 组、GSK461364 组;③动物体内实验分为生理盐水注射组、GSK461364 注射组。
1.4 统计学方法 采用SPSS 26.0 进行数据整理与分析,计量资料使用表示,两组间差异进行独立样本t检验,多组间两两比较进行ANOVA 单因素方差分析;不符合正态分布的计量资料采用M(P25,P75)表示,采用Mann-WhitneyU检验;计数资料以例或率表示,采用χ2检验,根据TCGA 数据库对患者的无病生存期(disease free survival,DFS)进行log-rank 检验。以P<0.05 为差异有统计学意义。
2 结果
2.1 PLK1 在肝癌中的表达及临床意义 使用TCGA(The Cancer Genome Atlas)数据库分析PLK1 在肝癌组织(369 例)及癌旁组织(160 例)中mRNA 的表达,结果显示,PLK1 在肝癌中的表达水平明显高于癌旁组织,差异有统计学意义(P<0.05)。生存分析显示,PLK1高表达者(以基因表达的中位数为表达分界阈值)的DFS 明显低于PLK1 低表达者(P<0.05)。为进一步验证,提取我院30 例肝细胞肝癌患者的肿瘤组织及癌旁组织分析PLK1 mRNA 表达,结果显示,PLK1 在肿瘤组织的表达明显高于癌旁组织,差异有统计学意义(P<0.001)。见表2、图1。

图1 PLK1表达与肝细胞肝癌患者预后的生存分析分析
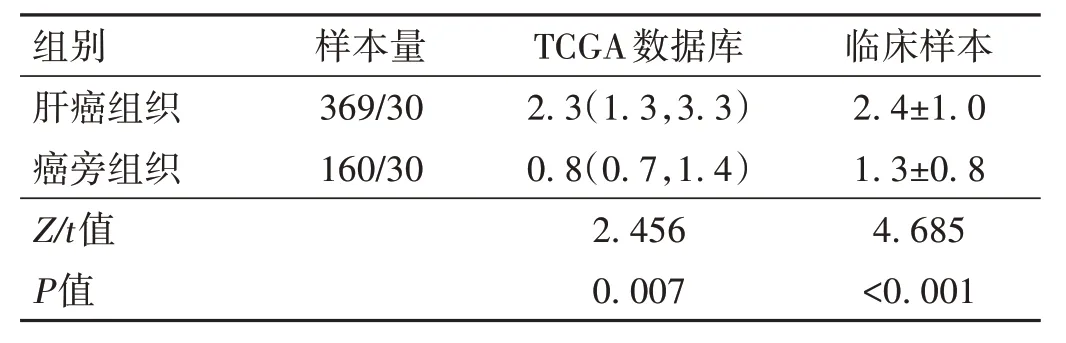
表2 PLK1在TCGA数据库及临床样本肝癌中的mRNA表达差异
2.2 3 组siRNA 敲低HepG2 细胞增殖情况比较 使用siRNA 敲低HepG2 细胞中PLK1 的表达,结果显示两对siRNA 对PLK1 的敲低效率分别为(71.3±4.8)%、(65.3±5.3)%[与对照组相比,相对灰度值分别为(0.2±0.2)比(1.0±0.2),t1=14.752,P<0.001;(0.4±0.2)比(1.0±0.2),t2=9.771,P<0.001](图2A),与siCtrl 组相比,siPLK1-1、siPLK1-2 组肝癌细胞HpG2 增殖能力明显降低[CCK8 实验中96 h 的细胞相对活力为[(4.4±0.2)比(9.8±0.2),t1=33.068,P<0.001;(4.8±0.2)比(9.8±0.2),t2=30.619,P<0.001]。平板克隆实验中细胞克隆数差异有统计学意义为[(20.8±4.3)比(201.5±8.9),t1=31.664,P<0.001;(28.6±5.0)比(201.5±8.9),t2=29.336,P<0.001](图2B)周期实验结果显示,与siCtrl 组相比,siPLK1 组的HpG2 细胞周期阻滞在G2 期[细胞G2 期比例为(37.2±1.7)%比(13.6±1.2)%,t1=19.644,P<0.001;(36.5±1.9)%比(13.6±1.21)% ,t2=17.001,P<0.001]( 图 2C)。见表3。
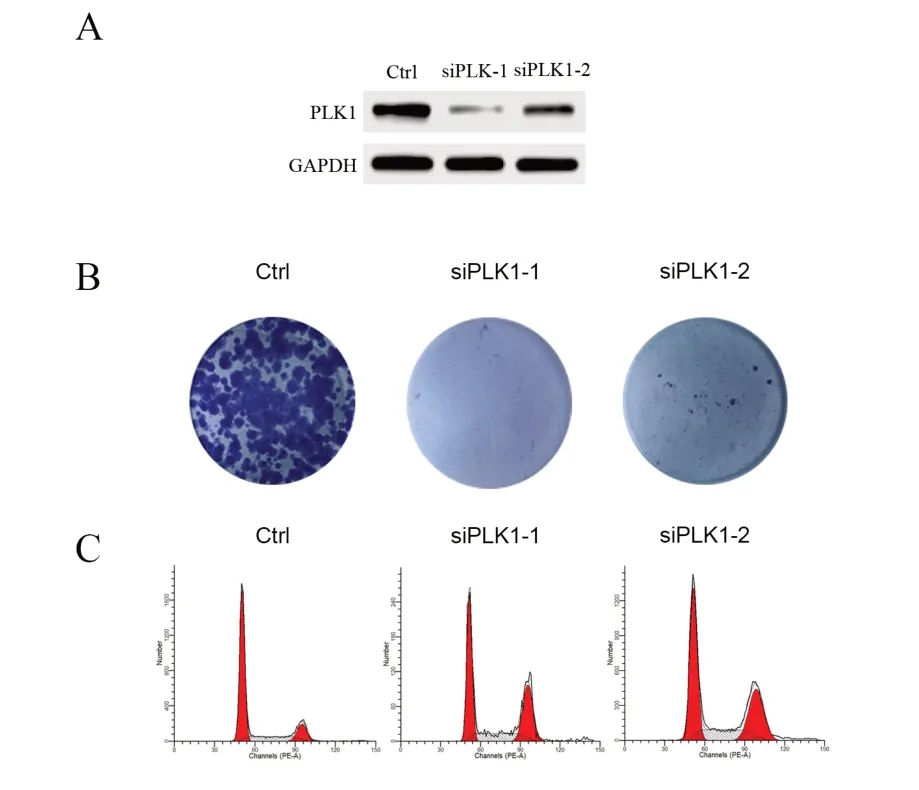
图2 siRNA敲低PLK1抑制肝癌细胞增殖
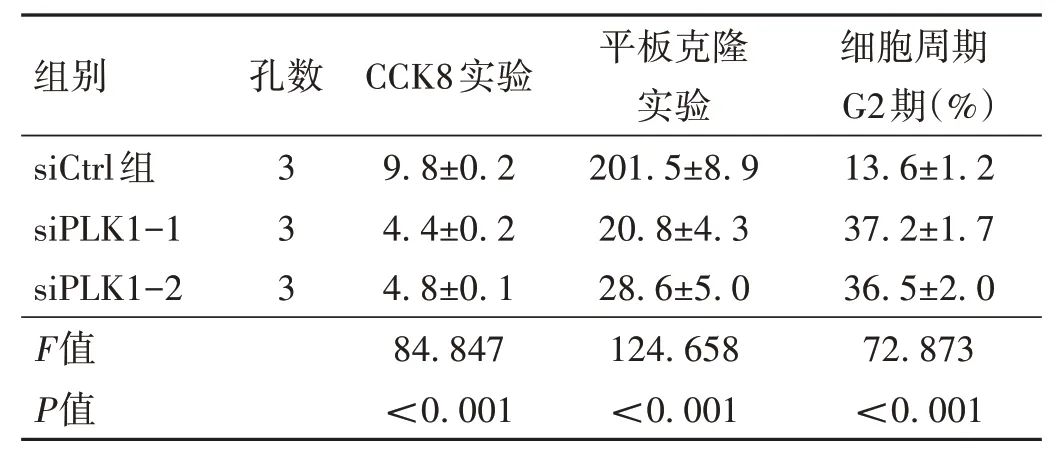
表3 敲低PLK1对肝癌细胞的增殖抑制作用比较
2.3 DMSO 组与GSK461364 组肝癌细胞增殖情况比较 随后使用PLK1 特异性小分子抑制剂GSK461364处理HepG2 细胞,测定IC50=24.960 nM,选用25 nM浓度,分别进行CCK8、平板克隆及细胞周期实验,结果显示,与DMSO 组相比,GSK461364 组细胞相对活力明显降低(P<0.001)。细胞克隆数明显减少,差异有统计学意义(P<0.001)(图3A),细胞周期阻滞在G2 期,与siRNA 处理后实验结果一致,差异有统计学意义(P<0.001)(图3B),GSK461364 可有效抑制肝癌细胞系HepG2 的增殖,差异有统计学意义。见表4。

图3 PLK1小分子抑制剂GSK461364抑制肝癌细胞增殖

表4 GSK461364抑制肝癌细胞增殖能力情况
2.4 生理盐水注射组与GSK461364 注射组抑制HepG2 移植瘤增殖情况比较 使用HepG2 细胞构建裸鼠皮下成瘤模型进行体内给药处理,结果显示相对于生理盐水注射组,GSK461364 注射组的肝癌生长速度明显减慢(P<0.001);Ki-67 染色阳性率明显降低(P<0.001)。见图4、表5。

图4 PLK1小分子抑制剂GSK461364在动物体内抑制肝细胞肝癌进展
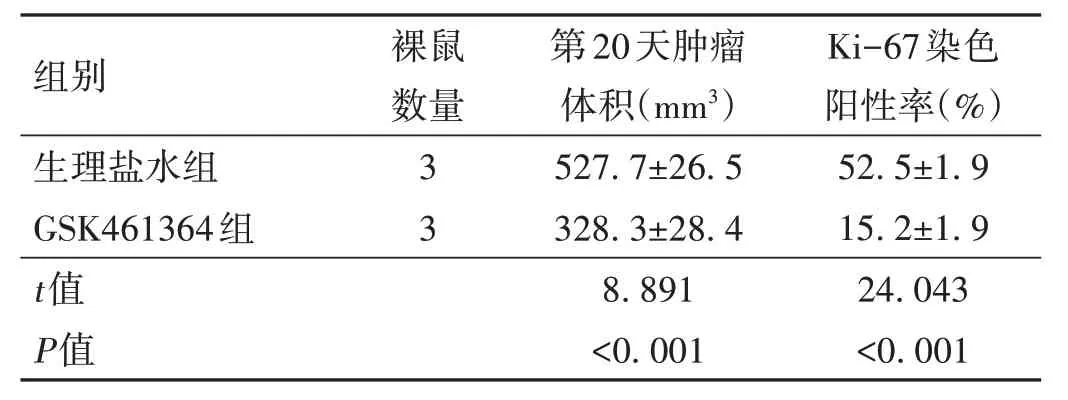
表5 GSK461364在动物体内抑制肝细胞肝癌进展能力情况
3 讨论
HCC 患者就诊断时通常已处于晚期阶段,死亡率极高,是癌症相关死亡率的第二大诱因[6-8]。癌细胞的恶性增殖受多种信号通路的调控,靶向癌细胞不可控制的有丝分裂过程关键成分是抑制其进展最重要的治疗方法之一,尤其是靶向关键有丝分裂激酶的新型抗有丝分裂剂的开发,具有抗击HCC 的巨大潜力[9]。PLK1 是一种丝氨酸/苏氨酸激酶,广泛存在于真核细胞中,已被确定是细胞周期进程,尤其是有丝分裂的关键调节剂,在细胞周期调控中起着关键作用,被认为是HCC 中有希望的靶标。
作为PLK 家族的成员,PLK1 蛋白主要分为三个功能不同的结构域:高度保守的N 末端激酶催化结构域(APT 结合区和T-loop 区),C 末端polo-box 结构域以及中间的连接区域。PLK1 蛋白可以通过polo-box 结构域与某些蛋白的磷酸肽结合。在正常情况下,polobox 结构域总是与N 末端激酶结构域结合,以抑制激酶中T210 的磷酸化,从而抑制PLK1 的激酶活性。当polo-box 结构域与不同的磷酸肽相互作用而募集到特定的细胞位置时,其激酶结构域被释放,PLK1 被激活,磷酸化不同的蛋白质或同一蛋白质的不同位点[10],调节发育、细胞有丝分裂及DNA 损伤应答等过程。PLK1在多种类型的肿瘤细胞中异常表达[11-14],并且PLK1 水平升高与肿瘤发生和不良的临床预后密切相关。多项研究显示,PLK1 的过表达与转移性HCC 疾病和HCC预后不良有关[5,15-17]。本项研究中,在大多数HCC 患者中发现了PLK1 基因的过表达,这表明PLK1 可能在HCC 的肿瘤发生中起作用;生存分析显示,PLK1 的高表达与更低的HCC 总体生存率相关,表明PLK1 同时可能在HCC 的发展中起重要作用,是HCC 诊断及预后的潜在靶点之一。另一方面本研究体外CCK8、平板克隆结果显示,敲低PLK1 蛋白表达,HepG2 细胞增殖速度明显减慢。PLK1 在细胞周期的G2 期后期被激活,是进入有丝分裂所必需的[18],本研究流式细胞学结果显示,敲低PLK1 后,细胞周期阻滞在G2/M 期,验证了PLK1 可促进肝癌细胞增殖。因此, PLK1 可被认为是HCC 潜在治疗靶点之一。
GSK461364 是可逆的ATP 竞争性的PLK1 选择性抑制剂, 对PLK1 的选择性比对PLK2 和PLK3 的选择性高至少390 倍,抑制PLK1 会导致细胞中有丝分裂延迟延长,有丝分裂异常退出和p53 活化,相对其他抑制剂治疗时产生的毒性相关副作用更少,在乳腺癌、神经系统肿瘤等多种肿瘤中已得到应用[19-20]。本研究体外使用PLK1 小分子抑制剂GSK461364 处理HepG2 细胞,检测药物IC50=24.96 nM,表明肝癌细胞对GSK461364 具有较高的敏感性,低剂量即可产生明显的抑制作用,CCK8、平板克隆结果显示,GSK461364 可有效抑制HCC 细胞增殖,诱导细胞发生G2 / M 阻滞,抑制肝癌进展。本研究证明PLK1 在肝细胞肝癌中的促癌作用,将其预测为治疗的潜在靶点,但存在一定的局限性。首先,目前对于PLK1 在肝细胞肝癌中表达升高的调控机制,以及PLK1 诱导肝细胞肝癌进展的下游通路仍无明确报道,有待进一步寻找并验证。其次,GSK461364 目前仅完成了淋巴瘤的临床试验,在肝癌中的大规模临床试验仍未开展,但本研究中的体内给药疗效为该肝细胞肝癌恶性进展相关靶点抑制剂的临床转化提供了良好的实验室基础。
综上所述,PLK1 在大多数肝癌患者中高表达,与肝癌的发生、发展及不良预后密切相关,是潜在的诊疗靶点,其小分子抑制剂GSK461364 在动物体内的应用可有效降低肝细胞肝癌的恶性程度,抑制肿瘤进展,可作为有效的治疗策略之一,具有良好的临床转化前景。

