药品微生物限度检查真菌污染鉴定溯源*
黄 结,李雪玲,朱 斌,甘永琦,王 涛,零文超
2020年版《中国药典(四部)》[1]指导原则9203中规定,当药品微生物检验结果不符合药典各品种项下要求或另外建立的质量标准时,应调查原因。《药品生产质量管理规范》(GMP)第224 条规定,实验室检验超标结果(OOS)需按操作规程进行完整地调查。进行OOS调查,找到微生物污染的根本原因,可为准确判定超标结果是否真实有效提供依据,利于检测机构或企业有针对性地采取有效纠正和预防措施,避免同类事件再次发生,提高实验室管理质量,同时为检验结果和产品风险作出准确判断提供支撑[2]。微生物鉴定和溯源分析,对于确定微生物污染原因具有重要意义[3]。但截至目前,微生物溯源分型技术为无统一标准,不同分型方法各有其局限性[4],其中内转录间隔区(ITS 序列)分析技术具有高通量、高效率、高准确率等特点,属基因型鉴定技术,可实现微生物的鉴定、分类、溯源及污染调查分析[5]。本研究中以ITS 序列分析技术和基质辅助激光解离飞行时间质谱(MALDI-TOF-MS)技术,对实验室一次样品真菌污染事件与OOS 调查采集到的环境相似菌株进行鉴定和溯源分析,为生产企业和检测机构样品污染真菌的溯源和控制提供依据和方法。现报道如下。
1 材料与方法
1.1 仪器
GR110DR 型高压蒸汽灭菌锅(美国Zealway 公司);AC2-6S1/A2级双人操作生物安全柜(新加坡Esco公司);BD720 型恒温培养箱(德国Binder 公司);MM400 型冷冻研磨仪(德国Retsch 公司);JY300C 型电泳仪、JY -SPFT 型水平电泳槽(北京君意东方电泳设备有限公司);5200 系列凝胶成像仪(上海天能科技有限公司);U410 - 86 型超低温冰箱(英国New Brunswick 公司);DM6000B型显微镜(德国Leica公司);Microflex LT型基质辅助激光解析飞行时间质谱仪(德国Bruker Daltonik GmbH公司);Universal 320R型高速冷冻离心机(德国Hettich公司);Mastercyler gradient PCR仪(德国Eppendorf公司)。
1.2 试剂
pH 7.0 无菌氯化钠- 蛋白胨缓冲液(批号为210310)、沙氏葡萄糖液体培养基(批号为201112),均购自北京陆桥技术股份有限公司;沙氏葡萄糖琼脂(SDA)培养基(德国Merck Millipore 公司,批号为VM906938);乙腈、三氟乙酸(色谱纯)、MALDI-TOFMS 基质、标准肽蛋白(德国Bruker Daltonik GmbH 公司);聚合酶链式反应(PCR)引物(北京天根生化科技有限公司);水为无菌水。
1.3 菌株来源
从药品微生物限度检查霉菌和酵母菌总数项目超标1次案例中,分离纯化的样品污染的主要霉菌标记为YP01 - YP04,OOS 调查采集到的相似环境菌标记为HJ01-HJ08。菌株来源见表1。

表1 菌株来源Tab.1 Origin of strains
1.4 菌株鉴定方法
传统形态观察法:无菌操作下接种各菌株于SDA平板上,23 ℃培养5 d,观察菌落的颜色、形状、大小、表面状况、质地等形态特征,拍照并记录。取适量培养物,封固液(乳酸品红)制片,置显微镜油镜下直接观察。
ITS 序列分析法:采用北京天根生化科技有限公司DP350 天根植物基因组DNA 提取试剂盒(植物、真菌DNA提取均可使用)进行真菌DNA 的提取,具体操作参考说明书。PCR 扩增引物序列:ITS1,5'-TCCGTAGGTGAACCTGCGG - 3' ;ITS4,5' - TCCTCCGCTTATTGATATGC - 3'。扩增体系为25 μL,其中10 × Buffer(Mg2+Plus)2.5 μL,引物(10 μmol/ L)1.5 μL,dNTP(10 mmol/ L)2 μL,Taq 酶(5 U/ μL)0.125 μL,DNA 5 μL,ddH2O 13.875 μL。扩增程序为,98 ℃,5 min;98 ℃10 s,58 ℃30 s,72 ℃60 s(共35 个循环);72 ℃10 min。得到的PCR 产物一部分用于凝胶电泳检查,一部分进行ITS 序列测序,测序委托北京乐八科技有限公司完成。利用NCBI BLAST 工具将得到的菌株序列与Gen-Bank 基因库中已知菌的序列进行比对,得到菌株鉴定结果。
1.4.3 MALDI - TOF - MS 鉴定法
采用甲酸乙腈提取法制备霉菌样品[6]。取培养后菌株的菌丝体约10 mg,置离心管中,加入300 μL水,混匀,再加无水乙醇900 μL,混匀,13 000 r/ min 离心2 min,弃去上清液,室温静置2 min;待菌体完全干燥,加入70%甲酸溶液50 μL,混匀,室温静置2 min,加入乙腈50 μL,混匀,13 000 r/min离心2 min;取1 μL上清液滴加至MALDI 靶板上,室温晾干,加1 μL HCCA 基质溶液,覆盖晾干,将靶板置入MALDI-TOF-MS质谱仪中进行菌株鉴定。
2 结果
2.1 菌落形态与显微形态
将样品检出的霉菌和采集到的环境霉菌同法培养后,取菌落形态相似的菌株一并进行鉴定溯源。样品菌YP01 的菌落形态和显微形态见图1,各菌株的菌落形态和显微形态描述见表2。

A. 菌落形态 B. 显微形态图1 菌株(YP01)的菌落形态与显微形态A.Colony morphology B.Microscopic morphologyFig.1 Colony morphology and microscopic morphology of the strain(YP01)

表2 各菌株鉴定结果Tab.2 Results of strain identification
2.2 ITS 序列鉴定
凝胶电泳检测结果显示,12 个菌株的PCR 产物均在500~600 bp 之间得到清晰、完整的电泳条带,详见图2。12个菌株的PCR产物鉴定结果最大鉴定率均大于99%(基因测序鉴定结果鉴定率大于98.7%,即与标准菌株序列同种[7-8]),表明结果可靠。ITS 序列鉴定结果见表2。
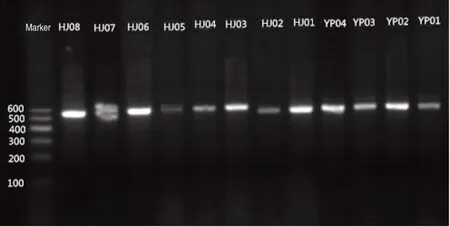
图2 PCR产物的凝胶电泳检测结果Fig.2 Results of gel electrophoresis detection of PCR products
2.3 MALDI-TOF-MS 鉴定
HJ02 - HJ08 的鉴定分值均大于2.0 分,表示鉴定结果准确,可鉴定出具体菌名。YP01-YP04 和HJ01 未给出具体鉴定结果,所测物质蛋白分子量主要集中在2 000~18 000 Da 范围内(质谱图见图3),在横坐标相同的点上有峰强度增强,各菌株主要质谱峰重叠度高。
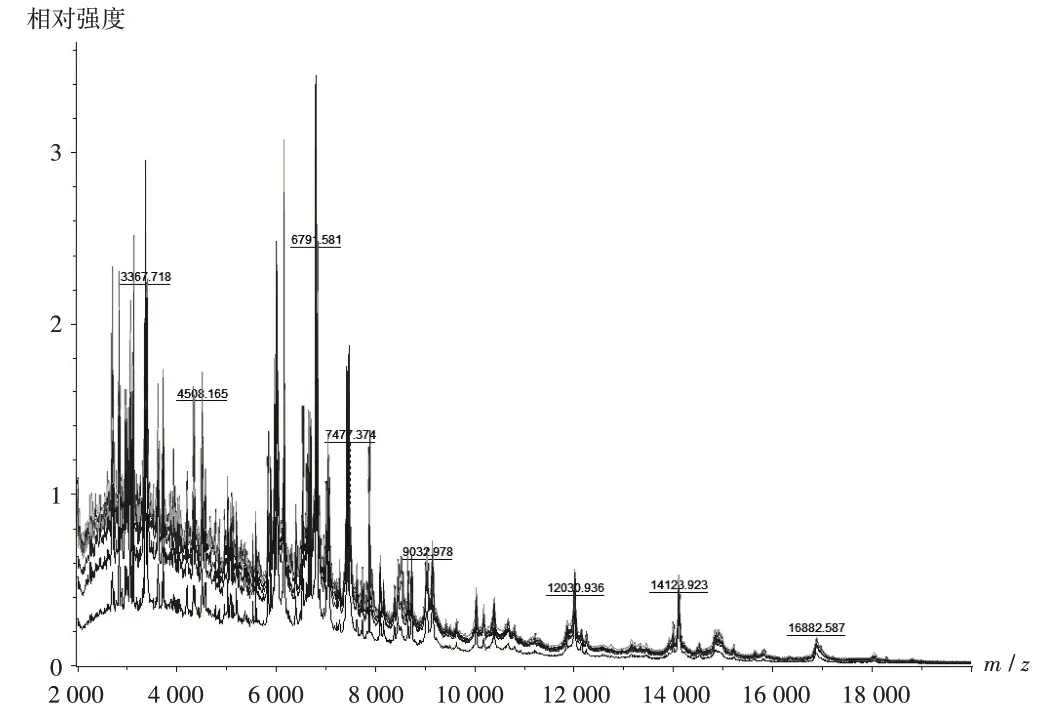
图3 菌株的叠加质谱图Fig.3 Superimposed mass spectrograms of strains
2.4 同源性分析
利用MEGA 5.0 软件对12 个菌株的序列进行比对,采用Neighborhood - Joining 法构建有根系统发育树,结果见图4。样品菌YP01-YP04 和环境菌HJ01 的基因水平无明显差异,能聚为一类,存在同源性。
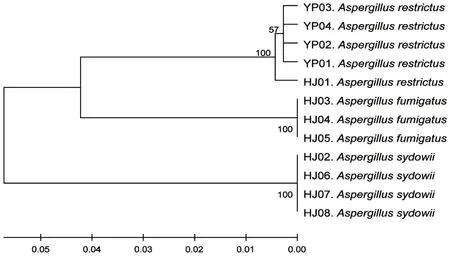
图4 菌株系统发育树Fig.4 Phylogenetic tree of strains
3 讨论
在同一天实验中出现多批样品真菌结果超标,从超标样品SDA 平板上观察发现真菌形态非常相似,怀疑样品受到了环境菌污染,触发了实验室OOS 调查。实验员从人、机、料、法、环5个方面回顾整个检验流程,逐一排查原因,并使用SDA 接触皿进行洁净环境多地点采集和实验用料的微生物检测,共找到了8株与超标样品相似的真菌。鉴定及同源性分析显示,得出样品检出菌YP01 - YP04 和环境菌HJ01 存在同源性,即样品污染菌来自pH 7.0 氯化钠- 蛋白胨缓冲液,是实验用“料”出现问题。配制员再次针对同批次的实验用料进行全面排查和回顾,其受污染的可能原因如下。一是使用的稀释液经压力蒸汽灭菌后存在有灭菌容器瓶的胶塞松动或容器倾倒现象,配制员操作是扭紧胶塞或扶正容器,继续放入实验室,稀释液存在微生物污染风险;二是灭菌后的实验材料未及时放入洁净环境暂存室。针对以上原因实施如下纠正预防措施:1)重新换购一批匹配的胶塞;2)发现灭菌后容器胶塞有松动或容器倾倒,应立即丢弃;3)及时将灭菌物品移入洁净环境暂存室。经过一段时间的验证再无类似事件发生。
局限曲霉菌是人及动物曲霉病的病原菌,广泛分布于土壤、食品和发霉纸盒及织物等,可通过呼吸道和血液传播,可侵犯皮肤、黏膜、眼脑、耳鼻、肺部、胃肠道、神经系统和骨骼等,严重者可导致败血症。温暖潮湿环境利于其生长和繁殖,可产生大量的分生孢子,易于烟雾化存在于空气中,可通过实验人员、物品传递和空气流动污染实验室洁净区。针对实验室洁净区霉菌污染高风险点,加强清洁灭菌,定期采用过氧化氢杀孢子剂等进行彻底消杀,可确保洁净区洁净。
MALDI-TOF-MS 鉴定发现,局限曲霉菌的菌株蛋白质图谱较佳,但MALDI-TOF-MS 的数据库中缺少局限曲霉,未得到鉴定结果。同源性分析发现,YP01-YP04 和HJ01 的ITS 序列能聚为最小分支,质谱峰重叠度高,菌落形态和显微形态相同,因此真菌YP01 -YP04和HJ01亲缘关系非常接近。
ITS 序列鉴定分析结果发现,鉴定菌株序列与基因库中的标准序列进行比对时会至少出现2 个匹配结果且最大鉴定率均为100%的情况,因此本研究中还结合了形态学观察结果,以得到准确的鉴定结果[9]。霉菌的ITS 序列在结构和功能上具有高度保守性,是微生物核酸测序鉴定分类中得到广泛应用的DNA 特征性核酸序列之一,方法易于标准化[10-11]。这也是本研究中采用ITS 序列分析技术进行霉菌污染溯源的原因,且该方法简单、快速、重复性好。

