电针对佐剂性关节炎大鼠膝关节滑膜VEGF/Vav2/Rac1信号通路的影响
孙晓莹,龙轶映,赵凌云,吴庆泽,瞿启睿,祁 芳,刘 梨,艾 坤*,张 亮*
1 湖南中医药大学针灸推拿与康复学院,湖南 长沙410208;2.湖南中医药大学附属第一医院,湖南 长沙410007;3 湖南中医药大学继续教育学院,湖南 长沙410208
类风湿关节炎(rheumatoid arthritis, RA)是一种以侵蚀性关节滑膜炎症为主要特征的自身免疫性疾病,血管新生是滑膜组织病变的重要病理基础,在RA 滑膜血管翳的形成与发展中有着关键作用。 最新研究表明,抑制血管新生可作为治疗RA 的重要靶点[1]。 在血管新生过程中,内皮细胞迁移是其重要环节,而伪足生成在细胞迁移中起关键作用[2-4]。 有研究表明,血管内皮生长因子(vascular endothelial growth factor, VEGF)可通过激活Ras 相关C3 肉毒素底物1(Ras-related C3 botulinum toxin substrate 1,Rac1)诱导细胞前端片状伪足形成来刺激内皮细胞迁移[5],这一激活过程与鸟嘌呤核苷酸交换因子(guanine nucleotide exchange factors, GEFs)密切相关。 与二磷酸鸟苷(guanosine diphosphate, GDP)结合的非活性状态的Rac1-GDP 可被GEFs 激活转换为与三磷酸鸟苷(guanosine triphosphate, GTP)结合的活性状态的Rac1-GTP[6-7]。 鸟嘌呤核苷酸交换因子2(vav guanine nucleotide exchange factor 2, Vav2)是一种常见的GEFs,VEGF 可调控Vav2 促进Rac1-GDP转化为Rac1-GTP,使Rac1 活化,促进伪足形成,从而刺激内皮细胞迁移[8-10]。 因此,通过调控VEGF/Vav2/Rac1 信号通路,抑制滑膜内皮细胞伪足生成,是抑制RA 血管新生的重要途径之一。
本课题组前期研究表明,电针“关元”“足三里”“阿是穴”能明显减轻佐剂性关节炎(adjuvant arthritis, AA)模型大鼠足跖关节肿胀程度,降低相关细胞因子含量,从而减轻炎症反应[11-12]。 另有研究证实,电针可以有效抑制滑膜内血管生成,减轻RA滑膜炎症,且与VEGF 相关[13-14]。 为了探索电针抑制RA 滑膜血管新生的内在机制,本研究拟以AA 大鼠模型为观察对象,采用电针干预,从调节VEGF/Vav2/Rac1 信号通路、抑制内皮细胞伪足生成、抑制血管新生的角度,探讨电针在RA 治疗中对血管新生的作用机制,为电针治疗RA 的临床应用提供科学依据。
1 材料与方法
1.1 实验动物与分组
40 只SPF级SD 雄性大鼠均由湖南斯莱克景达实验动物公司提供,体质量(100±10) g,动物合格证号:430727211101621817,实验动物生产许可证号:SCXK(湘)2019-0009。40 只大鼠以3 只一笼饲养在湖南中医药大学动物实验中心,饲养室温度(23±3) ℃,相对湿度60%±10%。适应性饲养7 d后开始实验,按随机数字表法将其分成空白组、模型组、西药组、电针组,每组10 只。 实验全程遵从《关于善待实验动物的指导性意见》(2006 年版)中动物伦理学有关条规,本实验伦理编号:LLBH-202203140004。
1.2 主要试剂与仪器
灭活结核分枝杆菌(美国BD 公司,批号:231141);矿物油(美国Sigma Aldrich 公司,批号:M8410);甲氨蝶呤(美国AbMole Bioscience 公司,批号:M2228);二喹啉甲酸(bicinchoninic acid, BCA)蛋白浓度测定试剂盒(美国Thermo Scientific 公司,批号:QB214754);VEGF 抗体(美国Cell Signaling Technology 公司,批号:65373);Vav2 抗体、Rac1 抗体、β-actin 抗体、Rabbit 二抗(美国Proteintech Group 公司,批号:21924、24072、20536、SA00001-2);显影液(苏州科达科技股份有限公司,批号:6610190);ECL 发光液(美国Advansta 公司,批号:K-12045-D50);4%多聚甲醛(广州硕谱生物科技有限公司, 批号:BL539A);DAB 显色液(北京索莱宝科技有限公司,批号:SW1020)。
电针治疗仪(苏州医疗用品有限公司,型号:SDZ-II);超净工作台(苏州净化设备厂,型号:SWCJ-1FD);高速低温离心机(美国SCILOGBX 公司,型号:D3024R);电泳仪(美国BIO-RAD 公司,型号:041BR126545);GloMax 酶标仪(美国Promega 公司,型号:GM3030);磁力恒温搅拌器(金坛市城西峰峥嵘实验仪器厂,型号:HJ-4A);足跖容积测量仪(济南益延科技发展有限公司,型号:YLS-7C)。
1.3 模型制备
本实验采用完全弗氏佐剂注射尾根部皮下组织制作AA 大鼠模型[15-16]。 将定量的灭活结核分枝杆菌与矿物油在通风柜中混合研磨至溶液清透无杂质,制成2.5 mg/mL 的完全弗氏佐剂;然后依次将模型组、西药组、电针组大鼠用异氟烷呼吸麻醉,用0.1 mL的微量注射器于尾根部皮下缓慢注射佐剂(0.1 mL/只)。 观察大鼠关节外表现,进行模型评价,造模后第3 天出现尾根部红肿,全身性关节继发症状出现,造模后第9~12 天关节红肿明显加剧,其余关节也出现症状,大鼠食欲减退、体质量减轻和皮温变高,则判定为模型制备成功[15-17]。
1.4 干预方法
于造模第2 天开始干预,空白组、模型组大鼠以仰卧位固定于自制鼠板上20 min,不做其他处理。电针组大鼠仰卧位固定于鼠板上,75%乙醇消毒穴位局部皮肤,使用华佗牌针灸针(0.25 mm×25 mm)直刺“足三里”“关元”“阿是穴”,穴位参照“十三五”国家规划统编教材《实验针灸学》中的大鼠标准穴位图谱进行定位[18],针刺深度为3~4 mm,然后接电针(左侧足三里与关元配穴,右侧足三里与同侧阿是穴配穴),选择疏密波(20/50 Hz),电流强度通过观察针柄处抖动情况来判读,轻微抖动即可,留针20 min。均每天1 次,7 次为1 个疗程,共干预3 个疗程。西药组使用阳性对照药物甲氨蝶呤,按每只0.35 mg/kg灌胃给药[19],每周1 次,共干预3次。
1.5 取材
于干预后禁食24 h,隔天在无菌操作台上用刀片拨开大鼠膝关节囊,取出清透淡黄色的滑膜组织,放入做好标记的冻存管中,分别于液氮中或装有4%多聚甲醛的试剂管中保存。
1.6 指标检测
1.6.1 一般情况观察 于实验过程中,观察造模后第1、9、12、15、18、21 天大鼠的饮食、毛发、体质量、关节肿胀等一般情况的变化。
1.6.2 足跖容积测量 测量前,用防水不掉色黑色记号笔在大鼠后足踝关节处标好测量标线,为减少人为误差,每次测量标线以及测足肿均由专人完成,并且每次标线的位置不宜有较大偏差,应在第1 次测量时使用墨水针头纹好一点作为标线固点。 将足肿测量仪放置水平固定的台面上进行校零,量杯中装适量蒸馏水,测量时测量者先将大鼠一侧后足抻直,放进装有适量蒸馏水的量杯中,直到后足的标线与量杯中的液面平行,重复3 次,再换下一侧后足,记录读数,后取其平均值进行数据统计。在造模后第1、9、12、15、18、21 天进行足跖容积的测量。
1.6.3 HE 染色 备取使用4%多聚甲醛固定好的膝关节滑膜组织,标定组号,流水清洗2 h,然后取出滑膜组织进行脱水,于56 ℃的石蜡浸泡进行包埋,包埋成块后,把石蜡置于切片机中,切分成5 μm 的石蜡片,石蜡片放入水浴锅后展开贴在载玻片上,60 ℃烘箱烘干2 h。脱蜡后放入苏木素溶液中染色5 min,接着使用蒸馏水冲洗,浸透于1%氨水中返蓝,清水冲洗30~60 s 后,于显微镜下观察细胞核的分色程度,之后置于1%伊红中染色,蒸馏水冲洗后脱水,最后每个组织滴加一滴中性树胶,盖上盖玻片。每个片子分别拍100×视野。
1.6.4 免疫组织化学检测 备取用4%多聚甲醛固定好的膝关节滑膜组织,每组抽取5 只大鼠并标定组号,流水清洗2 h,然后取出滑膜组织,依次浸透于不同浓度的乙醇、二甲苯中进行脱水,然后于56 ℃的石蜡浸泡进行包埋,包埋成块后,把石蜡置于切片机中,切分成5 μm 的石蜡片,石蜡片放入水浴锅后展开贴在载玻片上,60 ℃烘箱烘干2 h。 脱蜡后放置高压喷气中抗原修复,喷水致冷后将石蜡片放入10%羊血清中,室温封闭1 h,去除封闭液后,滴加抗体,37 ℃孵育1 h 后,PBS 清洗4 次,每次5 min。 接着加相对应的二抗孵育,孵育后PBS 摇洗5 min,10 次。 之后配备DAB显色液,即配即用,显微镜观察显色,然后复染、脱水。每个切片上滴注些许中性树胶后盖上盖玻片。 每个片子分别拍400×视野;采用Image-Pro Plus 6.0 软件测量平均光密度值,为便于计算,将空白组平均数赋值为1,进行数据归一化处理,最终采用SPSS 26.0 分析结果。
1.6.5 Western blot 检测 每组另5 只大鼠各取100 mg 膝关节滑膜组织样本,随后加定量混有蛋白酶、磷酸酶抑制剂的蛋白裂解液,搅匀混合溶液,使用匀浆机匀浆4 min,再将得到的样品裂解30 min,裂解全程均在冰上操作,裂解完全后以4 ℃、半径8 cm、12 000 r/min 离心20 min,利用BCA 蛋白质定量法测定离心得到的上清液蛋白浓度,得到蛋白质样品液。取蛋白质样品液30 μg,加上一定蛋白上样缓冲液,放入恒温槽中沸水浴10 min,再以半径8 cm、10 000 r/min 离心10 min;随之计算蛋白分子量,选择制备10%或12%的分离胶、浓缩胶,将之电泳,接着进行电转, 将胶上的蛋白转移至PVDF 蛋白印迹膜;下一步进行封闭,将PVDF 膜全部浸泡于封闭液中,室温25 ℃孵育1 h,然后摇洗3 次,每次10 min;而后分别加入一抗(VEGF 稀释度1∶1 000;Vav2 稀释度1∶500;Rac1 稀释度1∶800),放入4 ℃冰箱过夜,隔天用PBST 洗膜,每次20 min,摇洗3 次后,使用移液枪吹打入相对应的二抗溶液(稀释度1∶1 000),室温25 ℃孵育1 h;再用PBST 摇洗3 次,每次10 min,滴加显影液,反应2 min 后进行曝光显影,得到条带采用Image J 软件行灰度分析,数据根据相对应的内参对比,为便于计算与直观,将空白组平均数赋值为1,进行数据归一化处理,最终采用SPSS 26.0 分析结果。
1.7 统计学分析
采用SPSS 26.0 分析数据,GraphPad Prism 8.0.2软件制作图表。 全部数据用“±s”表示,符合正态分布和方差齐性,使用单因素方差分析法,进一步两两比较用LSD 检验;方差不齐则采用Tamhane's T2 多重检验。 不满足正态性则采用非参数检验。 均以P<0.05 为差异有统计学意义。
2 结果
2.1 各组大鼠一般情况
模型组大鼠活动及饮食减少,于造模后第3~5天尾根部出现脱皮、红肿,甚至出现溃烂,第9~12天后足、关节、耳朵、眼角陆续出现肉眼可见的红肿,第15~18 天症状达到高峰期。 各组大鼠第1 天体质量比较,差异均无统计学意义(P>0.05)。相较于空白组,模型组大鼠于造模后第9、12、15、18、21 天体质量降低(P<0.05,P<0.01);西药组体质量于造模后第9、12、15 天差异均无统计学意义(P>0.05),于第18、21 天降低(P<0.01);电针组体质量于造模后第9、15天差异均无统计学意义(P>0.05),第12、18、21 天均降低(P<0.05,P<0.01)。与模型组相比,西药组体质量在造模后第9、21 天差异均无统计学意义(P>0.05),在第12、15、18 天均升高(P<0.01);电针组体质量在造模后第1、9 天差异均无统计学意义(P>0.05),在第12、15、18、21 天均升高(P<0.01,P<0.05)。 与西药组相比,电针组体质量差异均无统计学意义(P>0.05)。详见图1。
2.2 各组大鼠足跖容积比较
各组大鼠在造模后第1、9 天足跖容积比较,差异均无统计学意义(P>0.05)。相较于空白组,模型组大鼠于造模后第12、15、18、21 天足跖容积增大(P<0.05,P<0.01),结合一般情况,提示模型制备成功;西药组足跖容积于造模后第12、15、18 天差异均无统计学意义(P>0.05),于第21 天增大(P<0.05);电针组足跖容积于造模后第12、18 天差异均无统计学意义(P>0.05),第15、21 天均增大(P<0.05)。 与模型组相比,其余3 组足跖容积于造模后第12 天差异均无统计学意义(P>0.05),西药组足跖容积在造模后第15、18、21 天均减小(P<0.05,P<0.01),电针组在第21 天明显减小(P<0.01)。 与西药组相比,电针组足跖容积差异均无统计学意义(P>0.05)。 详见图2。

图2 各组大鼠造模前后各时点足跖容积比较(±s,n=10)
2.3 各组大鼠组织形态学结果比较
空白组大鼠膝关节滑膜组织内衬层细胞排列规则(图3 箭头①),未见炎细胞浸润;与空白组相比,模型组大鼠滑膜组织结构呈现异常,滑膜组织出现一定增生,可见大面积胶原纤维组织增生(图3 箭头②),诸多炎细胞浸润(图3 箭头③),大量血管增生(图3 箭头④);与模型组相比,电针组和西药组滑膜结构较好,细胞密度明显降低,滑膜组织增生一定程度缓解,出现较小面积的胶原纤维组织增生,炎细胞浸润较模型组大鼠少,偶见血管生成。

图3 各组大鼠膝关节滑膜组织病理形态学结果(HE,×100)
2.4 各组大鼠滑膜组织中CD31 蛋白表达的比较
空白组大鼠滑膜组织见少量CD31 蛋白表达。与空白组相比,模型组CD31 表达明显增加(P<0.05),表明血管生成增加;与模型组相比,西药组和电针组CD31 表达有一定减少,但差异无统计学意义(P>0.05)。详见图4—5。
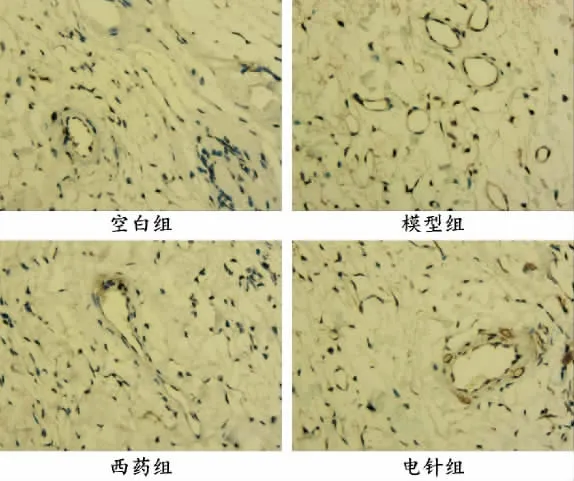
图4 各组大鼠滑膜组织CD31 表达水平(免疫组织化学,×400)
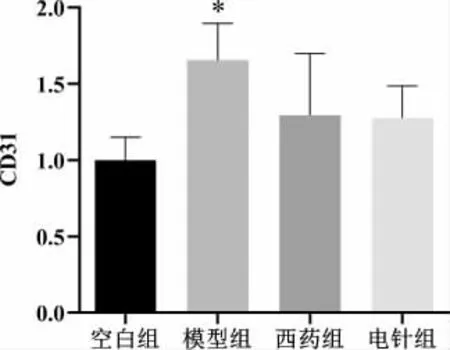
图5 各组大鼠滑膜组织CD31 表达水平比较(±s,n=5)
2.5 各组大鼠滑膜组织中VEGF、Rac1、Vav2 的蛋白表达比较
与空白组相比,模型组大鼠滑膜组织中VEGF、Rac1、Vav2 蛋白表达量显著升高(P<0.01);与模型组相比,西药组、电针组中VEGF、Vav2、Rac1 蛋白表达量下降(P<0.05,P<0.01)。 详见图6。
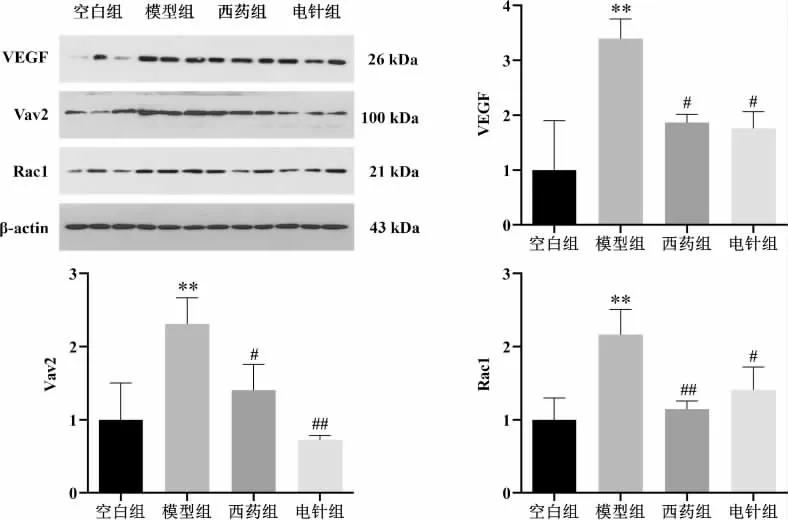
图6 各组大鼠滑膜组织VEGF、Vav2、Rac1 蛋白表达水平比较(±s,n=5)
3 讨论
RA 是最常见的自身免疫性关节炎症疾病,其临床最大危害在于关节软骨与骨的破坏,影响正常关节活动,导致活动受限。 RA 基本病理是关节内的滑膜炎症及血管翳形成[20-21]。 血管翳主要由滑膜炎症、滑膜增生以及血管新生等共同构成。 血管新生是RA 早期促进滑膜增生和炎症发展的核心病理特征,是RA 关节侵蚀破坏最主要的原因[1,22]。 因此,血管新生在RA 的发病机制中发挥了重要作用, 已成为当前RA 研究的热点和治疗靶点之一[3,23]。 RA 在中医学中属于“痹病”范畴。 《素问·痹论》曰“风寒湿三气杂至,合而为痹”,指出感受外邪是痹病发病的外因;《金匮要略·中风历节病脉证并治第五》曰“寸口脉沉弱……故曰历节”,指出正气虚弱是痹病发病的内因[24]。“正气不足,复感外邪”,内外相合发病,虚实夹杂、本虚标实为其病机特点[25-26]。 临床上,多遵循扶正祛邪、活血化瘀的治疗原则[27-28]。 针刺是治疗RA 常用的中医技法之一,有扶正祛邪、通脉止痛的作用[29]。 根据RA 的治疗原则,本实验选取足三里、关元和阿是穴,足三里为胃经之合穴,关元为先天之气海,两者均有补益气血、扶正培元的功效,阿是穴具有活血化瘀、通络止痛的功效。
与空白组比较,本实验AA 模型大鼠足跖关节肿胀明显,足跖容积明显增大(P<0.01),电针干预后足跖容积减少(P<0.01),与既往研究结果一致[7-8]。组织形态学显示,模型组大鼠滑膜组织结构排列异常,大量炎细胞浸润,血管生成增多,电针干预后滑膜组织结构较好,炎细胞浸润、血管生成明显减少。CD31是公认的血管特异性标志物[30],免疫组织化学结果显示,与空白组比较,模型组关节滑膜组织中CD31表达明显增加(P<0.05),电针干预后CD31 表达差异虽无统计学意义(P>0.05),但有明显下降趋势,提示电针干预后RA 滑膜血管数量减少。因此,初步证实电针治疗RA 可能与抑制滑膜血管新生有关。 另外,Western blot 结果显示,与空白组比较,模型组大鼠关节滑膜组织中VEGF、Vav2 和Rac1 表达均明显增多(P<0.01),电针干预后VEGF、Rac1、Vav2 蛋白表达量均下降(P<0.05,P<0.01),这提示VEGF/Vav2/Rac1 信号通路可能在这一过程中发挥了重要作用。
RA 血管新生是一项极为复杂的过程,内皮细胞迁移是其中的重要环节之一,而伪足生成在细胞迁移中占据了重要位置[31-32]。VEGF 及其信号通路参与血管新生全部过程,有着无可替代的作用[33]。研究表明,电针调节血管新生可能与调控VEGF表达有关[34-35]。 已有研究证实,VEGF 通过诱导其下游Vav2激活Rac1 引起内皮细胞迁移[6]。Rac1 作为小蛋白酶家族的一员,在细胞迁移过程中发挥了重要作用,参与细胞前端片状伪足的形成并向前伸出[36]。 Rac1 作为分子开关被Vav2 激活,从不活跃的GDP结合态循环到活跃的GTP 结合态,活性状态下的Rac1通过信号通路作用于肌动蛋白结合蛋白,使得肌动蛋白细胞骨架发生聚合的重构变化,最终使得细胞前端片状伪足生成,诱导内皮细胞发生迁移[37-40]。
本实验以VEGF 及其下游Vav2/Rac1 信号通路为切入点展开研究,结合组织形态学结果及血管内皮细胞标记物CD31 结果,模型组大鼠滑膜组织中CD31 较空白组表达升高(P<0.05),VEGF 含量明显升高(P<0.01),说明模型大鼠血管新生增多,且与VEGF 表达增多密切相关。 电针干预后CD31 表达差异虽无统计学意义(P>0.05),但有明显降低趋势,提示血管新生较少,同时VEGF 表达明显降低,这表明VEGF 可能是电针发挥抑制血管新生的关键信号途径。 同时,本研究结果显示,模型组大鼠滑膜组织中Vav2、Rac1 蛋白表达量较空白组大鼠均明显增多(P<0.01),电针干预后Vav2、Rac1 蛋白表达量明显下降(P<0.01,P<0.05),提示电针可能通过抑制VEGF的表达,从而抑制Vav2、Rac1 活性和血管新生,减少血管翳浸润,减轻关节肿胀。 因此,VEGF/Vav2/Rac1 信号通路可能介导了电针抑制AA 模型大鼠滑膜血管新生这一作用。
综上所述,电针治疗RA 的效应机制可能是通过抑制VEGF/Vav2/Rac1 信号通路,抑制内皮细胞伪足生成及其迁移,从而抑制RA 血管新生,改善关节症状,为电针抑制RA 血管新生提供了一定证据支持。为了进一步确定VEGF/Vav2/Rac1 信号通路在电针抑制RA 血管新生中的作用机制,后续将通过设置其信号通路关键蛋白的阻断剂或激动剂展开研究,同时补充内皮细胞伪足生成直接证据的检测。

