探究芩柏加减方通过NF-κB/TNF-α 信号通路对溃疡性结肠炎的保护机制
陆文洪,王真权,熊家青,刘丽芳*,李 逵*
1.湖南中医药大学第二附属医院,湖南 长沙 410005;2.湖南中医药大学第一附属医院,湖南 长沙 410021
溃疡性结肠炎(ulcerative colitis, UC)是一种慢性非特异性肠道炎症性疾病,以结肠黏膜连续性、弥漫性炎症改变为特点,病因未明,暂无法治愈[1]。 其临床表现为持续性、反复性的腹泻、腹痛,伴随黏液脓血便。目前,多认为UC 是一种由遗传背景与环境因素相互作用导致的慢性炎症性疾病[2],可能存在多基因、多环节的遗传背景,个体免疫因素也参与其中[3-5]。 近年来,我国UC 发生率有升高趋势[6-8],患病率约为11.6/100 万[9]。 目前,尚缺乏有效的治疗方式。 现有研究显示,UC 患者体内促炎因子呈高表达,尤其在活动期,多种炎症因子参与UC 的病理过程[10]。 研究发现,肿瘤坏死因子-α(tumor necrosis factor, TNF-α)/白细胞介素-10(interleukin-10, IL-10)信号通路在UC 发展中起关键作用[11-12]。
中医学虽无UC 病名,但根据其症状,可以归属于“肠澼”“滞下”“下利”“久痢”“休息痢”等范畴,中医学辨证论治在改善该病临床症状和预防复发等方面具有一定的优势[13-14]。 本课题组通过长期的临床观察和研究,认为UC 发病与“气虚”“湿滞”“血瘀”等病机有关,本病的显著特点是“虚中有实”“虚实夹杂”,并针对“久病多虚”“无湿不成泄”等病机特点,以“益气除湿祛瘀”立法,将湖南中医药大学第二附属医院自制方剂“复方芩柏颗粒剂”化裁成芩柏加减方,发现其能明显改善UC 患者的临床症状[15],但其具体机制尚不明确。 近年来,随着系统生物学及计算机学科的高速发展,网络药理学应运而生,其主要用于探究药物与疾病之间的相互作用关系,并建立“分子-靶点”的网络模式[16]。本文运用网络药理学方法,构建芩柏加减方成分-靶点网络,通过建立大鼠UC模型,旨在探讨芩柏加减方对UC 的作用机制,为中医药治疗UC 提供理论依据。
1 材料与方法
1.1 实验动物
60 只SPF 级SD 大鼠,体质量(220±10) g,雌雄各半,由辽宁长生生物技术股份有限公司提供,动物质量合格证编号:SCXK (辽)2020-0001。 于室温(22±1) ℃、相对湿度50%±5%环境下饲养。 实验通过湖南中医药大学第一附属医院实验动物委员会审查批准(编号:ZYFY20210528)。
1.2 主要药品及试剂
芩柏加减方是由湖南中医药大学第二附属医院自制方剂“复方芩柏颗粒剂”化裁而成,由13 味中药组成:党参20 g,炒白术20 g,生黄芪20 g,黄芩10 g,黄柏10 g,秦艽10 g,当归12 g,桃仁6 g,防风10 g,泽泻10 g,丹参12 g,制大黄10 g,延胡索10 g。生药均由医院中药房提供。
注射用异戊巴比妥钠(上海上药新亚药业,批号:H31021725);3-硝基苯磺酸水合物(上海阿拉丁生化科技股份有限公司,批号:2508-19-2);大鼠核因子κB 亚基p65 亲和肽(nuclear factor κB p65,NFκB p65)ELISA 试剂盒、大鼠TNF-α ELISA 试剂盒、大鼠IL-10 ELISA 试剂盒(武汉伊莱瑞特生物科技股份有限公司,批号:E-EL-R0674c、E-EL-R2856c、E-EL-R0016c);大鼠半胱氨酸蛋白酶-3(Caspase-3)ELISA 试剂盒(武汉云克隆生物科技股份有限公司,货号:SEA626Ra);Caspase-3 抗体(美国Cell Signaling Technology 公司,货号:9661S);NF-κB p65 抗体、TNF-α 抗体、IL-10 抗体(武汉三鹰生物技术有限公司, 货号:10745-1-AP、60291-1-Ig、60269-1-Ig);TUNEL 细胞凋亡检测试剂盒(FITC)[翌圣生物科技(上海)股份有限公司;货号:40306ES50];DAPI、抗荧光淬灭封片剂(上海碧云天生物技术有限公司,货号:C1002、0100-01)。
1.3 主要仪器
荧光正置显微镜、荧光倒置显微镜[奥林巴斯(中国)有限公司,型号:BX53、IX53];低速离心机、电热恒温培养箱(湖南湘仪实验室仪器开发有限公司,型号:H1650-W、ICV-450);Flex Station 3 多功能酶标仪(美国Molecular Devices 公司,型号:Flexstation3);脱水机、组织摊烤片机、抗原修复用电陶炉、包埋机(武汉俊杰电子有限公司,型号:JT-12J、JK-6、SK-109G、JB-P5);病理切片机(沈阳恒松科技有限公司,型号:RM2016);切片刀(日本羽毛Feathe公司,型号:R35);载玻片及盖玻片(江苏世泰实验器材有限公司,型号:188105W)。
1.4 药液制备
芩柏加减方溶液由湖南省中医院药剂科制备,其中13 味生药共160 g,加入12 倍蒸馏水浸泡30 min后武火煮沸,继续文火煎煮30 min,消毒纱布过滤药液后,加入10 倍蒸馏水煎煮30 min,合并2 次滤液。 根据“动物与人体的每千克体质量剂量折算系数表”计算大鼠灌肠的中药剂量。 临床上,芩柏加减方的服用剂量约为160 g/70 kg,按照大鼠与人的换算系数为6.25,则得出芩柏加减方换算出大鼠使用剂量为14.285 g/kg,按照一只大鼠体质量约0.2 kg核算,则灌胃高剂量为2.86 g/0.2 kg。
1.5 芩柏加减方治疗UC 的物质基础探索
通过中药系统药理学数据库和分析平台TCMSP 检索获取“党参”“白术”“黄芪”“黄芩”“黄柏”“延胡索”“当归”“桃仁”“丹参”“防风”“秦艽”“泽泻”“大黄”的有效化学成分的数据信息,借助毒药物动力学参数进行活性成分筛选,以平台推荐的设定条件“OB≥30%,DL≥0.18”为筛选条件,并利用TCMSP靶点预测模型预测所获得的活性成分的可能作用靶点。在PubChem 数据库(https://pubchem.ncbi.nlm.nih.gov/)获得筛选后成分的“Canonical SMILES”,导入Swisstarget Prediction 数据库(http://swisstargetprediction.ch/)进行成分的靶点预测分析,汇总“Probabili ty≥0”的靶点预测结果并剔除重复数据。 借助UniProt数据库(https://www.uniprot.org)中UniProKBt 检索功能,以“Homo sapiens”为物种条件,将剔除重复后靶点名称校正为“Official Gene Symbol”。 借助基因表达综合(gene expression omnibus, GEO)数据库的GEO2R分析GSE75214 数据集。 该芯片数据的原始文件包含了97 例UC 患者与11 例健康人结肠样本组织。利用生物信息学之Robust 阵列平均值算法(Robust multiarray average,RMA)背景矫正和矩阵数据归一化处理其原始文件,利用limma 二次分析芯片数据结合P 值和差异倍数(fold change, FC)进行相关数值的筛选,其中显著差异基因的筛选条件为P<0.05,FC>2。 获得与“芩柏加减方”相关靶点结合获得“芩柏加减方”治疗UC 的靶点,将其定义为共同靶点。借助集成生物信息学工具分析平台(https://david.ncifcrf.gov/)对共同靶点进行基因本体论(gene ontology,GO)功能和京都基因和基因组数据库(Kyoto encyclopedia of genes and genomes, KEGG)信号通路富集分析,整理相关数据借助Cytoscape 软件构建调控网络进行可视化展示。
1.6 造模方法
采用2,4,6-三硝基苯磺酸(ethanol-trinitrobenzene sulfonic acid, TNBS)构建UC 大鼠模型[17]。 大鼠适应性饲养1 周后,禁食不禁水24 h,实验时用2%的异戊巴比妥钠按2.3 mg/kg 剂量进行腹腔注射麻醉大鼠。用300 mL 乙醇液将TNBS配制成50 g/L 溶液,而后将直径约2.0 mm、长约12 cm 的硅胶管经液状石蜡润滑后由肛门轻缓插入大鼠体内深约8 cm 达结肠部位,按100 mg/kg 剂量缓慢注入TNBS/乙醇混合液,再注入约0.4 mL 的空气,以使硅胶管中的药液全部注入肠腔,捏紧肛门,提起大鼠尾部保持倒立,持续约10 min,使造模剂充分渗入大鼠肠腔内。造模完成后,仰卧归笼,保温灯照射至大鼠自然苏醒,正常自由饮食。 以大便带血(或隐血阳性)、稀便或体质量减轻作为造模成功的标志[17]。
1.7 分组和干预方法
TNBS 法造模24 h 后开始药物干预。实验分为正常对照组(n=12)和造模组(n=48),造模组再随机分为4 组:给予等剂量生理盐水的模型组、给予200 mg/kg奥沙拉嗪组、给予2.86 g/0.2 kg 芩柏加减方高剂量组、给予1.43 g/0.2 kg 芩柏加减方低剂量组,每组12 只,每天2 次灌肠给药,连续干预14 d。
1.8 动物取材
给药后分别于第1、7、14 天,每组随机取4 只大鼠按2.3 mg/kg 剂量腹腔注射2%异戊巴比妥钠麻醉大鼠,剖腹暴露腹主动脉,负压管采血,2 000 r/min 离心5 min 后,取上层血清,置于-80 ℃保存备用。 沿肠系膜纵轴剖开,游离的结肠组织冰生理盐水清洗,取距肛门8 cm 处组织一分为二。 一部分用4%多聚甲醛固定,用于常规石蜡包埋、切片,用于观察结肠组织病理学变化;另一部分迅速投入液氮中,后转入-80 ℃冰箱保存。
1.9 结肠组织病理学评分标准
取全段结肠剪开,生理盐水洗净,平铺于白板上置于放大镜下,肉眼观察结肠组织形态变化情况、结肠黏膜损伤情况等。 参照IBA 等[18]的标准进行结肠组织学病理评分,具体见表1。
1.10 HE 染色观察结肠组织
将取出的新鲜结肠组织置于4%多聚甲醛中固定、石蜡包埋、HE 染色,在显微镜下观察结肠组织的结构变化、炎症情况。
1.11 TUNEL 荧光法检测大鼠结肠组织细胞凋亡情况
对结肠组织切片先增加细胞膜通透性,然后让rTDT 和生物标记的dTUTP 进入细胞内,在rTDT 的辅助下dTUTP 与核断裂的DNA 3-OH 结合,再用HRP 标记的链霉亲和素与dTUTP 上的biotin 结合(每个链霉亲和素至少可以再结合3 个Biotin 分子),最后用DAB、过氧化氢与SP 上的辣根过氧化物酶(horseradish peroxidase, HRP)发生氧化、环化反应,形成苯乙肼聚合物而呈现棕褐色,最终通过计数每张切片上阳性细胞的比例来判断细胞凋亡发生情况。
1.12 ELISA 检测NF-κB/TNF-α 信号通路相关因子的表达
实验开始前,收集的血清样本及各试剂均置于室温平衡;试剂或样品配制时,均需充分混匀,并尽量避免起泡。 分别设空白孔、标准孔、待测样品孔,空白孔加样品稀释液100 μL,余孔分别加标准品或待测样品100 μL。 给酶标板覆膜,37 ℃孵育90 min。弃去液体,每孔加生物素化抗体工作液100 μL(临用前20 min 内配制,避光放置),加上覆膜,37 ℃温育60 min。弃去液体,洗板3 次,每次浸泡30 s,大约350 μL/孔,甩干并在吸水纸上轻拍,将孔内液体拍干。每孔加酶结合物工作液100 μL(临用前20 min 内配制,避光放置),加上覆膜,37 ℃温育30 min。 弃去孔内液体,甩干,洗板5 次。每孔加TMB 90 μL,酶标板加上覆膜37 ℃避光孵育15 min。每孔加终止液50 μL 终止反应,此时蓝色立转黄色。立即用酶标仪在450 nm 波长处测量各孔的光密度(optical density, OD)值。
1.13 免疫组织化学检测NF-κB/TNF-α 信号通路相关因子的表达
组织经75%、80%、90%、95%、100%的梯度乙醇进行脱水处理至完全透明,透明后的组织块依次经低熔点100%石蜡(40 ℃)一遍、高熔点100%石蜡(60 ℃)两遍浸蜡,100%石蜡纸盒内凝固完成包埋。包埋好的蜡块使用病理切片机进行切片,切好的组织片放入40 ℃的水浴锅中进行展片,防脱玻片倾斜插入水面,使组织贴附在载玻片的合适位置,于60 ℃烤箱烤片3 h。 然后切片脱蜡和抗原修复,采用电陶炉进行抗原修复。 将配制好的3%过氧化氢溶液滴加于切片组织上以阻断内源性过氧化物酶,室温孵育15 min,PBS 冲洗3 次,每次3 min。 滴加稀释好的正常山羊血清,室温封闭30 min,以减少非特异性染色,滴加稀释好的一抗p65(1∶100)和Caspase-3(1∶100),加完一抗后于4 ℃湿盒中孵育过夜(15 h)。加HRP 标记的山羊抗兔/小鼠二抗,37 ℃孵育30 min。每张切片滴加新鲜配制的DAB 显色液,染色3~10 min。终止染色后,苏木素复染1~2 min,氨水返蓝。 梯度乙醇脱水处理后中性树胶封片,完成免疫组织化学染色。 显微镜下观察和采集图像。
1.14 统计学分析
2 结果
2.1 芩柏加减方治疗UC 的物质基础探索
从TCMSP 数据库检索获得芩柏加减方成分1 156个,其中党参134 个、白术5 个、黄芪87 个、黄芩143 个、黄柏140 个、秦艽27 个、当归125 个、桃仁66个、防风173 个、泽泻46 个、丹参202 个、大黄92 个、延胡索77 个,根据筛选条件过滤后获得272 个相关有效成分。通过Swisstarget Prediction 预测并经UniProt校对名称后,获得相关靶点1 031 个。 GSE75214 芯片分析结果以“P<0.05,|logFC|>1”筛选,获得对UC 差异基因848 个。 将筛选后成分预测的靶点与GSE75214芯片差异基因统计,获得共同靶点103个。 根据调控网络分析得知,与共同靶点相关的成分有167 个,其中党参13 个、白术1 个、黄芪13 个、黄芩26 个、黄柏29 个、秦艽1 个、当归2 个、桃仁13 个、防风13个、泽泻8 个、丹参34 个、大黄6 个、延胡索37 个。对调控网络进行度值分析,芩柏加减方治疗UC 的主要活性成分是紫花前胡素、5,7,2',6'-四羟基黄酮、黄芩苷、芹菜黄酮、去甲芎烯等,共同靶点以前列腺素内过氧化物合酶2、激酶插入区受体、多药耐药性蛋白、单胺氧化酶A、基质金属蛋白酶9 相关性较强。 KEGG 富集分析显示,芩柏加减方治疗UC 主要涉及46 条相关通路,主要与TNF 信号通路、NFκB 信号通路、HIF-1 信号通路等联系密切。
借助DAVID 平台对芩柏加减方治疗UC 的靶点进行GO 与KEGG 通路富集分析。 GO 富集分析显示,主要与炎症反应、对脂多糖反应、正调控胞质钙离子浓度等相关;细胞组成涉及42 条,主要富集在细胞表面、质膜、分泌颗粒膜等;分子功能涉及67条,主要富集条目为跨膜受体肽链内切酶活性、跨膜受体蛋白酪氨酸激酶活性、蛋白酪氨酸激酶活性等。KEGG 富集分析显示,主要涉及46 条相关通路,主要与TNF 信号通路、NF-κB 信号通路、HIF-1 信号通路等联系密切。通过Reactome 数据库分析发现芩柏加减方治疗UC 主要与免疫系统、信号转导及疾病等机制相关。 详见图1—2。

图2 芩柏加减方-中药-成分-靶点调控网络图
2.2 芩柏加减方对UC 大鼠疾病活跃指数(disease activity index, DAI)评分的影响
与正常对照组比较,经TNBS 灌肠处理的各组大鼠DAI 评分均升高(P<0.05),提示造模成功。 给药1 d,与模型组相比,奥沙拉嗪组和芩柏加减方高、低剂量组DAI 评分均无明显变化,差异无统计学意义(P>0.05);给药7 d,与模型组相比,奥沙拉嗪组DAI评分降低(P<0.05),而芩柏加减方高、低剂量组差异无统计学意义(P>0.05);给药14 d,与模型组比较,奥沙拉嗪组和芩柏加减方高、低剂量组大鼠DAI 评分均明显降低(P<0.05)。另外,芩柏加减方高剂量时间点组内对比发现,与1 d 相比,7 d 的DAI 评分差异无统计学意义(P>0.05),14 d 的DAI 评分明显下降(P<0.05)。 详见表2。 结合结肠组织HE 染色结果显示,模型组的结肠腺体排列紊乱,肌底膜断裂或消失,并伴有炎症性细胞浸润,隐窝脓肿形成(圆圈所示);芩柏加减方高剂量组给药14 d,其结肠损伤病理明显减少,结肠腺体呈现纤维化再生和修复,炎症细胞浸润减少(箭头所示),与其DAI 评分表现一致。 详见图3。

图3 大鼠结肠组织HE 染色结果(×400)
表2 各组大鼠DAI 评分比较(±s,n=12)
注:与正常对照组比较,*P<0.05;与模型组比较,△P<0.05;与芩柏加减方高剂量组1 d 比较,#P<0.05。
组别DAI 评分/分1 d7 d14 d正常对照组模型组奥沙拉嗪组芩柏加减方高剂量组芩柏加减方低剂量组1.33±0.89 9.83±1.12*9.67±1.44*9.75±0.97*9.50±1.09*1.17±0.94 8.92±0.90*6.92±1.17*△8.25±0.97*9.00±0.85*1.08±0.52 7.42±0.90*5.00±0.74*△4.58±1.51*△#5.50±1.38*△
2.3 芩柏加减方对细胞凋亡的影响
给药1 d 和给药7 d,模型组的结肠腺体均排列紊乱,基底膜断裂或消失;给药14 d,奥沙拉嗪组及芩柏加减方高、低剂量组的结肠腺体呈现不同程度的纤维化再生(图4)。 给药1 d,与正常对照组比较,经TNBS 灌肠处理的各组大鼠调亡指数评分均升高(P<0.05);给药7 d,与模型组相比,奥沙拉嗪组调亡指数明显降低(P<0.05),而芩柏加减方高、低剂量组凋亡指数差异无统计学意义(P>0.05);给药14 d,与模型组比较,奥沙拉嗪组及芩柏加减方高、 低剂量组大鼠细胞调亡指数均明显降低(P<0.05)。 另外,芩柏加减方高剂量各时间点组内对比发现,与1 d 相比,7 d 的细胞调亡指数差异无统计学意义(P>0.05),14 d 的细胞调亡指数明显下降(P<0.05)。详见表3。 因此,后续选用给药14 d 作为研究点进行进一步探究。
表3 各组大鼠结肠组织细胞凋亡指数比较(±s,n=12)
注:与正常对照组比较,*P<0.05;与模型组比较,△P<0.05;与芩柏加减方高剂量组1 d 比较,#P<0.05。
组别调亡指数/%1 d7 d14 d正常对照组模型组奥沙拉嗪组芩柏加减方高剂量组芩柏加减方低剂量组2.88±1.11 21.15±3.61*19.98±2.13*20.67±2.81*19.50±3.04*3.41±0.98 19.40±1.32*15.02±2.82*△19.84±3.35*19.50±3.03*3.08±0.95 15.13±2.00*6.68±1.34*△7.92±1.06*△#9.28±1.31*△
2.4 病理检测芩柏加减方对TNF-α、IL-10、NF-κB p65 和Caspase-3 的影响
与正常对照组相比,模型组大鼠结肠组织中TNF-α、NF-κB p65 和Caspase-3 含量水平均升高,而IL-10 含量明显降低(P<0.05);与模型组相比,奥沙拉嗪组及芩柏加减方高、低剂量组的TNF-α、NFκB p65 和Caspase-3 含量明显降低,而IL-10 含量明显升高(P<0.05);与奥沙拉嗪组比较,芩柏加减方低剂量组的IL-10 含量降低,Caspase-3 含量升高(P<0.05);与芩柏加减方高剂量组比较,芩柏加减方低剂量组的TNF-α、NF-κB p65 和Caspase-3 含量升高,IL-10 含量降低(P<0.05)。 说明合适浓度的药物处理后具有一定的治疗缓解作用,随后在血清水平进一步检测其通路相关炎症因子的变化差异。 详见图5、表4。

图5 各组大鼠TNF-α、IL-10、NF-κB p65、Caspase-3 免疫组织化学染色结果(×400)
表4 各组大鼠结肠组织TNF-α、IL-10、Caspase-3 和NF-κB p65 的OD 值比较(±s,n=12,×10-3)

表4 各组大鼠结肠组织TNF-α、IL-10、Caspase-3 和NF-κB p65 的OD 值比较(±s,n=12,×10-3)
注:与正常对照组比较,*P<0.05;与模型组比较,△P<0.05;与奥沙拉嗪组比较,#P<0.05;与芩柏加减方高剂量组比较,※P<0.05。
组别正常对照组模型组奥沙拉嗪组芩柏加减方高剂量组芩柏加减方低剂量组TNF-α 6.42±1.82 44.76±5.29*11.90±3.16*△13.16±1.22*△16.82±1.37*△※IL-10 63.82±8.14 6.32±0.97*47.23±4.33*△37.12±4.24*△22.67±2.88*△#※NF-κB p65 4.88±3.86 51.32±7.34*23.87±2.35*△22.53±1.06*△24.97±3.46*△※Caspase-3 0.60±0.33 6.51±1.44*1.93±0.75*△2.71±0.46*△4.67±1.03*△#※
2.5 血清检测芩柏加减方对TNF-α、IL-10、NF-κB p65、Caspase-3 的影响
与正常对照组相比,模型组大鼠血清中TNF-α、Caspase-3 和NF-κB p65 含量均升高,IL-10 水平明显降低(P<0.05)。与模型组比较,芩柏加减方低剂量组血清中TNF-α、Caspase-3 含量均降低(P<0.05),IL-10、NF-κB p65 变化不明显,差异无统计学意义(P>0.05);奥沙拉嗪组、芩柏加减方高剂量组的TNF-α、Caspase-3 和NF-κB p65 水平相对于模型组均降低,IL-10 含量升高(P<0.05)。 与奥沙拉嗪组比较,芩柏加减方低剂量组的IL-10 含量降低,NF-κB p65含量升高(P<0.05);与芩柏加减方高剂量组比较,芩柏加减方低剂量组的TNF-α、NF-κB p65 和Caspase-3 含量升高,IL-10 含量降低(P<0.05)。详见表5。各细胞因子的含量水平在芩柏加减方低、高剂量之间存在一定的浓度相关性,可知大鼠血清中TNF-α、Caspase3 和NF-κB p65 的含量水平与溃疡性炎症的发生发展呈正相关性,IL-10 作为抗炎因子则表现为负相关性,说明高剂量的芩柏加减方在治疗缓解溃疡性结肠炎上与奥沙拉嗪具有相似的疗效,可能是通过干预NF-κB p65/TNF-α 信号通路,影响相关细胞因子TNF-α、IL-10、Caspase-3、NF-κB p65 的表达发挥治疗与缓解溃疡性炎症的作用。
表5 大鼠血清TNF-α、IL-10、Caspase-3 和NF-κB p65 表达水平比较(±s,n=12)
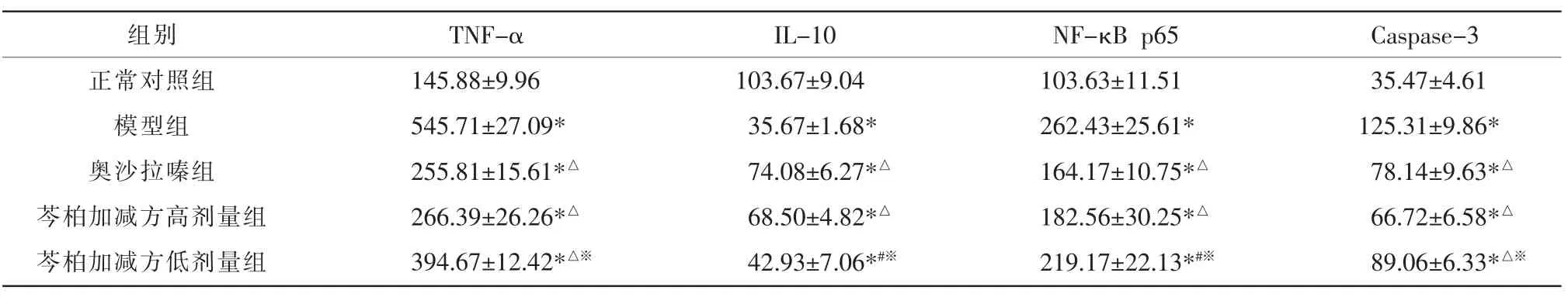
表5 大鼠血清TNF-α、IL-10、Caspase-3 和NF-κB p65 表达水平比较(±s,n=12)
注:与正常对照组比较,*P<0.05;与模型组比较,△P<0.05;与奥沙拉嗪组比较,#P<0.05,与芩柏加减方高剂量组比较,※P<0.05。
组别正常对照组模型组奥沙拉嗪组芩柏加减方高剂量组芩柏加减方低剂量组TNF-α 145.88±9.96 545.71±27.09*255.81±15.61*△266.39±26.26*△394.67±12.42*△※IL-10 103.67±9.04 35.67±1.68*74.08±6.27*△68.50±4.82*△42.93±7.06*#※NF-κB p65 103.63±11.51 262.43±25.61*164.17±10.75*△182.56±30.25*△219.17±22.13*#※Caspase-3 35.47±4.61 125.31±9.86*78.14±9.63*△66.72±6.58*△89.06±6.33*△※
3 讨论
UC 属于中医学“痢疾”“便血”“肠澼”“泄泻”等范畴,为本虚标实之证,气血亏虚、脉络失养为其本,痰浊瘀胶结留滞、痹阻肠络为其标,基本病理因素为血瘀、食积、痰浊、湿热、气滞等[19-20]。 现代中医医家的临证经验及本课题组多年的临床实践均发现,UC病机以“脾虚”为本,“湿热瘀毒”为标,治疗中遵循发时治标、平时治本的原则,着重强调“健脾益气,和中补虚”的重要性,尤其是对于UC 慢性持续性发作患者,不应只强调清热解毒,而应注重补虚健脾[21-22]。因此,本课题组紧扣UC 的本质,以“益气除湿祛瘀”立法,将湖南中医药大学第二附属医院自制方剂“复方芩柏颗粒剂”化裁成芩柏加减方。临床和动物实验都已证实,芩柏加减方对UC 的疗效佳[23-24]。
芩柏加减方由党参、炒白术、生黄芪、黄芩、黄柏、延胡索、当归尾、桃仁、丹参、防风、秦艽、泽泻、大黄13 味中药组成,诸药共行健脾益气、燥湿化瘀之效。现代研究认为黄芩具抗炎、抗菌、抗病毒,可抑制细菌对肠上皮细胞的侵袭,下调UC 模型大鼠NF-κB的表达。 另有研究表明,黄芩苷[25-26]可对小鼠淋巴细胞中T 淋巴细胞产生较强的抑制增生及活化作用[27]。黄连提取物可抑制LPS 诱导毒血症模型大鼠的NFκB 表达[28]。 研究亦发现,黄芪多糖和黄芪甲苷均能减少结肠组织炎症因子释放,修复黏膜屏障,从而对UC 大鼠具有治疗作用[29-30]。 SHEN 等[31]研究发现,黄芪可以显著降低Caspase-3 蛋白的表达。 网络药理学中筛选出芩柏加减方中的有效成分β-谷甾醇和豆甾醇,能有效改善DSS 引起的小鼠结肠炎[32]。汉黄芩苷可能通过下调促炎、氧化因子水平,上调抑炎、抗氧化因子水平以缓解UC 大鼠炎症、氧化损伤,促进黏膜修复[33]。 其具体机制可能与芩柏加减方调控TNF 信号通路和NF-κB 信号通路有关。
NF-κB p65/TNF-α 信号通路活化是导致UC发生炎症反应的关键因素[34-35]。NF-κB p65 作为UC中的主要亚基形式,其过度表达能够使腺体细胞的线粒体受到损害,破坏黏膜的生理屏障,从而加重病情[36]。NF-κB p65 表达的增加促进了TNF-α 的表达。TNF-α 是一种由单核细胞产生的多功能细胞因子,在炎症反应中起促进作用,TNF-α 激活丝裂原活化蛋白激酶和NF-κB 通路,促进细胞分化、细胞增殖和促炎细胞因子的上调[37]。 研究发现,UC 患者血清中TNF-α 较正常患者升高[38]。 IL-10 由B 细胞、T细胞和单核细胞分泌,通过减少单核细胞的抗原呈递能力来抑制TNF-α 的产生,在黏膜免疫系统中起保护作用[39]。 TNF-α 与Caspase 蛋白结合形成复合物,复合物聚集后迅速活化并触动下游信号通路,从而诱导肠上皮细胞凋亡、促进UC 的发生发展[40]。 而Caspase-3 的表达也会促使炎症因子的表达,促进细胞凋亡,导致UC 的发生[41]。
本研究发现,网络药理学分析显示芩柏加减方主要通过NF-κB p65/TNF-α 信号通路发挥治疗UC 的作用。 在UC 动物造模实验中发现,在造模后21 d(给药14 d)芩柏加减方组的DAI 评分明显降低(P<0.05),上皮细胞损伤减少,黏膜损伤减少,炎细胞浸润明显减少,说明芩柏加减方对TNBS 诱导的UC 大鼠有保护作用,能显著降低细胞凋亡指数。同时通过检测血清中炎症相关因子也发现:UC模型组TNF-α 和IL-1β 含量相比正常对照组显著升高,IL-10 明显降低,经TNBS 灌肠治疗后大鼠血清中TNF-α 和IL-1β 含量降低,IL-10 水平升高,从而发挥调节UC 大鼠炎性细胞因子的分泌,减轻机体炎症反应,最终达到缓解UC 的目的,其具体机制可能是通过调节NF-κB/TNF-α 信号通路来降低炎症因子的分泌,减轻机体炎症反应,提高抗炎因子IL-10 的表达,促进黏膜愈合而达到治疗效果。
综上可知,芩柏加减方对于TNBS 诱导的实验性UC 大鼠具有治疗作用,以高剂量效果最佳,其具体机制可能与降低TNF-α、Caspase-3、NF-κB p65 的表达,防止黏膜损伤,增加IL-10 的表达促进黏膜修复有关。

