羊踯躅含药血清对TNF-α 诱导的类风湿关节炎成纤维样滑膜细胞增殖及炎症因子分泌的影响
刘笑蓉,李硕夫,梅文亚,湛 欢,刘平安,周日宝
1.湖南中医药大学,湖南 长沙 410208;2.湖南中医药大学第一附属医院,湖南 长沙 410007;3.湖南省中医药研究院,湖南 长沙 410006
类风湿关节炎(rheumatoid arthritis, RA)是一种以多关节滑膜炎症增生、骨及软骨破坏为主要特征的一类慢性自身免疫性疾病[1-2]。 该病久治不愈,致残率极高,严重影响患者的生活质量[3-4]。 虽然多种抗风湿药,如细胞因子拮抗剂、B 细胞耗竭药和T细胞共刺激阻滞剂对治疗RA 有一定临床疗效,但RA 患者的死亡率仍然高于普通人群[5]。 因此,探索新的有效和安全的治疗RA 的方法非常重要。
羊踯躅(Rhododendron Molle G.Don)属杜鹃花科杜鹃花属药用植物,在《滇药录》《畲医药》《瑶药》等书中均有记载。 羊踯躅根提取物炮制后可去除毒性,广泛应用于RA 的临床防治,有较好的治疗效果[6],同时还能消肿、祛风、止痛及治疗风寒和湿气[7]。目前,对羊踯躅及其有效活性成分抗RA 的药理研究较多,主要集中在药效学研究[8-10]等方面。 然而,羊踯躅治疗RA 的具体作用机制尚未完全阐明。
本研究通过肿瘤坏死因子-α(tumor necrosis factor-α, TNF-α)诱导RA 细胞模型,探究羊踯躅含药血清对TNF-α 处理的RA 成纤维样滑膜细胞(rheumatoid arthritis fibroblast-like synovial, RAFLS)增殖和炎症因子分泌的影响和机制,为羊踯躅的临床应用提供科学依据。
1 方法
1.1 动物及细胞
健康SPF 级SD 雄性大鼠30 只,4 周龄,体质量(200±20) g,由湖南斯莱克景达实验动物有限公司提供。 RA-FLS(批号:BS-C1162506)购自上海宾穗生物科技有限公司。
1.2 主要仪器
低速离心机(型号:SL02,上海知信实验仪器技术有限公司);Bio-Tek 酶标仪(型号:MB-530,深圳市汇松科技发展有限公司);超净工作台(型号:YTCJ-2NB,北京亚泰科隆仪器技术有限公司);化学发光成像系统(型号:ChemiScope6100,上海勤翔科学仪器有限公司)。倒置生物显微镜(型号:DSZ2000X,北京中显恒业仪器仪表有限公司);培养箱(型号:DH-160I,上海三腾仪器有限公司)。
1.3 主要试剂
TNF-α(货号:P5318,上海碧云天生物技术有限公司);雷公藤多苷(纯度98%,货号:JKBw1779,上海经科化学科技有限公司);CCK-8(货号:NU679,日本同仁化学研究所);DMEM 培养基(货号:D5796-500ML,美国Sigma 公司);胎牛血清(货号:10099141,美国Gibco 公司);RIPA 裂解液(货号:AWB0136,长沙艾碧维生物科技有限公司);青霉素-链霉素溶液(货号:SV30010,上海碧云天生物技术有限公司);γ 干扰素(interferon-γ, IFN-γ)(货号:RIF00)、白细胞介素-1β (interleukin-1β, IL-1β)(货号:RLB00)、白细胞介素-6(interleukin-6, IL-6)(货号:R6000B)、白细胞介素-17A(interleukin-17A, IL-17A)(货号:DY8410-05)(美国R&D Systems 公司);白细胞介素-2(interleukin-2, IL-2)(货号:BMS634,美国赛默飞世尔科技公司);p-c-JUN(货号:ab32385)、p-p65(货号:ab76302)、IL-6(货号:ab259341)、c-JUN(货号:ab40766)、表皮生长因子受体(epidermal growth factor receptor, EGFR, 货号:ab52894) 均购自英国Abcam 公司;p-AKT1(28731-1-AP)、AKT1(货号:10176-2-AP)、p65(货号:10745-1-AP)、β-actin(货号:66009-1-Ig)(美国Proteintech 公司);羊抗鼠IgG-HRP(货号:SA00001-1)和羊抗兔IgG-HRP(货号:SA00001-2)均购于美国Proteintech 公司。
1.4 羊踯躅提取物及含药血清的制备
将羊踯躅根粉碎,与10 倍量的纯水混合,将混合物回流提取2 h,重复3 次,合并提取液。 羊踯躅提取物经洗脱、减压浓缩后制得[8,11]。 羊踯躅水提取液大鼠用药剂量为42.84 mg/kg,空白组给予等体积的生理盐水,雷公藤多苷组给药剂量为9.45 mg/kg。各组均采用灌胃给药,每日1 次,连续给药1 周。 末次给药90 min 后腹主动脉采血,3 000 r/min 离心10 min 收集血清。所得血清于56 ℃下灭活30 min,过滤后于-20 ℃保存备用。
1.5 细胞培养及分组处理
RA-FLS 在含有胎牛血清(10%)与青霉素-链霉素溶液(1%)的DMEM 中培养,培养箱条件为5%CO2、37 ℃。 细胞贴壁后吸出培养液,分别加入5%、10%、20%、30%不同浓度的羊踯躅含药血清进行干预,并用CCK-8 测定在48 h 时细胞的增殖活性。将细胞随机分为7 组,即空白组(细胞正常培养)、模型组(细胞用10 ng/mL TNF-α 处理24 h[12-15])、雷公藤多苷组(细胞用10 ng/mL TNF-α 和10%雷公藤多苷血清培养基处理24 h)、5%空白血清组(细胞用10 ng/mL TNF-α 和5%空白血清培养基处理24 h)、5%含药血清组(细胞用10 ng/mL TNF-α 和5%羊踯躅含药血清培养基处理24 h)、10%空白血清组(细胞用10 ng/mL TNF-α 和10%空白血清培养基处理24 h)、10%含药血清组(细胞用10 ng/mL TNF-α 和10%羊踯躅含药血清培养基处理24 h)。
1.6 CCK-8 法测定细胞增殖能力
将细胞接种于96 孔板内,每孔1×104个细胞(100 μL),设3 个复孔。 用不同剂量的羊踯躅提取物干预细胞,处理48 h 后,加入CCK-8 溶液(10 μL/孔)。 采用Bio-Tek 酶标仪测定450 nm 处的光密度(optical density, OD)值,即吸光度值。
1.7 ELISA 测定细胞上清液中炎症因子的含量
使用相应试剂盒检测细胞上清液中炎症因子(IL-1β、IL-17A、IL-6、IL-2 和INF-γ)的含量。 板上固定相应的一抗,将未结合的抗体洗去,然后将标准品、对照品或样品加入每个孔中,混匀并密封,在室温下孵育2 h。随后,吸去每个孔的液体并用洗涤缓冲液清洗,向每个孔中加入120 μL 特异性二抗。 将未结合的二抗洗去后,向每个孔中加入100 μL辣根过氧化物酶底物溶液。 孔板在室温下避光孵育30 min,之后加入终止液终止反应。 然后使用Bio-Tek 酶标仪在30 min 内测定各组样品在450 nm 处的光密度值,并通过标准曲线计算样品中目标蛋白的浓度。
1.8 Western blot 测定细胞中蛋白的相对表达水平
用RIPA 裂解液(含蛋白酶和磷酸酶抑制剂)对RA-FLS 进行裂解。收集蛋白质,100 ℃沸水变性,通过10% SDS-PAGE 分离并转移到NC 膜上,用PBST配制5%脱脂奶粉封闭NC 膜,1 h 后, 分别加入AKT1(1∶1 000)、p-AKT1(1∶3 000)、c-JUN(1∶3 000)、p-c-JUN(1∶5 000)、p65(1∶1 000)、p-p65(1∶1 000)、EGFR(1∶5 000)和β-actin(1∶5 000)一抗,4 ℃下孵育过夜。用PBST 洗涤3 次后,按上述一抗的种属特异性加入二抗∶羊抗兔 IgG-HRP(1∶6 000)或羊抗鼠IgGHRP(1∶5 000),常温下孵育1 h,PBST 冲洗3 次。随后使用ECL 化学发光系统和放射自显影,扫描和分析蛋白质。 最后用Quantity one 专业灰度分析软件分析曝光后条带的灰度值。
1.9 统计学分析
2 结果
2.1 羊踯躅含药血清对RA-FLS 增殖的影响
与未添加羊踯躅含药血清的RA-FLS 相比,添加了5%和10%羊踯躅含药血清的细胞增殖活性在48 h 内无明显变化(P>0.05)。 然而当羊踯躅含药血清浓度上升至20%和30%时,RA-FLS 增殖活性受到明显抑制(P<0.05)。 故本研究选择5%和10%含药血清进行后续实验。 详见图1。
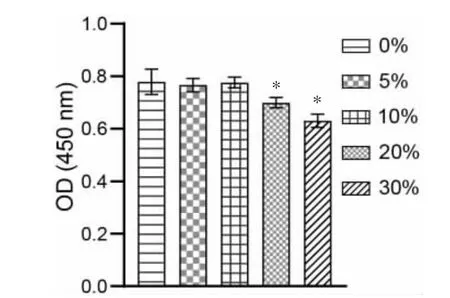
图1 羊踯躅含药血清对RA-FLS 增殖的影响
2.2 羊踯躅含药血清抑制TNF-α 诱导的RA-FLS增殖
CCK-8 结果显示,与空白组比较,模型组的细胞增殖活性显著升高(P<0.05)。与模型组相比,雷公藤多苷组的细胞增殖活性明显降低(P<0.05),而5%和10%空白血清组无明显变化(P>0.05)。 与5%和10%空白血清组相比,5%和10%羊踯躅含药血清组的细胞增殖活性显著降低(P<0.05)。另外,与雷公藤多苷组相比,10%羊踯躅含药血清组的细胞增殖活性显著降低(P<0.05)。 详见图2。

图2 羊踯躅含药血清抑制TNF-α 诱导的RA-FLS增殖
2.3 羊踯躅含药血清抑制TNF-α 诱导的RA-FLS中促炎因子的分泌
与空白组比较,模型组的IL-1β、IL-17A、IL-6、IL-2 和IFN-γ 水平均明显升高(P<0.05)。 与模型组相比,雷公藤多苷组的IL-1β、IL-17A、IL-6、IL-2 和IFN-γ 水平显著下降(P<0.05),而5%和10%空白血清组无明显变化(P>0.05)。 与5%和10%空白血清组相比,5%和10%羊踯躅含药血清组的IL-1β、IL-17A、IL-6、IL-2 和IFN-γ 水平显著降低(P<0.05)。与雷公藤多苷组相比,10%羊踯躅含药血清组的IL-1β、IL-17A、IL-6、IL-2 和IFN-γ 水平显著降低(P<0.05)。详见图3。
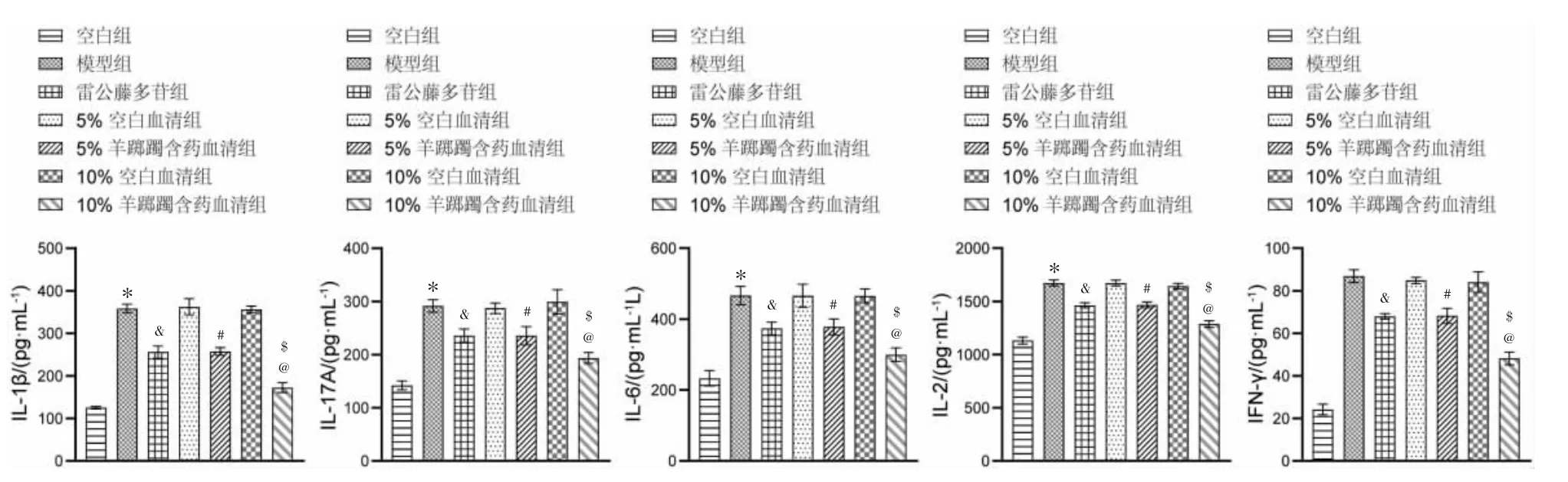
图3 羊踯躅含药血清抑制抑制TNF-α 诱导的RA-FLS 中促炎因子的分泌
2.4 羊踯躅含药血清抑制TNF-α 诱导的RA-FLS中增殖和炎症相关蛋白的表达
与空白组比较,模型组的EGFR 的表达及AKT1、c-JUN 和p65 的磷酸化水平均明显增加(P<0.05)。与模型组相比,雷公藤多苷组的EGFR 的表达及AKT1、c-JUN 和p65 的磷酸化水平均明显下降(P<0.05),而5%和10%空白血清组无明显变化(P>0.05)。 与5%和10%空白血清组相比,5%和10%羊踯躅含药血清组的EGFR 的表达及AKT1、c-JUN 和p65 的磷酸化水平均显著降低(P<0.05)。 与雷公藤多苷组相比,10%羊踯躅含药血清组的EGFR 的表达及AKT1、c-JUN 和p65 的磷酸化水平均明显降低(P<0.05)。详见图4。
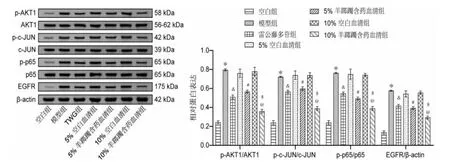
图4 踯躅含药血清抑制TNF-α 诱导的RA-FLS 中增殖和炎症相关蛋白的表达
3 讨论
RA 是一种常见的全身性免疫介导的炎症性疾病,其特征是关节疼痛、肿胀,并严重损害身体功能和生活质量[1-2]。 活化的RA-FLS 表现出与肿瘤细胞相似的侵袭性特征,这是异常增生和关节破坏的主要触发因素[16]。因此,能否有效控制RA-FLS 的增殖是治疗RA 的关键。 目前,雷公藤多苷在RA 的治疗中显示出了显著的临床疗效,并成为RA 相关研究中常用的阳性药物[17]。 如研究:苗药金乌健骨方对RA-FLS 细胞自噬以及IL-17/IL-17R 的影响[18-19]、自拟蠲痹补肾方含药血清对RA-FLS 细胞增殖与凋亡的影响[20],以及红景天含药血清对TNF-α 诱导的RA-FLS 增殖的影响[21]等,都将雷公藤多苷作为阳性药物对照。
有研究表明,RA 的发病机制亦涉及各种细胞因子和细胞的复杂网络,这些细胞因子和细胞会触发滑膜细胞增殖并导致软骨和骨的损伤[22]。其中,炎症相关的细胞因子在RA 的发病过程中发挥重要作用,如促炎因子IL-1β、IL-6 以及IFN-γ 分别通过影响破骨细胞的发育,刺激中性粒细胞迁移、破骨细胞成熟和血管内皮生长因子刺激的血管翳增殖以及破坏软骨和骨骼,促进RA 的发生[2,23-24]。 同时,有令人信服的证据支持EGFR、NF-κB、AKT 和JNK 信号通路也参与RA 的病理调节[12,25-28]。 具体来说,EGFR靶向的FLS、内皮细胞和破骨细胞在RA 的发病机制中起主要作用[25]。 NF-κB 和JNK 是RA 等免疫性疾病的两种关键调节剂,通过诱导炎症介质的表达,在炎症调节中起着重要作用[26,29-30]。AKT 通路是NF-κB的上游分子,是参与RA 发病的重要细胞内通路[12,27]。因此,抑制EGFR、NF-κB、AKT 和JNK 信号通路被认为是治疗RA 的关键靶点和有效的治疗策略。 据报道,使用厄洛替尼抑制EGFR 可改善胶原诱导的小鼠关节炎[25]。 此外,通过阻断MH7A 细胞NFκB/AKT/JNK 信号通路,可以抑制TNF-α 刺激的炎症反应[28]。 同样地,YANG 等[31]研究发现,苯丙素化合物通过调节NF-κB/AKT/JNK 信号通路显示出抗RA 的作用。
羊踯躅是一种常用的药用植物,其根、叶、花和果实均可入药,在民间医学中常用于治疗RA[6]。 有研究表明,羊踯躅中的二萜组分能显著降低IL-6、IL-1β 和TNF-α 的水平,可明显缓解RA 的症状,效果类似于雷公藤多苷[9]。 LUO 等[32]研究发现,羊踯躅提取物在体内能抑制完全弗氏佐剂诱导的大鼠关节炎的后足肿胀,降低关节炎指数,在体外能显著抑制TNF-α、IL-1β、IL-6、环氧合酶-2(cyclooxygenase-2,COX-2)和NO 的水平,从而起到抗RA 的作用。
本研究通过TNF-α 诱导RA 细胞模型,以雷公藤多苷作为阳性对照,探究了羊踯躅含药血清对TNF-α诱导的RA-FLS 增殖及炎症因子分泌的作用及机制。 本次体外实验发现,相比于正常的RA-FLS,TNFα 处理的细胞的增殖活性和IL-1β、IL-17A、IL-6、IL-2 和IFN-γ 的水平、EGFR 的表达及AKT1、c-JUN 和p65 的磷酸化水平显著升高。 而羊踯躅含药血清能显著降低TNF-α 诱导的RA-FLS 增殖活性和IL-1β、IL-17A、IL-6、IL-2 和IFN-γ 的水平。 此外,羊踯躅含药血清还降低了RA-FLS 中EGFR 的表达及AKT1、c-JUN 和p65 的磷酸化水平。 综上所述,羊踯躅含药血清能抑制TNF-α 诱导的RA-FLS增殖及促炎因子的分泌,其机制可能与对EGFR、NFκB、AKT 和JNK 通路的调控有关。 本研究为后续从羊踯躅中开发出治疗RA 的新药提供了依据,未来将进行体内实验以进一步验证羊踯躅提取物对RA的治疗作用。

